沙利度胺联合化疗治疗晚期肺癌血清VEGF和IL-6水平分析
2015-11-26武变荣张秀峰闫国亮滨海新区大港医院天津大港300270
武变荣,张秀峰,闫国亮(滨海新区大港医院,天津大港 300270)
沙利度胺联合化疗治疗晚期肺癌血清VEGF和IL-6水平分析
武变荣,张秀峰,闫国亮
(滨海新区大港医院,天津大港 300270)
目的:分析沙利度胺联合化疗治疗晚期肺癌前后患者血清VEGF和IL-6水平的变化。方法:60例肺癌患者随机分为治疗组和对照组,每组30例。对照组患者使用GP方案治疗,治疗组患者应用GP方案+沙利度胺,治疗2个周期后评价疗效,并检测患者治疗前后血清血管内皮生长因子(VEGF)和白介素-6(IL-6)水平。结果:两组治疗有效率比较差异无统计学意义(P>0.05)。治疗组治疗有效者治疗后血清VEGF水平明显低于治疗前(P<0.05);对照组治疗有效者治疗前后血清VEGF水平比较差异无统计学意义(P>0.05)。两组治疗有效者治疗后血清IL-6水平均明显低于治疗前(P<0.05)。两组治疗无效者治疗后血清VEGF和IL-6水平均明显高于治疗前(P<0.05)。结论:晚期肺癌患者治疗前后血清VEGF和IL-6的水平变化可作为肺癌患者疗效预测的参考指标。
晚期肺癌;沙利度胺;联合化疗;VEGF;IL-6
上世纪Meta分析证实,化疗比最佳支持治疗有更多临床受益,故其一直为晚期非小细胞肺癌(NSCLC)的主导治疗,但一线化疗有效率仅为25%-35%、一年生存率为30%-45%。肺癌是一种恶性程度较高的肿瘤,其发生、发展和转移与血管生成密切相关,抗血管生成治疗在肺癌治疗中占有重要地位。但由于抗血管生成治疗不能直接杀死肿瘤细胞,单独应用不能治愈肿瘤,常需与其它传统疗法联合应用。沙利度胺又称反应停,能通过抑制血管生成、刺激免疫系统活性、抑制癌细胞对间质的黏附等作用抑制肿瘤的发生发展,因而具有抗肿瘤作用的潜能。沙利度胺抗血管生成作用的可能机制与抑制新生血管形成的促进因子有关,如血管内皮生长因子(VEGF)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)和碱性成纤维细胞生长因子(bFGF)等。本研究评价了沙利度胺联合化疗治疗晚期肺癌的临床疗效,并分析了治疗前后血清VEGF 和IL-6水平的变化。
1 资料与方法
1.1 临床资料 2010年8月-2012年3月入组晚期肺癌患者60例,男32例、女28例,年龄38-67岁,中位年龄54岁,均为初治患者,治疗前血常规、肝、肾功能正常,预计生存期>3个月,有可评价疗效的观察指标。入组前3个月无特殊治疗。病理类型:腺癌32例,鳞癌21例,腺鳞癌5例,大细胞癌2例。患者随机分为治疗组和对照组,每组30例,两组患者性别、年龄、ECOG评分、病理类型、临床分期及转移情况比较差异无统计学意义(P>0.05)。
1.2 治疗方案 治疗组:GP方案+沙利度胺,吉西他滨(GEM)1000mg/m2,加入氯化钠注射液250ml,静脉滴注30min,d1;顺铂(DDP)75mg/m2,加入氯化钠注射液250ml,分3天静脉滴注;沙利度胺200mg/d口服,第1天起连续给药21天。对照组:单用GP方案化疗,剂量、方法同治疗组。治疗2个周期后评价疗效。
1.3 检测方法 两组患者治疗前和治疗后抽取空腹肘静脉血3ml,离心后分离血清,-80℃冰箱保存。采用双抗夹心ELISA法检测VEGF和IL-6水平。
1.4 评定标准 参照实体瘤疗效评价标准(RESICT1.0):完全缓解(CR),所有目标病灶消失;部分缓解(PR),基线病灶长径总和缩小≥30%,稳定(SD):基线病灶长径总和有缩小但未达到PR,或有增加但未达到进展(PD);PD:基线病灶长径总和增加≥30%。客观有效率(RR)=CR+PR。
1.5 统计分析 采用SPSS 17.0软件进行统计分析,计数资料行卡方检验,计量资料行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 治疗组和对照组均无完全缓解的病例,治疗组与对照组有效率比较差异无统计学意义(P>0.05)。见表1:
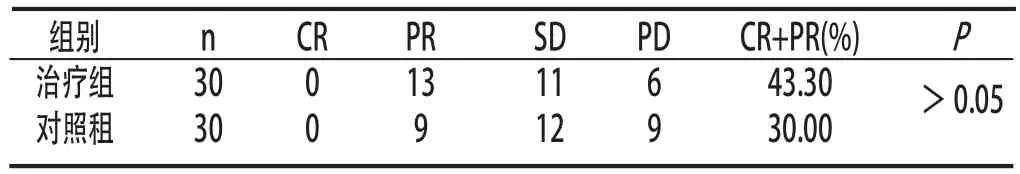
表1 两组患者临床近期疗效
2.2 两组患者治疗前后血清VEGF和IL-6水平 治疗组治疗后血清VEGF水平与治疗前比较差异无统计学意义(P>0.05);对照组治疗后血清VEGF水平明显高于治疗前(P<0.05)。治疗组治疗后血清IL-6水平明显低于治疗前(P<0.05);对照组治疗后血清IL-6水平与治疗前比较差异无统计学意义(P>0.05)。见表2:
表2 两组患者治疗前后血清VEGF和IL-6水平比较(±s)
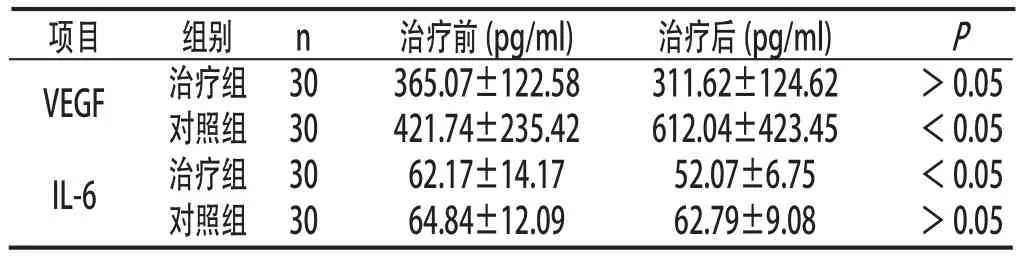
表2 两组患者治疗前后血清VEGF和IL-6水平比较(±s)
项目 组别 n 治疗前(pg/ml) 治疗后(pg/ml) P VEGF 治疗组 30 365.07±122.58 311.62±124.62 >0.05对照组 30 421.74±235.42 612.04±423.45 <0.05 IL-6 治疗组 30 62.17±14.17 52.07±6.75 <0.05对照组 30 64.84±12.09 62.79±9.08 >0.05
2.3 两组治疗有效者治疗前后血清VEGF和IL-6水平治疗组治疗有效者治疗后血清VEGF水平明显低于治疗前(P<0.05);对照组治疗有效者治疗前后血清VEGF水平比较差异无统计学意义(P>0.05)。治疗组、对照组治疗有效者治疗后血清IL-6水平均明显低于治疗前(P <0.05)。见表3:
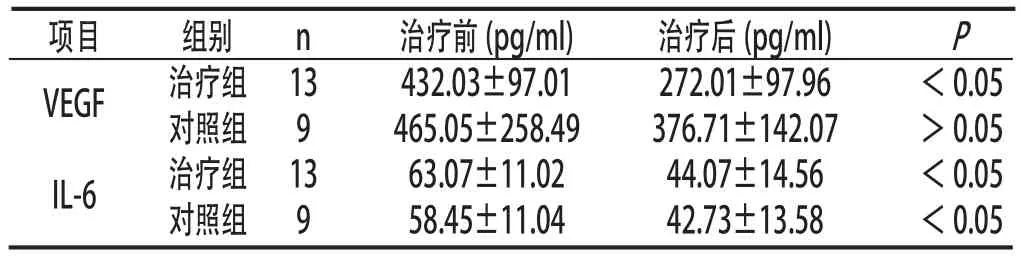
表3 两组治疗有效者治疗前后血清VEGF和IL-6水平比较(±s)
2.4 两组治疗无效者治疗前后血清VEGF和IL-6水平两组治疗无效者治疗后血清VEGF和IL-6水平均明显高于治疗前(P<0.05)。见表4:
表4 两组治疗无效者治疗前后血清VEGF和IL-6水平比较(±s)
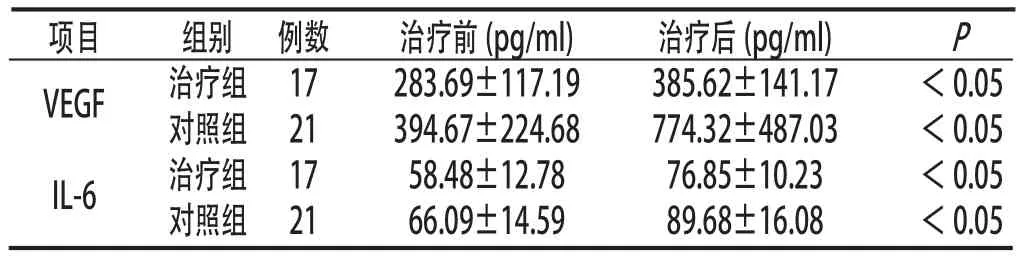
表4 两组治疗无效者治疗前后血清VEGF和IL-6水平比较(±s)
项目 组别 例数 治疗前(pg/ml) 治疗后(pg/ml) P VEGF 治疗组 17 283.69±117.19 385.62±141.17 <0.05对照组 21 394.67±224.68 774.32±487.03 <0.05 IL-6 治疗组 17 58.48±12.78 76.85±10.23 <0.05对照组 21 66.09±14.59 89.68±16.08 <0.05
3 讨论
化疗为80%以上NSCLC的常用治疗手段,但有效率低,仅为25%-35%,中位生存期仅为8-10月,1年生存率为30%-40%[1-2]。自上世纪70年代Folkman等提出了“肿瘤生长、转移依赖于血管生成”后,抗血管生成治疗已成为肿瘤治疗的主要研究方向。有研究证明,血管生成是决定肿瘤大小和局部、远处转移的关键因素,稳定瘤灶同样可带来临床受益,延长生存[3]。在贝伐单抗治疗NSCLC观察中,单纯化疗和联合贝伐单抗的客观有效率分别为10% 和27.2%,并将MST延长至1年以上[4];化疗联合贝伐单抗治疗复发NSCLC也明显延长了疾病进展时间(PFS)[5]。国内研究显示,与单纯化疗比较,化疗联合血管内皮抑素治疗NSCLC能明显提高初、复治者的临床受益率、TTP及生存时间[6]。虽然抗血管生成治疗取得了较好的效果,但由于价格昂贵,很多患者难以接受。
研究表明,几乎所有实体瘤的生长和转移均依赖于肿瘤血管的形成。VEGF是血管内皮细胞高度特异的有丝分裂原,能刺激细胞增殖,促进新生血管形成及血管内成分的渗漏,进而促进肿瘤细胞的转移[7]。VEGF可通过旁分泌和自分泌两种途径参与肿瘤血管生成;对淋巴管内皮细胞同样具有促分裂和增殖作用,可诱导淋巴管生成[8]。因此,VEGF过度表达引起肿瘤血管生成和淋巴结转移。国内外大量研究显示,VEGF在肺癌表达增高,且与肿瘤的分级、分期有关,可作为判断恶性程度及预后的指标。IL-6是肺癌的自分泌生长因子,可由肿瘤细胞产生[9]。Siem iń ska等[10]研究发现,大多数肺癌患者血清IL-6水平升高,经12个月的治疗后,治疗有效者血清IL-6水平均下降;而治疗无效者肺癌则不断进展,并伴有IL-6水平的不断升高,提示IL-6可能是肺癌患者预后不良的指标。
沙利度胺又称反应停,近年来基础研究和临床实验均证实,沙利度胺能通过抑制血管生成、刺激免疫系统活性、抑制癌细胞对间质的黏附等作用抑制肿瘤的发生发展,因而具有抗肿瘤作用的潜能;另外,沙利度胺还有较好的后续治疗作用,部分研究已证实,血管生成抑制剂在引起新生血管退化的同时,可以引起瘤体的消退。本研究的目的在于评价沙利度胺联合化疗治疗晚期肺癌的临床疗效并比较治疗前后血清VEGF和IL-6水平的变化。结果显示,治疗组治疗前后血清VEGF水平无明显变化,对照组治疗后明显升高;治疗组治疗后血清IL-6水平下降明显,对照组无明显变化;治疗组有效者治疗后血清VEGF、IL-6水平较治疗前明显下降。提示血清VEGF、IL-6水平可作为沙利度胺联合化疗治疗晚期肺癌疗效判断的参考指标。同时,与单纯化疗比较,沙利度胺联合化疗虽能改善晚期肺癌患者的治疗有效率,但组间比较差异无统计学意义,可能原因是沙利度胺作为血管内皮抑制剂需要长期持续服用,传统治疗之后处于肿瘤消退期的患者应用血管生成抑制剂有可能使微小转移处于静息状态,从而控制肿瘤的转移和复发,有较好的后续治疗作用。
总之,本研究显示,与单纯化疗比较,沙利度胺联合化疗能明显降低血清VEGF和IL-6水平,提示血清VEGF、IL-6水平可作为沙利度胺治疗晚期肺癌疗效预测的参考指标。
[1]Aberle DR, Broen K. Lung cancer screening with CT[J]. Clinics in Chest Medicine, 2008, 29(1): 1-14.
[2]Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4): 225-249.
[3]Cesano A, Lane SR, Ross GA, et al. Stabilization of disease as an indicator of clinical benef it associated with chemotherapy in non-small cell lung cancer patients[J].Int J Oncol, 2000, 17(3):587-590.
[4]Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J]. N Engl J Med, 2006, 355 (24): 2542-2550.
[5]Di Costanzo F, Mazzoni F, Micol Mela M, et al. Bevacizumab in non-small cell lung cancer[J]. Drugs, 2008, 68(6):737-746.
[6]王金万,孙燕,刘永煜,等.重组人血管内皮抑素联合NP方案治疗晚期NSCLC随机、双盲、对照、多中心Ⅲ期临床研究[J].中国肺癌杂志,2005,8(4):283-290.
[7]Linderholm B, Tavelin B, Grankvist K, et al. Vascular endothelial growth factor is of high prognostic value in node-negative breast carcinoma[J]. J Clin Oncol, 1998, 16(9):3121-3128.
[8]李恩孝.恶性肿瘤分子靶向治疗[M].北京:人民卫生出版社,2007.1-10.
[9]Kishimoto T. Interleukin-6: from basic science to medicine--40 years in immunolgy[J]. Annu Rev Immunol, 2005, (23): 1-21.
[10]Siemińska L, Wojciechowska C, Kos-Kudła B, et al. Serum concentrations of leptin, adiponectin, and interleukin-6 in postmenopausal women with Hashimoto's thyroiditis[J]. Endokrynol Pol, 2010, 61(1):112-116.
ANALYSIS OF VEGF AND IL-6 LEVEL IN SERUM OF ADVANCED LUNG CANCER PATIENTS TREATED WITH THALIDOMIDE COMBINED CHEMOTHERAPY
WU Bian-rong, ZHANG Xiu-feng, YAN Guo-liang
(Dagang Hospital of Binhai New Area, Tianjin Dagang 300270, China)
Objective:To analyze the changes of VEGF and IL-6 level in serum of advanced lung cancer patients treated with thalidomide combined chemotherapy.Methods:60 cases lung cancer patients were randomly divided into treatment group and control group with 30 patients in each group. The patients in control group were treated with GP chemotherapy regimens, while the patients in treatment group were treated with GP chemotherapy regimens combined thalidomide. The curative effects were evaluated after 2 treatment cycles. And the vascular endothelial growth factor (VEGF)and interleukin-6 (IL-6) level in serum were detected respectively before and after treatment.Results: There had no statistical signifi cance about effi ciency of clinical treatment between treatment group and control group (P>0.05). After treatment,the VEGF level in serum of response patients in treatment group was obviously lower than that before treatment (P<0.05). There had no statistical signifi cance about VEGF level of response patients in control group before and after treatment (P >0.05). After treatment, the IL-6 level in serum of response patients in 2 groups were all obviously lower than that before treatment (P<0.05). The VEGF and IL-6 level in serum of negative patients after treatment in 2 groups were all signifi cantly higher than that before treatment (P<0.05). Conclusions:Serum level of VEGF and IL-6 may provide predictive value for clinical effects of advanced lung cancer patients.
Advanced lung cancer; Thalidomide; Combined chemotherapy; VEGF; IL-6
R734.2
A
1004-6879(2015)01-0017-03
2014-05-14)
