不同寄主来源的葡萄霜霉病菌致病力测定及孢子囊大小比较
2015-11-25黄晓庆孔祥久孔繁芳刘薇薇王玉倩王忠跃
黄晓庆, 孔祥久, 孔繁芳, 刘薇薇,王玉倩, 王忠跃, 张 昊
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
不同寄主来源的葡萄霜霉病菌致病力测定及孢子囊大小比较
黄晓庆, 孔祥久, 孔繁芳, 刘薇薇,王玉倩, 王忠跃*, 张 昊*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
对采自我国不同地区、不同主栽葡萄品种‘红地球’、‘巨峰’及‘赤霞珠’上的12份葡萄霜霉病菌的致病力及孢子囊大小进行了比较和分析,结果表明:采自不同葡萄品种的病原菌对感病葡萄品种‘奥迪亚无核’叶片的致病力具有明显差异,其中‘巨峰’及‘红地球’来源的病原菌致病性较强,明显大于‘赤霞珠’来源的病原菌致病力;采自不同葡萄品种的霜霉病菌孢子囊大小存在一定的差异,‘赤霞珠’来源的病原菌孢子囊明显大于‘巨峰’及‘红地球’来源的霜霉病菌孢子囊。上述结果表明,采自不同寄主的葡萄霜霉病菌的致病力及孢子囊大小均存在一定程度的分化。
葡萄霜霉病菌; 致病力; 孢子囊大小
葡萄(Vitisspp.)是世界上栽培历史最悠久的植物之一,葡萄鲜果及其产品具有多种价值,随着人民生活水平的提高,对无公害葡萄及其产品的需求也逐渐增加,葡萄产业向着健康、优质、绿色的方向发展是大势所趋。由葡萄霜霉病菌[Plasmoparaviticola(BerketCurtis) Berl.etde Toni](卵菌门,卵菌纲,霜霉目,霜霉科,单轴霉属)引起的葡萄霜霉病是危害葡萄最严重的病害之一,目前,世界上几乎所有的葡萄产区都有葡萄霜霉病的发生。一般年份,葡萄霜霉病引起的损失在5%左右,流行年份,可达20%~80%,严重制约了世界及我国葡萄产业的健康发展[1]。
葡萄霜霉病菌可以侵染葡萄的任何绿色幼嫩组织,主要危害叶片,造成叶片病斑,致使叶片早衰、脱落,从而使与叶片光合作用有关的所有生理过程受阻,若防治不及时,对整个植株的长势、产量及品质都会造成严重的影响[2]。
国外的相关研究表明,采自不同寄主的葡萄霜霉病菌表现出明显的寄主专化性,并且不同来源的霜霉病菌的孢子囊形态具有明显的差异[3]。2013年,刘旭等对采自不同地区‘红地球’的霜霉病菌菌株的生物学特性和致病力进行了比较,发现来自同一寄主不同地区菌株的孢子囊形态及致病力差异较小[4],而不同品种来源的葡萄霜霉病菌的致病力及孢子囊形态是否存在差异,与相应的寄主之间是否存在一定的相关性,目前尚不清楚。上述问题对于霜霉病菌群体的遗传多样性、预测预报及综合防治问题至关重要,因此,笔者对采自不同寄主的霜霉病菌的致病力以及孢子囊形态进行了分析和比较。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
供试菌株分别采自‘巨峰’(V.labrusca×V.vinifera‘Kyoho’)、‘红地球’(V.vinifera‘ Red Globe’)、‘赤霞珠’(V.vinifera‘Cabernet Sauvignon’)3个葡萄品种,具体的信息见表1。

表1 供试葡萄霜霉病菌菌株来源
1.1.2 接种材料
接种材料为栽于中国农业科学院植物保护研究所温室的‘奥迪亚无核’(V.vinifera‘Otilia’)扦插苗。
1.2 试验方法
1.2.1 病原菌的采集与培养
采集的病样要求尽可能新鲜、纯净、无杂菌,并且未施用杀菌剂。采集的病叶先用蒸馏水冲洗2~3次,然后置于底部铺有2层湿润滤纸的培养皿内,25 ℃,L∥D=16 h∥8 h保湿培养,待病叶上长出新的浓密菌层,备用。
1.2.2 接种材料的培养
先将老熟的葡萄枝条用水浸泡24 h,使其吸收充足的水分,然后将枝条剪成小段(2~3芽/段),将剪短的葡萄枝条依次置于75%的乙醇1 min,5%的次氯酸钠20 min进行表面消毒,然后立即用无菌水漂洗3次,最后将消毒过的枝条的下端置于0.005 g/mL的生根粉中浸泡,以促进枝条的萌发。然后将沙土、蛭石(1∶3)的混合物置于121 ℃湿热灭菌30 min;将用生根粉处理过的枝条,扦插于灭菌土中,置于温室的光照培养架上(温度25 ℃,相对湿度65%,L∥D=16 h∥8 h)培养。
1.2.3 致病力测定
致病力试验采用圆叶盘接种法。将采自不同寄主上的霜霉病菌接种到欧亚感病品种‘奥迪亚无核’上,观察不同寄主来源的病原菌在同一感病材料上的致病力是否存在差异。具体的接种方法如下:
采集距葡萄苗顶端第5~6片叶作为接种材料,将收集的新鲜叶片用蒸馏水冲洗3次后于滤纸上晾干,之后使用直径为11 mm的打孔器在无菌条件下将其打制成新鲜的叶盘,叶背朝上置于1%的水琼脂培养基上备用;将来自不同寄主的霜霉病菌配制成含孢子囊1×105个/mL的悬浮液,每个叶盘上滴加20 μL,同时以滴加蒸馏水的叶盘作为阴性对照,每份样品接种60个叶盘,(每皿20个,共3皿),将其置于光照培养箱(25 ℃)中黑暗培养24 h之后,用滤纸吸去多余的菌液继续正常培养(25 ℃,L∥D=16 h∥8 h)。
于接种后3~9 d调查发病情况。记录初始发病天数、9 d病叶数及发病级数。根据农业部农药田间药效试验准则制定的分级标准[5],葡萄霜霉病病害严重度可分为6个级别:
0级:无病斑;
1级:发病面积占整个叶面积的6%以下;
3级:发病面积占整个叶面积的6%~10%;
5级:发病面积占整个叶面积的11%~20%;
7级:发病面积占整个叶面积的21%~50%;
9级:发病面积占整个叶面积的50%以上。
根据统计的结果,计算发病率及病情指数。
发病率(%)=发病叶盘数/调查总叶盘数×100;
病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)。
1.2.4 不同寄主霜霉病菌孢子囊大小的测定
在上述采集的新鲜病样上直接挑取少量菌丝,配成孢子囊悬浮液,制成玻片置于10×40倍显微镜下测量其孢子囊大小,每个样品随机测量100个孢子囊的长和宽,并对其进行方差分析。
2 结果与分析
2.1 致病力测定结果
不同寄主来源霜霉病菌接种于‘奥迪亚无核’的致病力结果(表2)表明,不同来源的霜霉病菌致使‘奥迪亚无核’发病的初始时间、9 d发病率及病情指数都有所不同,其中‘巨峰’来源的霜霉病菌在‘奥迪亚无核’上的潜育期最短,9 d发病率及病情指数都较高;而‘赤霞珠’来源的霜霉病菌潜育期较长,9 d发病率及病情指数相对较低。对其病情指数的统计分析结果表明,不同来源的霜霉病菌的致病力存在显著差异(F=3.48,P<0.05),其中采自河北石家庄-2‘巨峰’上的菌株致病力显著大于其他菌株,9 d病情指数高达55.56;采自河北昌黎-1‘赤霞珠’上的菌株致病力显著低于其他菌株。
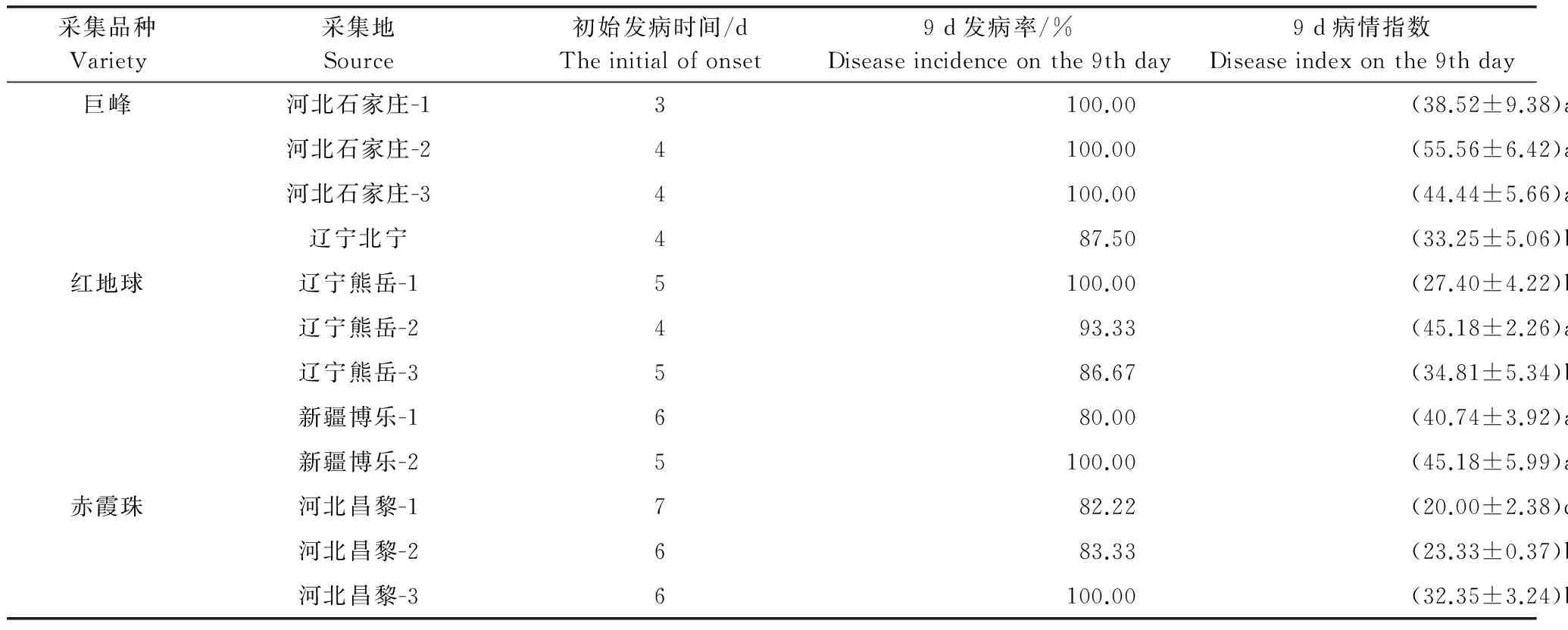
表2 不同葡萄品种来源的菌株致病力测定结果1)
1) 表中数据为平均数±标准误;同列不同字母表示经Tukey’s HSD多重比较在0.05水平差异显著。
Data are presented as mean±SE.Data with different letters in the same column are significantly different at 0.05 level.
将上述收集的菌株按照品种来源划分为不同的群体,统计结果表明,不同群体之间的葡萄霜霉病菌的致病力存在显著差异(F=4.37,P<0.05)(图1~2)。其中,采自‘赤霞珠’的霜霉病菌的致病力显著小于其他两个品种,而‘巨峰’与‘红地球’群体的霜霉病菌致病力差异不显著;同一品种来源群体内来自不同地区的霜霉病菌菌株之间的致病力没有明显的差异,例如同是采自‘巨峰’葡萄的辽宁北宁菌株与河北石家庄1号和3号菌株之间的致病力无显著差异;同是采自‘红地球’葡萄的新疆地区与辽宁地区的霜霉病菌菌株之间的致病力也没有显著差异。说明不同品种来源的霜霉病菌致病力存在着一定程度的分化。

图1 不同品种来源的霜霉病菌的致病力比较Fig.1 Pathogenicity analysis of isolates from different varieties

图2 不同寄主来源的葡萄霜霉病菌接种结果Fig.2 P.viticola isolates from different grape varieties inoculated on V.vinifera ‘Otilia’
2.2 不同来源霜霉病菌孢子囊大小
对不同来源的葡萄霜霉病菌孢子囊大小进行测量,结果(表3)表明,不同来源葡萄霜霉病菌的孢子囊大小存在显著差异(F=36.18,P<0.05),其中最大的孢子囊长度可达39.69 μm,最小的孢子囊长度为12.16 μm,最大的孢子囊宽度可达23.07 μm,最小的孢子囊宽度为9.13 μm。

表3 不同来源葡萄霜霉病菌的孢子囊大小1)
1) 表中数据为平均数±标准误;同列不同字母表示经Tukey’s HSD多重比较在0.05水平差异显著。
Data are presented as mean±SE.Different letters in the same column indicate significant difference at 0.05 level.
为进一步明确孢子囊大小的变化规律,将上述菌株按品种来源分为不同的群体,进行群体内及群体间孢子囊大小的比较。不同品种来源的霜霉病菌群体间的孢子囊长度(F=64.89,P<0.05)和宽度(F=111.90,P<0.05)均存在显著差异(图3),其中‘赤霞珠’来源的病原菌孢子囊长和宽显著大于其他品种,‘红地球’、‘巨峰’来源的病原菌孢子囊长和宽无显著差异;而采自同一品种不论是同一地区来源还是不同地区来源的霜霉病菌的孢子囊大小都存在显著差异(图4),因此病原菌的孢子囊大小与相应的采集地区之间目前没有发现明显的相关性。但是不同品种来源的霜霉病菌孢子囊大小确实存在一定程度的分化。

图3 不同品种来源的葡萄霜霉病菌群体孢子囊大小Fig.3 Sporangia size of P.viticola isolates from different grape varieties

图4 同一寄主来源的葡萄霜霉病菌群体内孢子囊大小的比较Fig.4 Sporangia size of P.viticola isolates from the same grape variety
3 讨论
葡萄霜霉病菌作为一种活体营养寄生菌,其室内接种方法主要有以下几种:离体叶片接种、新鲜葡萄枝条接种、圆叶盘接种以及试管苗接种等,其中圆叶盘接种方法因其节省空间,节约接种材料,并且与田间反应最为接近,而得到广泛的认可和应用[6-11]。
本研究通过叶盘接种试验对霜霉病菌的致病力进行测定,结果显示不同菌株对同一接种材料的致病性不同,并且不同品种来源的霜霉病菌群体之间的致病力差异显著,来自欧美杂交种‘巨峰’、欧亚种‘红地球’的病原菌致病力相近,其显著大于‘赤霞珠’来源的菌株。说明不同品种来源的菌株致病力存在着一定程度的分化。由于目前葡萄霜霉病菌的致病力测定还没有一套标准、有效、统一的寄主,因此在不同的研究中采用的致病力测定寄主可能有所不同。欧亚种‘奥迪亚无核’因其高度感染霜霉病菌的特性,而被作为本试验的接种材料。但葡萄霜霉病菌作为一种专性寄生菌,活菌的保存和扩繁都有一定的难度,因此很难在短时间内同时获得大量新鲜的采自不同寄主的病原菌,这在一定程度上限制了本研究对其致病力的进一步测定及验证。
对不同来源的霜霉病菌孢子囊形态进行观察,发现不同品种上霜霉病菌的孢子囊大小具有明显差异,来源于‘赤霞珠’的霜霉菌的孢子囊显著大于其他品种,而来源于‘红地球’及‘巨峰’的病原菌孢子囊差异不大。同一品种不同地区来源的霜霉病菌孢子囊大小也存在显著差异,说明不同来源的霜霉菌在孢子囊形态上确实存在着一定程度的分化。这与Savulescu、Golovina及Kump对孢子囊形态的观察结果一致[12],但本试验对于同一品种不同地区之间病原菌孢子囊大小的比较结果与刘旭的结果有所不同,这可能与这些因素更易受环境条件的影响有关,尚需要进一步的试验验证。
2013年,Rouxel通过交互接种试验证实了不同来源的霜霉病菌对不同葡萄品种的致病力不同,并结合孢子囊形态的比较及系统发育分析方法,发现采自美洲的霜霉病菌是一个复合群体,其可能由4种不同的专化型组成[3],目前中国没有相关报道。病原菌致病力测定及孢子囊形态的比较对其群体遗传结构的研究具有重要意义,本试验针对我国主栽葡萄品种上的葡萄霜霉病菌的致病力及孢子囊形态的分化进行了初步探索,但对于霜霉病菌群体学的研究,仍需进一步结合分子生物学手段进行相关试验。
[1] 王忠跃.中国葡萄病虫害与综合防控技术[M].北京:中国农业出版社,2009.
[2] 刘世秋,郭锐,张军翔.宁夏贺兰山东麓葡萄灰霉病的发生与综合防治[J].中外葡萄与葡萄酒,2012(4):38-40.
[3] Rouxel M, Mestre P, Comont G, et al. Phylogenetic and experimental evidence for host-specialized cryptic species in a biotrophicoomycete [J].New Phytologist, 2013, 197(1):251-263.[4] 刘旭, 梁曼, 王阳, 等. 不同地区葡萄霜霉病菌生物学特性及致病力研究[J].北方园艺, 2013 (6):119-122.
[5] 农业部农药检定所. 农药田间药效试验准则[S].北京:中国标准出版社,2000.
[6] Liu S M, Sykes S R, Clingeleffer P R.A method using leafed single-node cuttings to evaluate downy mildew resistance in grapevine [J].Vitis-Geilweilerhof, 2003, 42(4):173-180.
[7] Liu S M, Sykes S R, Clingeleffer P R.Variation between and within grapevine families in reaction to leaf inoculation with downy mildew sporangia under controlled conditions [J].Vitis-Geilweilerhof, 2008, 47(1):55.
[8] Brown M V, Moore J N, Fenn P, et al. Comparison of leaf disk, greenhouse, and field screening procedures for evaluation of grape seedlings for downy mildew resistance[J].HortScience, 1999, 34(2):331-333.
[9] Boso Alonso S, Kassemeyer H H.Different susceptibility of European grapevine cultivars for downy mildew [J].Vitis, 2008, 47(1):39-49.
[10]Sotolar R.Comparison of grape seedlings population against downy mildew by using different provocation methods [J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2007, 35: 61-68.
[11]Staudt G, Kassemeyer H H.Evaluation of downy mildew resistance in various accessions of wildVitisspecies[J].Vitis, 1995, 34(4):225-228.
[12]Gessler C, Pertot I, Perazzolli M.Plasmoparaviticola: a review of knowledge on downy mildew of grapevine and effective disease management [J].Phytopathologia Mediterranea,2011,50(1):3-44.
(责任编辑:王 音)
Pathogenicity and sporangia size analysis ofPlasmoparaviticolafrom different grape varieties
Huang Xiaoqing, Kong Xiangjiu, Kong Fanfang, Liu Weiwei, Wang Yuqian, Wang Zhongyue, Zhang Hao
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Twelve samples from different planting areas were collected on ‘Kyoho’, ‘Red Globe’ and ‘Cabernet Sauvignon’, which were mainly grape varieties in China. The pathogenicity was tested and the size of sporangia was measured. The results showed that the ability ofPlasmoparaviticolaisolates from different grape varieties to colonizeVitisvinifera‘Otilia’ leaf tissue differed significantly. Isolates from ‘Kyoho’ and ‘Red Globe’ were significantly more aggressive than those from ‘Cabernet Sauvignon’. And sporangia size from different grape varieties differed significantly too. Isolates from ‘Cabernet Sauvignon’ were significantly bigger than others. In conclusion, there were significant differences in aggressiveness and sporangia size among isolates from different hosts.
Plasmoparaviticola; pathogenicity; sporangia size
2014-04-21
2014-07-31
公益性行业(农业)科研专项(201203035);国家现代农业产业技术体系专项资金(nycytx-30)
S 436.631.1
A
10.3969/j.issn.0529-1542.2015.03.035
致 谢: 感谢国家葡萄产业体系各综合试验站为本研究提供的葡萄霜霉病样品。
* 通信作者 E-mail:wangzhy0301@sina.com; hzhang@ippcaas.cn
