不结球白菜霜霉病菌株生物学特性及致病力研究
2020-12-14文锴张雷王清明徐旋王璐璐
文锴 张雷 王清明 徐旋 王璐璐

摘要 为了研究不结球白菜霜霉病菌菌株生物学特征及致病力,以10份不结球白菜霜霉病病变叶为材料,收集、提取、培养并保存霜霉病菌菌株,测定菌株生物学特性,调查其病情指数。结果表明,当温度为6~25 ℃时,孢子囊均可萌发,18 ℃萌发率达到最大值;在相对湿度为98%~100%条件下,孢子囊均可萌发;在相对湿度为100%条件下,孢子囊萌发率达到最大值,在48 h萌发率达到最大。南京地区霜霉病菌孢子囊相对较大,天津地区霜霉病菌孢子囊相对较小。不结球白菜品种042-S2-1病情指数为4.80,为高抗;品种084-S2-6病情指数为68.15,为感病。Cc-nj2的侵染能力最强,Cc-nj3的侵染能力最弱。综合分析可知,不结球白菜品种042-S2-1和027-S2-1为抗病材料,084-S2-6为感病材料。
关键词 不结球白菜霜霉病;生物学特性;孢子囊;病情指数;致病力
中图分类号 S435.121.4+5 文献标识码 A
文章编号 1007-5739(2020)21-0131-03 开放科学(资源服务)标识码(OSID)
不结球白菜又叫青菜、小白菜,生長周期短、产量高、适应性广、种类繁多,对调节蔬菜市场供应具有重要作用。在多年的栽培生产过程中,不结球白菜病害高发,其中黑斑病、白粉病、霜霉病对产量影响较大。霜霉菌(Hyaloperonospora parasitica)是引起不结球白菜霜霉病的病原菌,霜霉病是不结球白菜生产上的一大病害,主要危害叶片,影响叶肉品质,尤其是影响苗期生长。不结球白菜霜霉病具有高发病率、强传染性等特点,大大降低了不结球白菜的产量,严重制约了我国不结球白菜产业的发展。据国内外有关报道,不同不结球白菜品种对霜霉病存在明显抗性差异,菌株对不同蔬菜品种的侵染能力存在明显差异,霜霉病伴随不结球白菜整个生长周期[1]。在春、秋季节,不结球白菜霜霉病菌株的致病能力比夏、冬季节更强。由于霜霉病菌株进化快速[2],化学杀菌剂对于新进化的霜霉病病菌的防治效果较差[3-4]。目前,通过对蔬菜的抗性基因研究和培育不结球白菜抗病品种是防治霜霉病最为有效的方法。由于蔬菜抗性较差,田间管理者为了降低霜霉病危害,通常每5~7 d喷施1次杀菌剂[5]。由于抗杀菌剂菌株群体缓慢出现,田间管理者将面对新的抗病难题[6]。致病型的真菌性状在蔬菜上呈现很多不同的特点,形态学上的差异给病原菌的鉴定与分类工作增加了难度,而霜霉菌侵染能力受其生理机制的影响。基于此,本文通过对不结球白菜霜霉病菌株生物学特性及致病力的研究,进一步探究不结球白菜品种的抗病性。
1 材料与方法
1.1 供试材料
供试不结球白菜品种为027-S2-1、SZQ、042-S2-1、084-S2-6和NHCC-020-S2-2。供试霜霉病菌株分别来自沈阳、天津和南京等地(表1),病叶采集后装于无菌密封箱,带回实验室备用,共计10份。收集的病菌要求未施用杀菌剂,且纯净、新鲜、无杂菌。采集病叶后,用蒸馏水冲洗3~4次,在18~25 ℃暗培养箱中保湿24~48 h,待出现新鲜且浓密的霜霉菌层,备用。
1.2 试验方法
1.2.1 孢子囊悬浮液制备。用灭菌的蒸馏水将采集的病叶表面污垢杂质冲洗干净后,用灭菌的滤纸充分吸干叶面水分,在温度18 ℃、湿度为100%的全黑暗培养箱中培养24~48 h。培养后用灭菌的毛笔轻轻刷下新鲜孢子囊,溶解到灭菌蒸馏水中配制孢子囊悬浮液。
1.2.2 不结球白菜霜霉病病菌孢子囊萌发方式。参照改进后崔铁军等[7]的方法,吸取少量新鲜孢子囊悬浮液制片,于显微镜下统计观察。
1.2.3 不结球白菜霜霉病病菌生物学特性测定。
(1)温度对不结球白菜霜霉病病菌孢子囊萌发的影响。将新鲜孢子囊悬浮液分别置于0、6、12、16、18、22、25 ℃条件下,于4、8、12、16、24 h后分别检测萌发率,每个处理3次重复。
(2)相对湿度对不结球白菜霜霉病病菌孢子囊萌发的影响。采集的病叶用蒸馏水冲洗干净后,置于温度为18 ℃,相对湿度分别为90%、95%、98%、100%的条件下培养。待长出菌层,于培养4、8、16、24、36、48 h分别显微镜制片检测孢子囊萌发率,每个处理3次重复。
1.2.4 不结球白菜霜霉病菌形态学观察。将每个品种的菌株分别置于光学显微镜和体式显微镜下观察。每个菌株在10×40倍显微镜下用显微测微尺随机测定,孢子囊数量不少于50个,计算孢子囊大小。
1.2.5 不结球白菜霜霉菌致病性研究。把菌源Cc-nj1分别接种于不结球白菜品种027-S2-1、SZQ、084-S2-6和042-S2-1。同时,于SZQ上分别接种菌源Cc-tj1、Cc-sy1、Cc-nj2和Cc-nj3,于NHCC-020-S2-2上接种菌源Cc-nj4和Cc-tj1,子叶期接种7 d后,肉眼结合体视显微镜进行观察统计,调查病情指数,于各品种不结球白菜子叶期以注射器注射的方式接种菌种。结果调查按叶片的病斑面积分级,记录病情指数。改良后的分级标准:0级,无病斑;1级,病斑微小,病斑面积占叶面积20%及以下;3级,病斑较大且面积占叶面积的20%~40%;5级,病斑面积占叶面积的40%~60%,病斑大且多;7级,病斑面积占叶面积的60%及以上,病斑多,存在局部坏死现象[8]。病情指数计算公式如下:
依病情指数(DI)将不结球白菜对霜霉病的抗性分为以下5级:高抗(HR),DI≤20;抗病(R),20
2 结果与分析
2.1 不结球白菜霜霉菌形态学结构观察
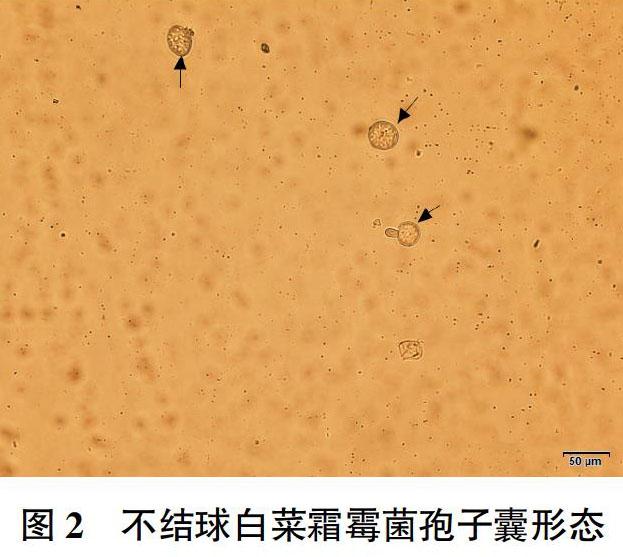
通过霜霉菌的形态观察发现,不结球白菜霜霉菌孢子梗有明显主干,存在分支,分支发达、细长且相互交织,孢子囊位于顶端且形成芽管,芽管可形成分支(图1),孢子囊呈球形或椭球形(图2)。
2.2 温度对不结球白菜霜霉菌孢子囊萌发的影响
在供试范围温度内,0 ℃条件下未发现孢子囊萌发,6~25 ℃均有孢子囊萌发,但6 ℃条件下前12 h未发现孢子囊萌发。孢子囊萌发率随温度升高呈先升后降的趋势,18 ℃条件下萌发率达到最大值(表2)。较高或较低的温度都会降低霜霉菌孢子囊的萌发率。
2.3 相对湿度对不结球白菜霜霉菌孢子囊萌发的影响
在供试相对湿度范围内,在相对湿度95%以下,孢子囊不萌发;在相对湿度98%~100%条件下,孢子囊均可萌发。相对湿度98%和100%条件下,孢子囊萌发率存在较大差异。在相对湿度100%条件下,孢子囊萌发率达到最大值,且在48 h萌发率达到最大(表3)。
2.4 不结球白菜霜霉菌孢子囊大小
从表4可以看出,南京地区霜霉菌孢子囊平均大小为22.02~32.57 μm×22.15~31.76 μm;天津地区孢子囊平均大小为19.17~22.55 μm×19.99~22.29 μm。综合比较可知,南京地区霜霉菌孢子囊相对较大,天津地区霜霉菌孢子囊相对较小。
2.5 不结球白菜霜霉菌致病性
由表5可以看出,根据子叶期发病情况,不同不结球白菜品种间发病率和发病指数有明显差异,发病率为4.80%~100.00%,病情指数为4.80~87.14。高抗品种为042-S2-1,病情指数为4.80;感病品种为084-S2-6,病情指数为68.15。Cc-nj2的侵染能力最强,使SZQ发病指数达87.14;Cc-nj3的侵染能力较弱,使SZQ发病指数为28.42。综合分析可知,不结球白菜042-S2-1和027-S2-1为抗病品种,084-S2-6为感病品种。
由表5可以看出,所有不结球白菜品种均可感染霜霉病菌。同一品种霜霉菌菌株对不同鉴别寄主的致病能力存在差异;不同霜霉菌菌株对同一种寄主的侵染力和致病性都存在差异。综合分析可知,不同区域的不结球白菜霜霉菌存在生理小种分化现象。
3 結论与讨论
霜霉菌传播主要以风为载体,主要寄生在叶片上,无性繁殖,适宜的温度和湿度有利于霜霉菌生长。对于不结球白菜霜霉病病原菌的防治,菜农多采用多菌灵治理,但效果不佳。基于此,本试验就不同温度和相对湿度等环境因素对不结球白菜霜霉病病原菌孢子囊萌发率的影响进行研究。研究发现,在供试条件下,孢子囊在6~25 ℃范围内均有萌发,但6 ℃条件下孢子囊萌发率低且前12 h未发现萌发,18 ℃为孢子囊萌发的最适温度,较高或较低温度都会使霜霉菌孢子囊的萌发力有一定程度下降。南京地区不结球白菜霜霉病高发于4月前后,这可能与18 ℃的最适温度有关。在供试相对湿度条件范围内,孢子囊在相对湿度为95%及以下基本不萌发;相对湿度为 98%时孢子囊萌发率低,且前16 h孢子囊不萌发,至 24 h孢子囊萌发率只有2%;相对湿度为100%时孢子囊萌发率达到最大,48 h萌发率达到14.0%,这表明水分条件是孢子囊萌发的必要条件。南京及长江中下游地区3—5月多雨天气,是霜霉病的高发期,这可能与100%的相对湿度是霜霉菌萌发最适相对湿度有关。
霜霉病是影响不结球白菜产量和品质的重要病害之一。不结球白菜霜霉菌为专性寄生菌,菌株不易保存,在一定程度上影响了不结球白菜霜霉病机理的研究。从病原物生物学特性和致病性入手对研究品种抗霜霉病发病机理具有重要意义[9]。通过接种方法的优化,接种后叶片发病周期短、重复性好,调查快捷、易操作,能快速测定不结球白菜品种的抗病性和霜霉菌菌株的致病性。根据统计结果,可将品种分为高抗、抗病、中抗、感抗和高感等5类,其中多为中抗或感病品种。Cc-nj2的侵染能力最强,Cc-nj3的侵染能力最弱,这可能与菌株的使用以及采集的地域差异有关,有待进一步研究。一般认为,接种后叶片出现局部坏死为过敏性坏死反应,坏死斑的出现能够隔离菌丝在叶片内部延伸,阻止霜霉病的进一步蔓延。
本研究明确了不结球白菜在不同环境下的生物学特性及致病性,以期为该病的发生与防治提供理论基础与依据。虽然本试验只对10种不结球白菜霜霉菌菌株进行研究,但选择的菌株代表性较强,且来自不同的地区和寄主,客观性较强,对菌株生理小种进一步鉴定具有一定的说服力。为进一步探究不结球白菜霜霉菌生理小种生物学特性和致病性差异,全国各个地区和不同气候条件下不结球白菜霜霉病病株的收集工作必不可少。
4 参考文献
[1] MONOT C,PAJOT E,CORRE D.Induction of systemic resi-stance in broccoli (Brassica oleracea var. italica) against dow-ny mildew (Peronospora parasitica) by a virulent isolates[J].Biological Control, 2002,24:75-81.
[2] GUNN N D,BEYNON J L,HOLUB E B.Outcrossing of two homothallic isolates of Peronospora parasitica and segregation of avirulence matching six resistance loci in Arabidopsis tha-liana[M].Dordrecht:Springer,2007,34:185-188.
[3] NASHAAT N I,HERAN A,MITCHELL S E.New genes for resistance to downy mildew (Peronospora parasitica) in oil-seed rape (Brassica napus spp. oleifera)[J].Plant Pathology,1998,46:964-968.
[4] SILUE D,NASHAAT N I,TIRILLY Y.Differential responses of Brassica oleracea and B. rapa accessions to seven isolates of Peronospora parasitica at the cotyledon stage[J].Plant Dise-ase,1996,80:142-144.
[5] GRANKE L L,MORRICE J,HAUSBECK M K.Relationships between airborne Pseudoperonospora cubensis sporangia,en-vironmental conditions,and cucumber downy mildew severity[J].Plant Disease,2014,98:674-681.
[6] WANG W,YAN L,MENG R,et al.Sensitivity to fluopicolide of wild type isolates and biological characteristics of fluopi-colide-resistant mutants in Pseudoperonospora cubensis[J].Crop Protection,2014,55:119-126.
[7] 崔鐵军,刘跃庭,罗加凤,等.寄生霜霉Peronospora parasi-tica(Pers.) Fr.孢子囊萌发方式的观察[J].菌物学报,2008,27(5):775-777.
[8] 赵雪艳,张玮,严红,等.不同葡萄品种对霜霉病的田间苗期抗性评价[J].植物保护,2014,40(5):172-175.
[9] 李明远.十字花科蔬菜霜霉病的发生与防治[J].当代蔬菜,2004(8):38-39.
作者简介 文锴(1990—),男,河北邢台人,硕士,研究实习员。研究方向:蔬菜育种。
收稿日期 2020-07-01
