小麦条锈菌hsp70基因的克隆及热胁迫下的表达特征分析
2015-11-25曹华宁刘太国陈万权
曹华宁, 刘 博, 刘太国, 高 利, 陈万权
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
小麦条锈菌hsp70基因的克隆及热胁迫下的表达特征分析
曹华宁, 刘 博*, 刘太国, 高 利, 陈万权*
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
为明确热激蛋白70在小麦条锈菌对高温适应性中的作用,采用RACE和PCR技术扩增得到小麦条锈菌hsp70的基因全长,并利用实时荧光定量PCR技术对热胁迫下不同温度敏感类型小麦条锈菌中hsp70的表达特征进行分析。克隆得到的小麦条锈菌hsp70基因组序列全长为2 817 bp,包含7个内含子,cDNA序列全长为2 267 bp,其中开放阅读框为1 917 bp,编码639个氨基酸,分子量为66.7 ku,等电点为5.15。编码蛋白含3个保守的HSP70氨基酸序列。qRT-PCR试验结果表明,28 ℃热激后,hsp70的转录水平随热激时间的延长而略有增加,2 h达到最高值。不同温度敏感类型菌株在热激2 h后hsp70的相对表达量具有显著差异。低敏感类型菌株hsp70平均表达量为未经处理对照的7.12倍,而高敏感类型菌株hsp70平均表达量仅为对照的1.63倍。
小麦条锈菌; 温度敏感类型; 热激蛋白70; 克隆; 荧光定量PCR
小麦条锈病是由条形柄锈菌小麦专化型(PucciniastriiformisWestend. f.sp.triticiEriks.,Pst)引起的世界范围内小麦生产上危害最为严重的一种病害,已成为影响小麦生产可持续发展的限制因素[1-2]。相比其他植物病原真菌,甚至同属的小麦秆锈菌和小麦叶锈菌,小麦条锈菌生长、繁殖与侵染活动均需要较低的温度[3-4],在冷凉潮湿的地区发病严重,是一种典型的低温病害。但近年来,不断有研究发现小麦条锈菌对温度的适应性有所增强[5-7]。Milus等在两种不同温度条件下(日均温14 ℃和20 ℃)对北美2000年前、后采集的条锈菌进行侵染力测定,结果发现无论是在低温还是高温条件下,2000年之后的条锈菌对高温有更强的适应性,具体表现为潜伏期更短、侵染面积扩展更快、产孢量更大。推测这些2000年之后的条锈菌可能在小麦生长季节中持续侵染时间更长,从而造成更严重的损失[5-6]。Mboup等结合室内试验与田间调查对采自法国南部及北部的小麦条锈菌进行了研究,结果表明与北部菌株相比,南部菌株对温暖的地中海气候表现出更强的适应性[7]。陈万权等在对云南、陇南等地的常年越夏调查中发现,小麦条锈菌在部分地区的越夏海拔已经发生50~300 m不同程度的下降[8]。王新俊等在对甘肃省平凉市越夏菌源分布区域精准勘测的研究中发现,夏季最热一旬旬均温 23~25 ℃的年份也可以查到小麦条锈菌的越夏菌源[9]。同样,全辉等发现在河南省淅川县低海拔地区(194~197 m近丹江水库边麦田),7-8月平均温度在24.8 ℃时条锈病菌也能正常越夏和快速繁殖传播[10]。肖志强等结合陇南50年来的气象数据对当地小麦条锈病的流行进行了分析,指出陇南山区近10年小麦条锈病流行程度逐年加重趋势与冬季显著的增暖趋势相一致,与1990s以前相比,条锈病越冬越夏高界明显提高了100~300 m,致使小麦条锈病危害范围扩大,发生时间提前[11]。以上各项研究结果均表明,小麦条锈菌群体对温度的适应性随着气候的变化在发生相应的调整,发病范围正在扩大,流行频率和严重度也在增加,推测其对温度的忍耐能力在全球气候变暖的环境下有所增强。
本研究组在2011年对来自西北、华北、长江中下游以及西南麦区不同年代(1980s、1990s、2000s、2010s)的126份小麦条锈菌样本的单孢堆分离菌株的温度敏感性进行了研究[8]。以病害抑制中温度(ET50)为标准将所有菌株划分为温度低敏感性、中敏感性和高敏感性3个类群。结果表明,自然条件下不同麦区小麦条锈菌群体对温度的耐受能力有所不同,总体趋势是越温暖的地区条锈菌群体对高温的耐受能力越强,海拔、纬度越低地区的小麦条锈菌群体ET50值越高,反之越低,不同年代的条锈菌株随着时间的推移耐高温能力增强。对3类温度敏感型代表菌株的寄生适合度测定结果表明:在14 ℃和22 ℃条件下,温度低敏感型菌株的寄生适合度都要高于其他两类,具体表现在潜育期短,扩展速度快,产孢量高等方面。说明温度低敏感型菌株的生长与繁殖能力高于其他类型菌株。
热激蛋白(heat shock proteins,HSPs)作为一类对体内外环境变化极为敏感的有机分子广泛参与各种生理代谢途径,是受高温、病原体及其他理化因素等刺激后所产生的一组在生物进化中高度保守的蛋白[12]。根据分子量的不同,HSPs可分为HSP100、HSP90、HSP70、HSP60以及小分子量热激蛋白(small HSP)。HSP70家族在正常细胞中水平较低,而在胁迫条件下可显著升高,因此成为广受关注,研究最为深入的一种热激蛋白[13]。Montero-Barrientos等的研究表明,哈茨木霉菌 (Trichodermaharzianum)T34经热激后,hsp70基因表达量增加[14]。谢翎等通过实时荧光定量PCR检测球孢白僵菌 (Beauveriabassiana)hsp70在高温诱导下的表达量,结果表明高温处理30 min时表达量最高,为对照的10.18倍,180 min时,表达量降到最低,为对照的2.85倍[15]。邢淑莲研究了热激后小麦白粉菌的hsp70表达量,发现28 ℃热激60 min后,小麦白粉菌hsp70基因的相对表达量达到最高峰,为对照样本的11.6 倍,随后表达量下降,推测hsp70基因在小麦白粉菌耐高温中有重要作用[16]。
本研究通过RACE技术对小麦条锈菌hsp70进行克隆、分析,并利用qRT-PCR分析了28 ℃热激条件下温度高、低敏感类型代表菌株hsp70的表达特征,表明不同温度敏感类型的菌株在热胁迫条件下hsp70的表达量存在差异,菌株的耐高温特性与热激蛋白的表达具有一定的关系。初步证实了HSP70在小麦条锈菌耐高温机制中的作用。
1 材料与方法
1.1 材料
所有供试菌株信息见表1,菌株经单孢堆分离纯化、扩繁后由本实验室保存。小麦条锈菌hsp70基因的克隆选用菌株11-6-4-1进行,qRT-PCR分析选取温度低敏感类型(耐高温菌株)及温度高敏感类型(不耐高温菌株)的代表菌株各3株进行。

表1 供试小麦条锈菌菌株
1.2 试剂
TRIzol试剂购自Invitrogen公司;SMARTer RACE cDNA Amplification Kit、Advantage 2 PCR Kit购自Clontech公司;反转录试剂盒(PrimeScript 1st Strand cDNA Synthesis Kit)、LATaq购自TaKaRa公司;DNA胶回收试剂盒购自北京天根生物公司;pEASY-T3载体及感受态细胞购自全式金生物公司;UltraSYBR Mixture (With ROX)购自康为世纪生物科技公司;引物由上海生工生物工程有限公司合成。
1.3 小麦条锈菌基因组DNA、总RNA的提取与cDNA合成
小麦条锈菌基因组DNA的提取方法参照Chen等[17]方法进行。采用TRIzol试剂提取新鲜以及各个处理条锈菌夏孢子的总RNA。cDNA第一链的合成参照TaKaRa反转录试剂盒说明进行。RACE扩增参照SMARTer RACE试剂盒说明进行。
1.4 小麦条锈菌hsp70 cDNA序列及基因组DNA序列扩增
采用李翠翠[18]设计的真菌hsp70基因的简并引物P1、P2(表2)扩增小麦条锈菌hsp70基因的核心片段。扩增反应体系(50 μL)为:10×TaqBuffer (Mg2+)2.5 μL、cDNA 2 μL、10 mmol/L dNTPs 2 μL、10 μmol/L引物各 1 μL、Taq酶 (5 U /μL)0.25 μL。PCR扩增程序为:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。
根据得到的核心片段序列设计5′ RACE和3′ RACE引物(表2)。5′ RACE扩增反应体系(50 μL):PCR-Grade Water 34.5 μL、10×Advantage 2 PCR Buffer 5.0 μL、dNTPs (10 mmol/L)1.0 μL、TaKaRa LATaq1.0 μL、5′-RACE-Ready cDNA 2.5 μL、UPM 5 μL、5′ RACE引物 1 μL。3′ RACE扩增反应体系(50 μL)同5′ RACE体系,但其中cDNA为3′-RACE-Ready cDNA,引物为3′ RACE引物。RACE扩增touchdown PCR反应程序:94 ℃ 3 min;94 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,70 ℃ 3 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,68 ℃ 3 s,72 ℃ 3 min,27个循环;72 ℃ 10 min。
根据获得的hsp70 cDNA序列,设计引物ghsp70-S1、ghsp70-AS1、ghsp70-S2、ghsp70-AS2、ghsp70-S3、ghsp70-AS3(表2),以条锈菌基因组DNA为模板,对hsp70的基因组全长进行扩增。扩增反应体系(50 μL):10×TaqBuffer (Mg2+)2.5 μL、DNA 2 μL、10 mmol/L dNTP 2 μL、10 μmol/L 正反向引物各 1 μL、Taq酶 (5 U /μL)0.5 μL。第1对引物扩增程序为94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,36个循环;72 ℃ 10 min。第2、3对引物扩增程序的退火温度分别为58 ℃和56 ℃。

表2 小麦条锈菌hsp70克隆及荧光定量PCR分析所用引物序列1)
1) 简并碱基H=ACT;R=AG;Y=CT;D=GAT;N=ATGC。
Degenerate bases H=ACT, R=AG, Y=CT, D=GAT and N=ATGC.
1.5 扩增产物的克隆与测序
hsp70 cDNA序列及基因组序列扩增产物经1%琼脂糖凝胶电泳检测后用DNA胶回收试剂盒纯化回收,克隆于pEASY-T3 载体上,经转化和蓝白斑筛选后,由上海生工生物工程有限公司测序。
1.6 序列分析及同源性比较
利用ChromasPro对序列进行拼接和校对;采用NCBI的ORF finder预测开放阅读框,BLAST进行序列同源性比对;使用ExPASY进行蛋白质家族位点分析。
1.7 热激条件下不同温度敏感类型菌株hsp70基因表达特征分析
收集新鲜小麦条锈菌菌株11-6-4-1和10-9-1-9的夏孢子,分别等量放入各个冷冻管中,迅速转至28 ℃水浴,分别热激处理0 min、10 min、30 min、1 h、2 h、3 h,结束后用液氮迅速冷冻,提取样品RNA。利用实时荧光定量PCR,以菌株热激处理0 min的样本分别为对照,分析热激不同时间小麦条锈菌hsp70基因的表达特征。每个处理重复3次。
收集高、低温度敏感类型代表菌株(表1)的新鲜夏孢子,分别等量放入各个冻存管中,迅速转至28 ℃水浴中热激处理2 h,结束后用液氮冷冻,提取样品RNA。利用实时荧光定量PCR,以各个菌株热激处理0 min的样本分别为其对照,分析不同温度敏感类型菌株hsp70基因的表达特征。每处理重复3次。
根据小麦条锈菌hsp70的cDNA序列,利用Primer Premier 5.0设计qRT-PCR特异引物(表2)。选用小麦条锈菌Actin基因作为内参[19],以各个样本的cDNA为模板,进行PCR扩增。反应体系为:2×UltraSYBR Mixture 10 μL,上、下游引物(10 μmol/L)各0.4 μL, cDNA 2 μL,补超纯水至20 μL。扩增程序为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,45个循环。反应结束后分析产物的荧光值变化曲线和熔解曲线,根据qRT-PCR反应检测得到的CT值,采用2-ΔΔCT法计算每个样本中目标基因的相对表达水平(ΔΔCT=ΔCT.Gene-ΔCT.Control,ΔCT.Gene为待测组目的基因与待测组内参基因CT的差值,ΔCT.Control为对照组目的基因与内参基因CT的差值)。每个样本设3个反应重复,在同一批次完成目的基因和内参基因的PCR反应。
2 结果
2.1 小麦条锈菌hsp70序列分析
克隆得到小麦条锈菌hsp70 cDNA序列的全长为2 267 bp,开放阅读框为1 917 bp,编码639个氨基酸,理论分子量为66.7 ku,理论等电点为5.15。以小麦条锈菌夏孢子基因组DNA为模板,根据克隆的hsp70 cDNA序列设计引物,扩增拼接得到2 817 bphsp70 基因组序列。通过和克隆的hsp70 cDNA比较,发现该基因编码区含有7个内含子,符合GT-AG 剪切法则,hsp70基因编码区与非编码区序列示意如图1。
利用NCBI的BLAST比较分析,与担子菌门真菌秆锈菌、灰盖伞菌及子囊菌门真菌毛癣菌、曲霉等hsp70基因序列的相似度达79%~85%,与它们的氨基酸相似度达80%~92%(图2)。细胞质中高度保守的HSP70 C末端标志序列EEVD位于636~639。同时通过ExPasyProsite数据库推导发现氨基酸序列中含有:10~17(IDLGTTYS)、195~208(IFDLGGGTFDVSLL)、332~346(IVLVGGSTRIPRIQK)3个HSP70蛋白家族高度保守的标签序列。

图1 小麦条锈菌hsp70基因组结构与编码蛋白示意图Fig.1 Genomic structure and protein domains of Pst hsp70
2.2 高温胁迫下小麦条锈菌hsp70的表达特征分析
热激不同时间小麦条锈菌hsp70基因表达特征分析如图3所示。以未经热激(0 min)处理的样本为对照,经28 ℃热激处理后,两个菌株hsp70的转录水平都有所增加。温度高敏感类型菌株10-9-1-9在热激后,hsp70的相对表达量与未经处理的对照相比略有上升,2 h达到最高值也仅为未经热激处理对照样本的2.1倍。温度低敏感类型菌株11-6-4-1在受到热激后,2 h之前相对表达量一直维持在较低的水平,但2 h时,hsp70相对表达量显著增加,为未经热激处理对照样本的17.4倍,3 h时回落至对照样本表达量的2倍。
对温度高、低敏感类型各3株代表菌株其hsp70在热激2 h后的相对表达量分析结果见表3。以各菌株未经热激处理(0 min)为对照,不同温度敏感类型菌株在热激2 h后hsp70的相对表达量具有显著差异。温度低敏感类型菌株在热激2 h后,hsp70的相对表达量均高于温度高敏感类型菌株。低敏感类型菌株hsp70平均表达量为未经处理对照的7.12倍,而高敏感类型菌株hsp70平均表达量仅为对照的1.63倍。

图2 条锈菌与其他真菌HSP70氨基酸序列相似性分析Fig.2 Protein sequence alignment and similarity analysis of Pst HSP70 compared with other fungi
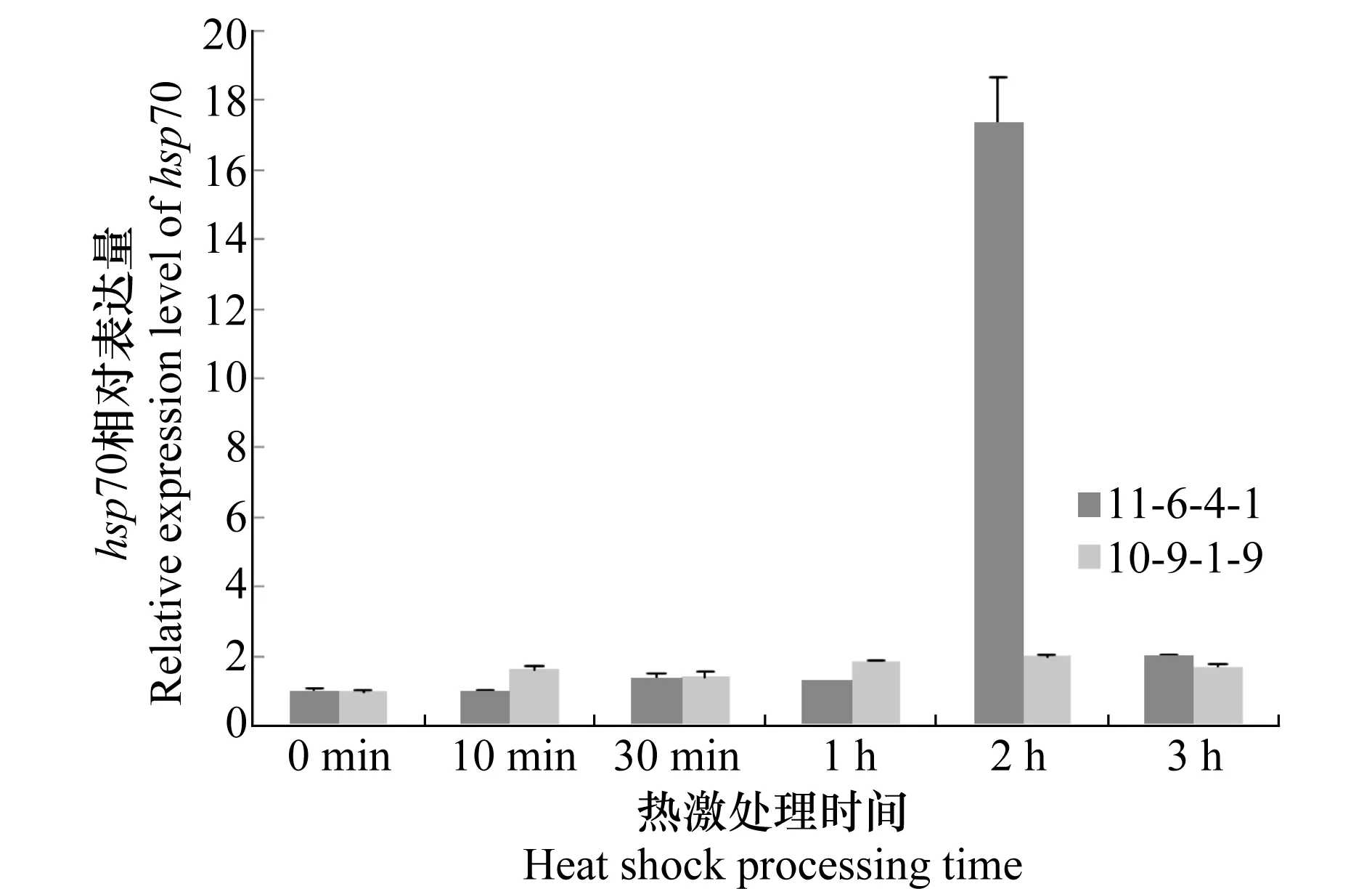
图3 热激不同时间小麦条锈菌hsp70基因表达特征Fig.3 Relative expression levels of Pst hsp70 with different heat shock processing times
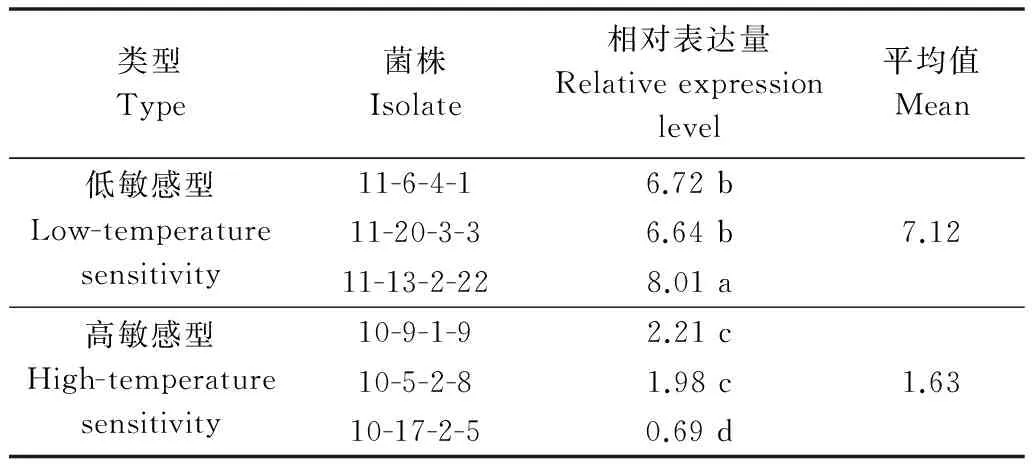
类型Type菌株Isolate相对表达量Relativeexpressionlevel平均值Mean低敏感型Low-temperaturesensitivity11-6-4-16.72b11-20-3-36.64b7.1211-13-2-228.01a高敏感型High-temperaturesensitivity10-9-1-92.21c10-5-2-81.98c1.6310-17-2-50.69d
1) 数据后标注的不同小写字母表示差异显著(P=0.05)。
Different lowercase letters indicate significant difference.
以上结果表明,热激条件下,hsp70在温度高、低敏感类型的表达特征具有明显差异,温度低敏感类型菌株的相对表达量显著高于温度高敏感类型菌株,证实小麦条锈菌HSP70在病菌抵御热胁迫过程中发挥了一定作用。
3 讨论
小麦条锈病是一种典型的低温病害,温度是控制该病害发生与流行的重要环境因子。以往的研究表明,小麦条锈病在冷凉潮湿的地区发病严重,但近年来不断有研究发现小麦条锈菌对温度的适应性有所增强。生物体在受到高温或其他不利条件伤害时,会激发其本身的应激作用。热激蛋白在此作用中发挥着独特的功能。在热激条件下,大部分生物体正常蛋白合成受阻,诱导型热激蛋白则开始合成,该蛋白可保护机体内其他蛋白免遭损伤或修复已经受损的蛋白,从而起到保护生物体的作用[20]。
本研究克隆了一个小麦条锈菌hsp70基因,翻译后得到的氨基酸序列含有HSP70蛋白家族的3个典型标签,而且与其他真菌HSP70氨基酸序列具有较高的同源性,表明该基因编码的蛋白质属于HSP70蛋白家族。另外,在其氨基酸序列的C末端存在高度保守的细胞质特异性EEVD调控基序,说明该蛋白是一种细胞质HSP70。
热激蛋白HSP70包含组成型和诱导型两种,组成型的HSP70对维持细胞基本生理功能和形态起重要作用,在正常条件下表达活跃,但不会对外界胁迫产生响应,而诱导型HSP70在正常生理条件下不存在或表达量很低,但能够在外界胁迫条件下被强烈诱导,从而达到保护机体免受伤害的作用,诱导型热激蛋白的累积决定着真核生物细胞的耐热性[13]。本研究中,分析了不同温度敏感类型小麦条锈菌经28 ℃热胁迫后hsp70基因的表达特征,发现该基因的表达量经热激处理后诱导表达,且温度低敏感类型菌株(耐高温菌株)的表达量显著高于温度高敏感类型菌株。说明HSP70在低敏感类型菌株抵御高温胁迫的过程中起到了积极作用。推测,在热激条件下,HSP70蛋白开始合成,合成的热激蛋白可保护机体,克服胁迫条件对机体带来的损伤。
HSP70的功能不只体现在其对热胁迫的响应,在生物体受到其他不良环境的影响时,其合成也会发生变化[13]。本文针对小麦条锈菌hsp70在热胁迫下的表达特征进行了研究,但关于其在紫外线、重金属盐等其他胁迫条件下的表达特征仍需进一步分析。
[1] Roelfs A P, Singh R P, Saari E E.Rust diseases of wheat:Concepts and methods of disease management [M].Mexico:Cimmyt, 1992.
[2] 李振岐,曾士迈.中国小麦锈病[M].北京:中国农业出版社,2002.
[3] Newton M, Johnson T.Stripe rust,Pucciniaglumarum,in Canada [J].Canadian Journal of Research,1936,14(2):89-108.
[4] Rapilly F.Yellow rust epidemiology [J].Annual Review of Phytopathology,1979, 17 (1):59-73.
[5] Milus E A, Seyran E, McNew R.Aggressiveness ofPucciniastriiformisf.sp.triticiisolates in the South-Central United States [J].Plant Disease,2006, 90 (7):847-852.
[6] Milus E A, Kristian K, Hovmøller M S.Evidence for increased aggressiveness in a recent widespread strain ofPucciniastriiformisf.sp.triticicausing stripe rust of wheat [J].Phytopathology, 2009, 99(1):89-94.
[7] Mboup M, Bahri B, Leconte M, et al. Genetic structure and local adaptation of European wheat yellow rust populations:the role of temperature-specific adaptation [J].Evolutionary Applications, 2012,5(4):341-352.
[8] 张静秋. 小麦条锈菌群体温度敏感性及寄生适合度研究[D].北京:中国农业科学院,2012.
[9] 王新俊. 平凉市小麦条锈病越夏菌源分布区域精准勘测及主要影响因子研究[J].植物保护,2009,35(6):130-134.
[10]全辉,谢保全,李新梅,等. 气象对淅川小麦条锈病越夏感染的影响[J].安徽农学通报,2009,15(2):47-49.
[11]肖志强,尚学军,李宗明,等. 陇南山区小麦条锈病流行对气候偏暖的响应及对策研究[J].气象科学,2007,27(S1):140-146.
[12]陈亚琼,肖调江,周浙昆. 热激蛋白与生物环境适应及进化的关系[J].自然科学进展,2006, 16(9):1066-1073.
[13]Morishima N.Control of cell fate by Hsp70: more than an evanescent meeting [J].Journal of Biochemistry,2005, 137(4):449-453.
[14]Montero-Barrientos M, Hermosa R, Nicolá C, et al. Overexpression of aTrichodermaHSP 70 gene increases fungal resistance to heat and other abiotic stresses [J]. Fungal Genetics and Biology, 2008,45(11): 1506-1513.
[15]谢翎,陈红梅,汤强,等. 实时荧光定量PCR检测球孢白僵菌热休克蛋白基因hsp70在几种胁迫条件下的表达[J].菌物学报,2009(6):806-812.
[16]邢淑莲,周益林,段霞瑜,等.小麦白粉菌HSP70基因的克隆及高温胁迫对其表达的影响[J].植物病理学报,2013,43(2):205-210.
[17]Chen X, Line R, Leung H.Relationship between virulence variation and DNA polymorphism inPucciniastriiformis[J].Phytopathology,1993, 83(12):1489-1497.
[18]李翠翠. 真姬菇热激蛋白HmHSP70基因克隆及其原核表达分析[D].青岛:青岛农业大学,2009.
[19]黄雪玲,冯浩,康振生. 小麦条锈菌实时荧光定量PCR分析中内参基因的选择[J].农业生物技术学报,2012, 20(2):181-187.
[20]Morimoto R I, Tissieres A.The biology of heat shock proteins and molecular chaperones[M].America:Cold Spring Harbor Laboratory Press, 1994.
(责任编辑:田 喆)
Cloning of a heat shock protein genehsp70 ofPucciniastriiformisf.sp.triticiand its expression in response to high-temperature stress
Cao Huaning, Liu Bo, Liu Taiguo, Gao Li, Chen Wanquan
(State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection, Chinese Academy of Agricultural Sciences,Beijing 100193, China)
To determine the response ofPucciniastriiformisf.sp.triticiheat shock protein 70 to high-temperature stress, thePsthsp70 gene was cloned via RACE and PCR, and mRNA expression ofhsp70 was determined in representative isolates with low-and high-temperature sensitivity during the heat shock process. The whole genomic DNA sequence ofhsp70 was 2 817 bp, including 7 introns, and the cDNA sequence was 2 267 bp, including an opening reading frame of 1 917 nucleotides. The ORF encodes a HSP70 protein of 639 amino acids, which had a theoretical pI/MW of 5.15/66.7 ku and contained three HSP70 family signature domains. Following heat shock at 28 ℃, expression ofhsp70 transcripts was up-regulated in the isolates with high-and low-temperature sensitivity, and reached the maximum level 2 hours after treatment. However, the average expression level was increased by 7.12-fold upon heat shock for 2 h in the isolates with low-temperature sensitivity, but only 1.63-fold in the isolates with high-temperature sensitivity.
wheat stripe rust; temperature sensitivity; HSP70; clone; qRT-PCR
2014-04-21
2014-12-11
国家重点基础研究发展计划(“973”计划)(2013CB127704);国家自然科学基金项目(31100110);国家科技支撑计划(2012BAS19B04);国家小麦产业技术体系岗位专家专项经费(CARS-03-04B)
S 435.121.42
A
10.3969/j.issn.0529-1542.2015.03.004
* 通信作者 E-mail:bliu@ippcaas.cn;wqchen@ippcaas.cn
