儿童呼吸道分离肺炎支原体药物敏感性分析
2015-11-24叶信予徐晓刚王明贵
张 泓, 叶信予, 徐晓刚, 王明贵, 刘 杨
·论著·
儿童呼吸道分离肺炎支原体药物敏感性分析
张 泓1, 叶信予2, 徐晓刚2, 王明贵2, 刘 杨2
目的 了解儿童呼吸道肺炎支原体临床分离株对常用抗菌药物的敏感性。方法 采用微量稀释法测定分离自呼吸道感染患儿的112株肺炎支原体对大环内酯类、四环素类和氟喹诺酮类药物的敏感性。对肺炎支原体核糖体23S rR N A全序列进行扩增及测序。结果 98株(87.5%)肺炎支原体临床分离株对红霉素和阿奇霉素耐药,耐药株均存在A2063 G 或A2064 G的23S rR N A核苷酸点突变。四环素类和氟喹诺酮类对肺炎支原体仍具有良好的抗菌活性。结论 呼吸道感染患儿肺炎支原体临床分离株对大环内酯类耐药率高,核糖体23S rR N A核苷酸点突变是导致其对红霉素和阿奇霉素耐药的原因。
肺炎支原体; 大环内酯类; 四环素类; 氟喹诺酮类; 耐药性
肺炎支原体(M ycoplasm a pneu moniae)是引起社区获得性呼吸道感染的主要病原体之一,尤其在学龄期儿童和青少年中[1]。2000年以来大环内酯类耐药肺炎支原体在全球范围内报道增多,尤其是东亚地区[2]。本研究对分离自儿童下呼吸道感染患者的肺炎支原体临床分离株进行药物敏感性测定,以明确近年来肺炎支原体对常用抗菌药物的敏感性变化,现将结果报道如下。
1 材料与方法
1.1 菌株来源与分离培养
痰液标本来自2009年1月—2011年3月上海市儿童医院呼吸道感染患儿因诊断需要常规留取的鼻咽部吸取物。根据 W aites等[3]2001年描述的方法进行肺炎支原体分离培养,临床标本直接接种于肺炎支原体SP4液体分离培养基,并继以1∶10、1∶100梯度稀释后分离接种于 SP4固体培养基。液体培养基置于37℃孵育,固体培养基置于37℃、5%C O2孵育。同一标本任何稀释度的液体培养基由清澈变黄色者阳性(分解葡萄糖产酸,p H 值下降),和(或)固体培养基见典型菌落(煎蛋样)后,显微镜下挑取单菌落再次接种于SP4液体培养基,变色后置-80℃保存。
1.2 SP4培养基的配置
根据美国临床与实验室标准化协会(C LSI)颁布的关于肺炎支原体药敏试验M 43-P 2011年版规程配置SP4液体和固体培养基[4]。SP4液体和固体培养基简要配方:①基质配方(每1 000 m L):去离子纯水643 m L,不含结晶紫的支原体肉汤培养基3.5 g,胰蛋白胨10.0 g,蛋白胨5.3 g,1%酚红2.0 m L,Fei鱼卵提取D N A 0.2 g;如配置固体培养基加琼脂15 g。②添加剂配方(每1 000 m L):热灭活(56℃30 min)胎牛血清170 m L,25%酵母提取液35 m L,2%酵母自溶液100 m L,50%葡萄糖 10 m L,C M R L 1066-10 X 50 m L。分别配制后,培养基基质121℃20 min灭菌,冷却后加入经0.22μm滤膜过滤的添加剂,最终p H 值调整至7.4~7.6。液体培养基用于原代培养、菌株保存及药敏试验,固体培养基用于纯化培养。
1.3 肺炎支原体的分子生物学鉴定
煮沸法提取标本中肺炎支原体 D N A。根据Ieven等[5]描述的针对肺炎支原体 P1黏附蛋白编码基因设计和合成 PC R引物(5′-G C C A C C C T C GG G G G C A G T C A G-3′和5′-G A G T C G G G A T T C C CC G C G G A G G-3′),由生工生物工程(上海)股份有限公司合成,PC R扩增产物大小为209 bp。肺炎支原体标准株 M PF H(A T C C 15531)由北京儿科研究所提供。
1.4 抗菌药物标准品
药物敏感性测定所用药物:红霉素、阿奇霉素、四环素、多西环素、左氧氟沙星和莫西沙星,均为Sig ma公司标准品。
1.5 最低抑菌浓度(M IC)测定
根据 C LSI M 43-P 2011年版标准规程[4],采用微量稀释法测定肺炎支原体对大环内酯类、四环素类和氟喹诺酮类等抗菌药物的敏感性。受试肺炎支原体的接种量为104~105C F U/m L;红霉素测定的浓度范围为0.007~256 m g/L,阿奇霉素为0.007~128 m g/L,四环素类和氟喹诺酮类为0.007~8 m g/L。红霉素和阿奇霉素M IC≤0.5 m g/L者判定为敏感,>1 m g/L者判断为耐药[4]。设培养基阴性对照和生长对照,当生长对照为阳性而培养基对照保持阴性时读取M IC值。肺炎支原体标准株M PF H (A T C C 15531)为质控菌株。
1.6 肺炎支原体核糖体23S rR N A基因序列分析
自行设计引物,委托生工生物工程(上海)股份有 限 公 司 合 成 (5′-C A A T A A G T T A C T A AG G G C T T A T G G T G G A T G C-3′,5′-T C C A A T A A GT C C T C G A G C A A T T A G T A T T A C T C A G-3′), 采用P C R法扩增肺炎支原体23S rR N A全序列,由华大基因科技有限公司测序[6],以确认各临床分离株是否存在核糖体核苷酸点突变。
2 结果
2.1 肺炎支原体临床株分离情况
2009年1月—2011年3月1 235份儿童患者鼻咽部吸取物通过SP4培养基培养,共分离培养到肺炎支原体112株,阳性率为9.1%(112/1 235)。对培养获得的112株肺炎支原体采用特异性黏附因子P1黏附蛋白引物的PC R扩增,结果显示112株肺炎支原体均获得209 bp的特异性黏附因子的扩增条带,确认为肺炎支原体。
2.2 肺炎支原体对抗菌药物的敏感性
肺炎支原体临床分离株对大环内酯类耐药率高,98株(87.5%)对红霉素和阿奇霉素耐药,二者M IC50和 M IC90均>128 m g/L。仅14株(12.5%)对红霉素敏感,M IC均≤0.06 m g/L。
受试的四环素类对肺炎支原体均具有强大的体外抗微生物活性。四环素和多西环素的M IC50和M IC90分别为0.06 m g/L和0.125 m g/L。受试的氟喹诺酮类对肺炎支原体亦具有良好的体外抗微生物活性。相比较 而言,莫西 沙星 M IC50和 M IC90均为0.06 m g/L,明显优于左氧氟沙星,后者的M IC50和 M IC90均为0.5 m g/L,见表1。
2.3 肺炎支原体核糖体23S rR N A序列分析
98株判定为大环内酯类耐药的肺炎支原体均存在23S rR N A的核苷酸点突变,97株为 A2063 G突变,1株为 A2064 G突变。14株敏感株均不存在23S rR N A点突变。
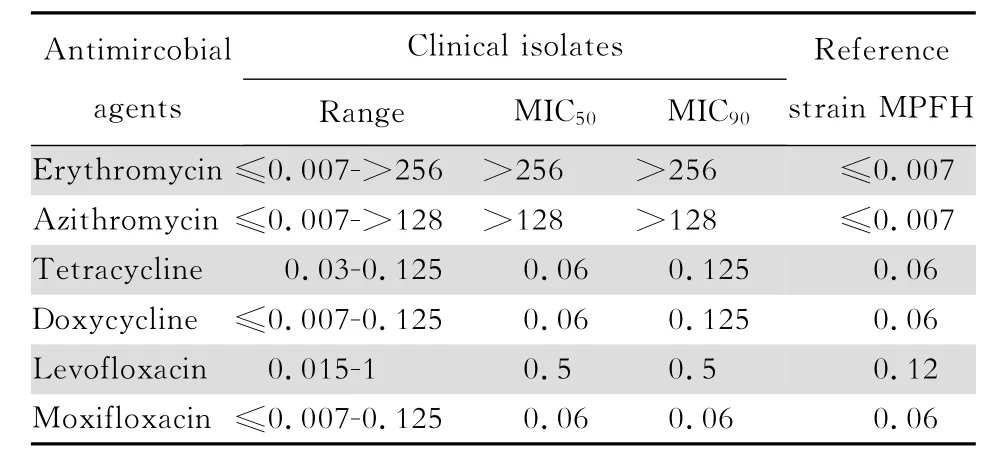
表1 6种抗菌药物对112株肺炎支原体临床分离株的体外抗微生物活性Table 1 In vitroactivity of 6 antimicrobial agents against 112M.pneu moniaestrains(M IC:m g/L)
3 讨论
肺炎支原体临床株分离培养周期长,技术要求高,临床上不作为常规检测开展。近年来由于其对大环内酯类耐药率不断上升,因此需要进行培养以获得更多药效学数据。利用肺炎支原体生化特性(分解葡萄糖产酸,SP4液体培养基p H 值下降使含酚红的培养基变为黄色)以及SP4固体培养基见典型菌落(煎蛋样)可以初步确定菌种。但发酵支原体(M ycoplasm a fermentans)亦可引起呼吸道感染且存在上述生化特性及类似菌落形态[3],因此在分离获得纯化菌株后,仍需通过P C R方法以确认。目前肺炎支原体肺炎检测的引物设计多针对16S rR N A、P1黏附蛋白编码基因和A T P酶操纵子[1]。P1蛋白是一种胰蛋白酶敏感的大分子表面蛋白,是肺炎支原体的特异性黏附因子。本研究采用针对P1基因的引物进行鉴定,证实所分离的临床分离株均为肺炎支原体。
2011年10月C LSI颁布了支原体药敏试验的标准化方法,同时制定了临床常用治疗肺炎支原体抗菌药物的建议耐药折点[4]。大环内酯类中红霉素和阿奇霉素 M IC≤0.5 m g/L 判定为敏感,>1 m g/L判断为耐药(一般耐药株M IC≥16 m g/L)。这是首次正式提出肺炎支原体对大环内酯类药物的耐药折点。该指南同时指出该耐药折点是参考大环内酯类抗生素对于其他革兰阳性菌已建立的耐药折点而制定,是探索性的,将会根据收集到新的相关数据随时更新。这些不断更新的数据资料包括检测菌株是否存在已知的、明确的耐药机制,M IC值升高是否影响药物抗微生物活性、药动学和药效学特性,菌株的M IC值与临床预后的相关性等多个因素。目前最根本的工作是收集更多的临床分离株,根据标准化流程进行药敏测定,以得到更多的M IC值分布数据,从而进一步明确耐药折点。
本研究根据已颁布的C LSI标准化药敏操作规程进行肺炎支原体药敏试验,并同时检测了临床耐药株是否存在核糖体23S rR N A核苷酸点突变。结果显示,2009—2011年分离的肺炎支原体对常用大环内酯类仍保持极高的耐药率(87.5%),与2005—2008年结果相仿[7]。
肺炎支原体对大环内酯类耐药主要与靶位改变有关,其耐药机制主要为核糖体23S rR N A V区中心环核苷酸序列改变(2063位A→G,2064位A→G),导致抗菌药物与核糖体亲和力下降而引起耐药。本 组 资 料 显 示,耐 药 株 均 存在核糖 体 23S rR N A核苷酸点突变,敏感株则不存在上述突变,突变位点明显集中于 A2063 G位点(99.0%,97/98)。
目前认为对大环内酯类耐药肺炎支原体的出现和流行始于2000年,以东亚(日本和中国)为主要流行地区,耐药率逐年上升。日本地区在2000年以前未报道过 对 大环内 酯 类耐 药 的肺炎 支 原 体[8],而2000—2010年报道的儿童患者中肺炎支原体对大环内酯类耐药率为13%~70%,成人患者中分离的肺炎支原体耐 药率仅 6%[9-14]。中 国报 道的 耐 药率最高,部分地区儿童患者临床分离株的耐药率超过90%(83% ~92%),成人 菌 株 耐 药 率69%[6-7,15-18]。此外,肺炎支原体对大环内酯类耐药率超过20%的国家还包括韩国(儿童,31.4%)[19]、以色列(儿童和成人,30%)[20]、意大 利(儿 童,26%)[21]以及 美 国的一项流行的报道,耐药率为27%(3/11)[22]。本研究结果显示,目前儿童患者呼吸道分离肺炎支原体对大环内酯类耐药率高,临床疑似肺炎支原体感染的儿童患者在初始治疗时需要考虑大环内酯类耐药株感染的可能。
由于诸多可能发生的不良反应,儿童患者选用四环素类及氟喹诺酮类药物受到极大限制。临床研究显示,阿奇霉素治疗大环内酯类耐药肺炎支原体仍可获得临床治愈,仅发热和退热时间延长[16]。原因可能与阿奇霉素在细胞内浓度较高以及存在免疫调节作用有关。因此,目前肺炎支原体感染患儿,无论是否为耐药株感染,仍推荐首先选用阿奇霉素治疗。但值得关注的是,本研究中阿奇霉素M IC值有上升趋势(2005—2008年资料 M IC90为64 m g/L)。国外目前研究开发的新酮内酯类药物如solithro m ycin,对大环内酯类耐药肺炎支原体具有良好的抗微生物活性[23],但仍需进一步研究以明确临床疗效。
综上所述,本研究根据 C LSI新颁布的标准化操作规程来进行肺炎支原体药物敏感性试验。结果显示,儿童患者中分离的肺炎支原体对大环内酯类耐药率仍保持极高水平,耐药株均存在核糖体23S rR N A A2063 G或 A2064 G核苷酸点突变。应考虑开发新型抗微生物药物用于临床治疗大环内酯类耐药肺炎支原体感染的儿童患者。
[1] W aites K B,Talkington D F.M ycoplasm a pneu moniaeand its role as a hu man pathogen[J].Clin Microbiol Rev,2004,17(4):697-728.
[2] Atkinson TP,W aites K B.M ycoplasma pneumoniaeinfectionsin childhood[J].Pediatr Infect Dis J,2014,33(1):92-94.
[3] W aites K B,Bébéar C M,Robertson JA,et al.Cu mitech 34,laboratory diagnosis of m ycoplasmal infections[M].N olte FS.W ashington D C,2001:1-30.
[4] Clinical and Laboratory Standard Institute.M ethods for antimicrobial susceptibility testing of hu man M ycoplasmas;approved guideline[S].W ayne,P A:2011,M 43-P.
[5] Ieven M,Ursi D,Van Bever H,et al.Detection ofM ycoplasma pneu moniaeby two poly merse chain reactions and role ofM. pneu moniaein acute respiratory tract infections in pediatric patients[J].J Infect Dis,1996,173(6):1445-1452.
[6] Liu Y,Ye X,Zhang H,et al.A ntimicrobial susceptibility of M ycoplasma pneu moniaeisolates and m olecular analysis on macrolide-resistant strains fro m Shanghai China [J]. A ntimicrob A gents Chem other,2009,53(5):2160-2162.
[7] 刘杨,张泓,叶信予,等.2005-2008年上海分离肺炎支原体对抗菌药物的敏感性及对大环内酯类的耐药机制研究[J].中华微生物和免疫学杂志,2009,29(12):1110-1113.
[8] O kazaki N,O hya H,Sasaki T.M ycoplasm a pneu m oniae isolated fro m patients with respiratory infection in Kanagawa Prefecture in 1976-2006:emergence ofmacrolide-resistant strains[J].Jpn J Infect Dis,2007,60(5):325-326.
[9] M orozu mi M,H asegawa K,K obayashi R,et al.E mergence of macrolide-resistantM ycoplasma pneu moniaewith a 23S rR N A gene m utation[J].A ntimicrob A gents Chem other,2005,49(6):2302-2306.
[10] M atsubara K,M orozu mi M,O kada T,et al.A co m parative clinical study of macrolide-sensitive and macrolide-resistant M ycoplasma pneu moniaeinfectionsin pediatric patients[J].J Infect Chem other,2009,15(6):380-383.
[11] M orozu mi M,Iwata S,Hasegawa K,et al.Increased macrol ide resistance ofM ycoplasm a pneu moniaein pediatric patients with co m m unity-acquired pneu m onia[J].A ntimicrob Agents Chem other,2008,52(1):348-350.
[12] Miyashita N,O ka M,Atypical Pathogen Study Group,et al. M acrolide-resistantM ycoplasm a pneu moniaein adults with co m m unity-acquired pneu m onia [J]. Int J A ntimicrob A gents,2010,36(4):384-385
[13] M atsuoka M,Narita M,O kazaki N,et al Characterization andm olecular analysis ofmacrolide-resistantM ycoplasm a pneu moniaeclinicalisolates obtained in Japan[J].A ntimicrob A gents Chem other,2004,48(12):4624-4630.
[14] Kawai Y,Miyashita N,Ya maguchi T,et al.Clinical efficacy of macrolide antibiotics against genetically determined macrolide-resistantM ycoplasm a pneu moniaepneu m onia in paediatric patients[J].Respirology,2012,17(2):354-362.
[15] Xin D,Mi Z,Han X,et al.M olecular mechanisms of macrol ide resistance in clinicalisolates ofM ycoplasm a pneu moniaefro m China[J].A ntimicrob A gents Chem other,2009,53(5):2158-2159.
[16] Cao B,Zhao CJ,Yin Y D,et al.High prevalence of macrol ide resistance inM ycoplasm a pneu moniaeisolates fro m adult and adolescent patients with respiratory tract infection in China[J].Clin Infect Dis,2010,51(2):189-194.
[17] Liu Y,Ye X,Zhang H,et al.Characterization of macrolide resistance inM ycoplasm a pneu moniaeisolated fro m children in Shanghai,China[J].Diagn MicrobiolInfect Dis,2010,67(4):355-358.
[18] Zhao F,Lv M,Tao X,et al.A ntibiotic sensitivity of 40 M ycoplasm a pneu moniaeisolates and m olecular analysis of macrolide-resistant isolates fro m Beij ing, China [J]. A ntimicrob A gents Chem other,2012,56(2):1108-1109.
[19] H ong K B,Choi E H,Lee H J,et al.M acrolide resistance of M ycoplasm a pneu moniae,South K orea,2000-2011[J]. E merg Infect Dis,2013,19(8):1281-1284.
[20] A verbuch D,Hidalgo-Grass C,M oses A E,et al.M acrolide resistance inM ycoplasma pneu moniae,Israel,2010[J]. E merg Infect Dis,2011,17(6):1079-1082.
[21] Chironna M,Sallustio A,Esposito S,et al.E mergence of macrolide-resistant strains during an outbreak ofM ycoplasm a pneu moniaeinfections in children [J].J A ntimicrob Chem other,2011,66(4):734-737.
[22] W olff BJ,Thacker W L,Schwartz SB,et al.Detection of macrol ide resistance inM ycoplasm a pneu moniaeby real-time P C R and high-resolution melt analysis [J]. A ntimicrob Agents Chem other,2008,52(10):3542-3549.
[23] W aites K B,Crabb D M,D uffy L B.Co m parativein vitro susceptibilities of hu man m ycoplasmas and ureaplasmasto a new investigational ketolide,C E M-101[J]. A ntimicrob A gents Chem other,2009,53(5):2139-2141.
Antimicrobial susceptibility of theM ycoplasma pneumoniaestrains isolated from pediatric patients
Z H A N G H ong,Y EXinyu,X UXiaogang,W A N GMinggui,LIU Yang. (Shanghai Children′s H ospital,Shanghai JiaoTong U niversity,Shanghai 200040,China)
Objective To investigate the profile of antimicrobial susceptibility of theM ycoplasm a pneu moniae (M pn)strains isolated fro m pediatric patients with respiratory tract infection.M ethods A ntimicrobial susceptibility testing was conducted with a total of 112 M pn clinical strains by broth microdilution method.Sequence analysis of full 23S rR N A genes was performed for all M pn strains.Results O ne hundred and twelve M pn strains were isolated fro m January 2009 to M arch 2011. Of these clinicalisolates,98(87.5%)were resistant to erythro m ycin and azithro m ycin.All macrolide-resistant M pn strains harbored an A2063 G or A2064 G transition m utation in do main V of 23S rR N A genes.M pn isolates were still very susceptible to the tetracyclines and fluoroquinolones tested.Conclusions The M pn strains fro m pediatric patients are highly resistant to macrolides.The mechanism of macrolide resistance may be associated withthe transition m utation on 23S rR N A gene.
M ycoplasm a pneu moniae;macrolide;tetracyclines;quinolones;antimicrobial resistance
R375.2
A
1009-7708(2015)01-0063-04
2014-08-22
2014-10-29
国家自然科学基金(81370047);上海卫生局(20124026)。
1.上海市儿童医院,上海交通大学附属儿童医院检验科,上海 200040;2.复旦大学附属华山医院。
张泓(1963—),女,硕士,主任技师,主要从事细菌耐药机制研究。
刘杨,E-mail:liuyang@fudan.edu.cn。
