I型鸭肝炎病毒3C蛋白的原核表达和免疫学检测
2015-11-23宋翠萍卢凤英彭大新
杨 洋,宋翠萍,卢凤英,丁 铲,彭大新
(1. 扬州大学兽医学院,扬州 225009;2. 中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
I型鸭肝炎病毒3C蛋白的原核表达和免疫学检测
杨 洋1,宋翠萍2,卢凤英2,丁 铲2,彭大新1
(1. 扬州大学兽医学院,扬州 225009;2. 中国农业科学院上海兽医研究所,上海 200241)
本研究采用原核表达载体pET-32a在大肠杆菌中表达血清I型鸭甲型肝炎病毒(Duck hepatitis virus serotype I,DHV-I)SH株的3C蛋白,经超声波裂解结果显示,pET-3C融合蛋白呈现可溶性表达。利用 His-bind Resin试剂盒纯化该产物,作为免疫原免疫小鼠,制备特异性抗体进行免疫学检测。结果表明,该抗体与原核表达产物、DHV感染的SPF尿囊液总蛋白呈现特异性反应。由此可见,3C基因在大肠杆菌中可获得成功表达,制备的多抗血清可用于3C 蛋白的检测。
I型鸭甲型肝炎病毒;3C 蛋白;原核表达
鸭病毒性肝炎(duck viral hepatitis,DVH)是引起雏鸭的一种急性、高度致死性的传染病,其病原为鸭肝炎病毒(Duck hepatitis virus,DHV),临床症状主要为运动失调,角弓反张,主要病变为肝脏肿大出血。病原包括小RNA病毒科禽肝病毒属的鸭甲肝病毒(Duck hepatitis A virus,DHAV)、星状病毒科禽星状病毒属的鸭星状病毒(Duck astrovirus,DAstV)。DHV曾分为3个血清型,为I型(DHV-I)、Ⅱ型(DHV-Ⅱ)和Ⅲ型(DHV-Ⅲ),分别对应以往所称的鸭肝炎病毒(Duck hepatitis virus,DHV)血清1型(DHV-1)以及2007年报道的台湾DHV新型和韩国DHV新型DAst V则指历史上所称的DHV血清2型病毒(DHV-2),在国际病毒分类委员会第八次分类报告中,DHV-2被更名为鸭星状病毒1型(Duck astrovirus LDAstV-1),DHV-3似可更名为DAstV-2,其中 DHV-I 型呈世界性分布,DHAV-2仅见于中国台湾,DHAV-3流行于韩国和中国大陆[1-4]。
DHV编码含一个2249个氨基酸的多聚蛋白,经过蛋白裂解,产生3种结构蛋白(VP0、VP3、VP1)和8个非结构蛋白(2A1、2A2、2B、2C、3A、3B、3C、3D)。3C 蛋白是具有水解多聚蛋白活性的蛋白水解酶,在多聚蛋白水解、病毒复制和形成过程中发挥重要的作用[5]。本研究利用大肠杆菌BL21转化系统表达DHV-1 SH 株的3C基因,制备其多抗血清,为 3C蛋白的进一步研究奠定基础。
1 材料与方法
1.1 毒株、菌株和载体 DHV-1 SH毒株为本实验室保存;pET-32a载体购自大连宝生生物公司;大肠杆菌 BL21(DE3)和 DH5α均为上海生工生物有限公司。
1.2 酶和相关试剂 Trizol试剂购于Invitrogen 公司;10 mmol/L dNTP、RNA 酶抑制剂(Rnasin)、Eco R I、Hind III均购自 TaKaRa 公司;Accquire Taq HF酶购自 Invitrogen公司;凝胶回收试剂盒、DNA片段快速回收试剂盒、质粒提取试剂盒等购自北京天根公司;DS 5000 Marker购自东盛科技有限公司;His标签单抗购自Erthox公司;His-band Resin亲和层析试剂盒购自Millipore公司;预染蛋白质Marker 购自NEB公司;Supersignal west pico Chemiluminescent Substrates ECL发光试剂盒购自Pierce公司。
1.3 引物设计与合成 根据 DHV-I SH株全基因组序列(HQ265433.1),利用 Primer premier 5.0 设计3C基因序列的2对引物,引物序列(表1),引物均由上海生工生物公司合成。
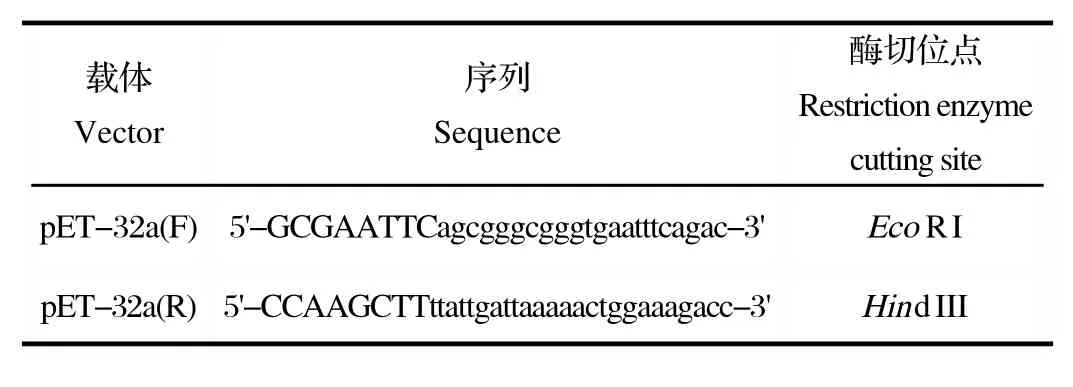
表1 扩增引物Table 1 Primers for amplifi cation
1.4 病毒 RNA 提取及3C 基因的扩增 参照说明书按Trizol法抽提尿囊液总RNA。以提取的病毒RNA为模板,应用随机引物在 MMLV反转录酶的作用下逆转录获得病毒基因组cDNA,随后利用 Accquire Taq HF酶 PCR扩增。反应条件:94℃变性2 min,55℃退火1 min,72℃延伸1 min,30个循环后,72℃再延伸10 min。反应结束后,取8μL PCR产物在1%琼脂糖凝胶上电泳。
1.5 重组质粒载体 pET-3C 的构建 PCR产物经1%琼脂糖凝胶电泳分离回收纯化,分别经Eco R I、Hind III酶切,与经同样酶切的pET-32a载体连接,转化大肠杆菌DH5α 感受态细胞,分别在含100 μg /mL氨苄青霉素(Amp)的LB琼脂平板上37℃培养过夜。挑取单菌落,提取质粒电泳筛选,进行酶切鉴定,并送上海生工生物技术有限公司测序,正确的克隆命名为pET-3C。
1.6 重组菌的诱导表达及表达产物的检测 将重组质粒 pET-3C转化至 BL21(DE3),挑取单菌落分别接种于5 mL含Amp抗性的 LB 液体培养基中,37℃振荡培养过夜,然后按1%接种量分别转接至含Amp的5 mL LB 液体培养基中,37℃、200 r/min振荡培养至菌液OD600值达0.6~0.7 时,加入0.2~1.0 mmol / L IPTG,37℃诱导3~5 h及16℃ 2~10 h。离心收集菌体,溶于适量 PBS 中,超声波裂解菌体,离心后分别收集上清及沉淀,-20℃保存备用。相同条件下诱导空载体pET-32a,将诱导样品和非诱导样品进行SDS-PAGE 电泳,然后转印至NC膜上,5%脱脂奶粉4℃封闭过夜,以鼠抗His单抗作为一抗,辣根过氧化物酶(HRP)标记的羊抗鼠为二抗,Western blot 检测表达产物。
1.7 重组蛋白纯化及多抗血清制备 利用His-band Resin亲和层析试剂盒收集并纯化重组蛋白。将纯化的蛋白包裹弗氏佐剂,免疫6周龄Balb/c小鼠,100 μg/只,每隔10 d免疫1次,4免后72 h时采血,分离血清作为鼠抗3C抗原血清 。
1.8 Western blot检测 将病毒尿囊液、重组菌诱导产物和空载体,利用12% SDS-PAGE分离,按常规方法转印NC膜,5%脱脂乳4℃封闭过夜;利用0.01 mol/L TBST溶液按1∶1000稀释制备的3C阳性血清,37℃作用2 h后,0.01mol/L TBST洗涤10 min;HRP标记的羊抗鼠IgG作为二抗,稀释度为1∶10 000,充分洗涤后,利用ECL显色。
2 结果
2.1 3C 基因的克隆 以提取的尿囊液总RNA为模板,RT-PCR扩增出约550 bp 的目的条带(图1)。目的片段和载体连接后经Eco R I、Hind III酶切获得2 个条带(图2)。经进一步测序,克隆的3C基因序列及阅读框完全正确。

图1 鸭肝炎病毒3C基因的PCR扩增Fig.1 PCR-amplifi ed 3C gene from DHV-I
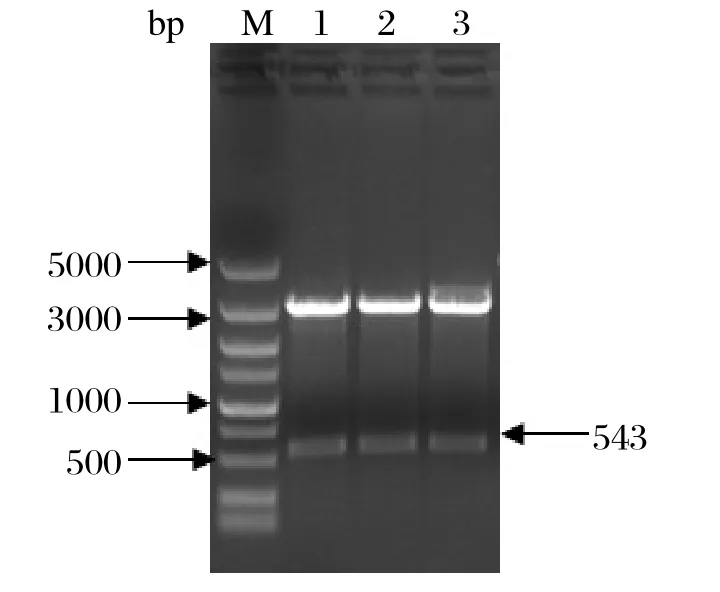
图2 重组质粒pET-3C双酶切鉴定Fig.2 Identifi cation of recombinant plasmid pET-3C by double enzyme digestion
2.2 重组蛋白的诱导表达与检测 IPTG 浓度为0.2 mmol /L,16℃诱导2~8 h,重组蛋白可得到较高水平表达,pET-3C在上清、包涵体都有表达(图3)。重组蛋白相对分子量约为38 kDa,见图4,以抗His标签单抗对重组蛋白进行鉴定,在目的位置出现1条特异条带。将pET-3C的诱导菌液用His-band Resin亲和层析试剂盒纯化,结果见图5。

图3 pET-3C蛋白的可溶性分析Fig.3 Solublility analysis of the recombinant 3C protein by SDS-PAGE
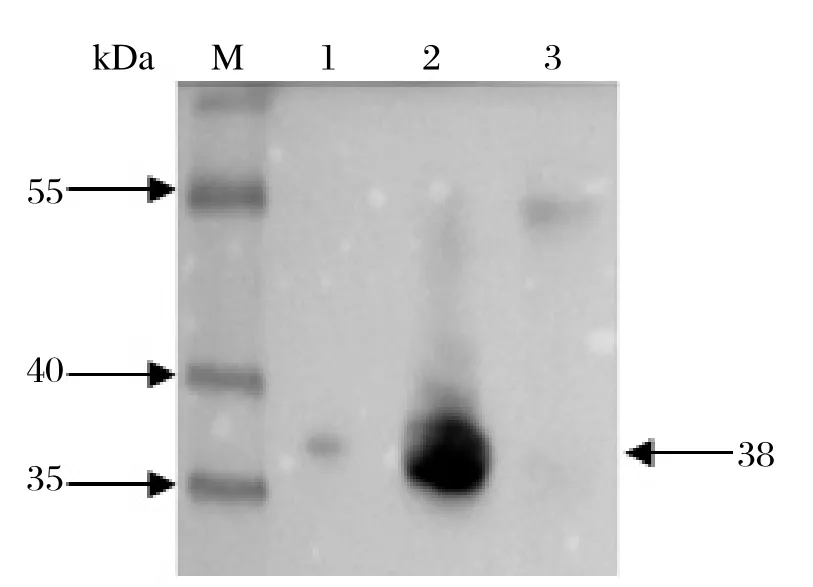
图4 纯化蛋白的SDS-PAGE分析Fig. 4 SDS-PAGE analysis of the purifi ed recombinant protein
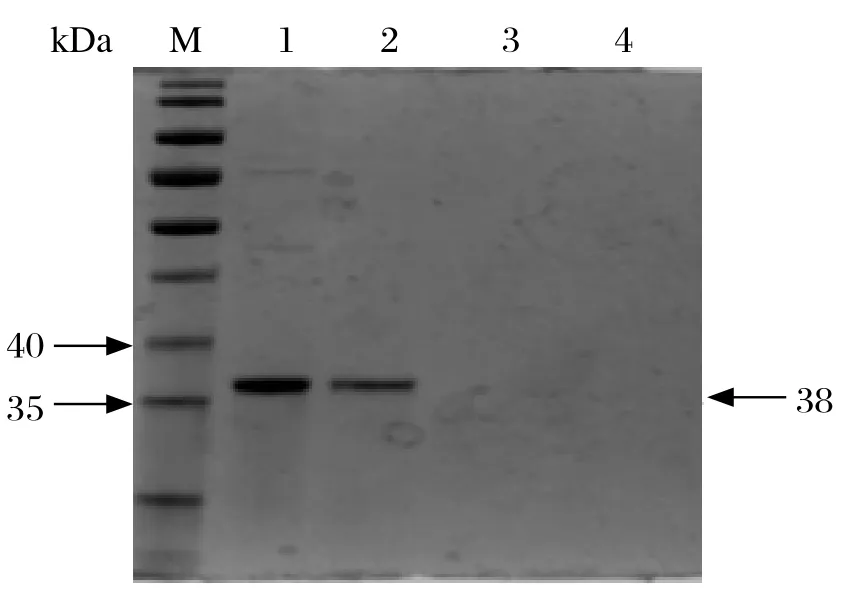
图5 pET-3C蛋白 Western blot 鉴定Fig. 5 Western blot of pET-3C recombinant protein
2.3 多抗血清的 Western blot 鉴定 结果表明,获得的pET-3C蛋白多抗血清不仅能与pET-3C蛋白重组蛋白发生反应,而且能与 DHV-ⅠSH 毒株鸡胚尿囊液反应,形成大小约为38 kDa的条带,如图6。

图6 3C多抗血清的Western blot鉴定Fig.6 Western blot of 3C antiserum
3 讨论
鸭甲型肝炎病毒归属于小RNA病毒科、禽肝炎病毒属、鸭甲型肝炎病毒种,3C 蛋白是一些小RNA病毒的自身蛋白水解酶之一,它虽然不直接参与病毒RNA的复制,但是对多种前体蛋白的正确水解有力的保证了衣壳的形成和病毒的复制。3C 蛋白酶不仅裂解自身蛋白,也可以裂解宿主的细胞内的蛋白,包括一些转录因子、翻译因子、固有免疫信号分子及细胞的骨架蛋白,能够抑制宿主蛋白的合成或功能的发挥,保证病毒的复制,还能使病毒逃避宿主的固有免疫,细胞骨架蛋白的重组有利于病毒的扩散其他小核糖核酸病毒一样,病毒基因组只编码1个大的开放阅读框,翻译形成一多聚蛋白,需进一步剪切加工形成结构蛋白及病毒复制必须的功能蛋白[6-8]。
pET系统是有史以来在E.coli中克隆表达重组蛋白功能最强大的系统。目的基因被克隆至pET质粒载体上,受噬菌体 T7强转录及翻译(可选择)信号控制,表达由宿主细胞提供的T7 RNA聚合酶诱导。T7 RNA 聚合酶机制十分有效并具选择性:充分诱导时,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几个小时,目的蛋白通常可以占到细胞总蛋白的50%以上。本研究用 pET-32a 表达系统成功表达了DHV-1 3C 蛋白,采用RT-PCR技术扩增出完整的3C基因,经分析该基因长为 543 bp,与DHV-1SH 株序列同源性达100%,SDS-PAGE 电泳证明表达的pET-3C能在上清中表达,分子量约为38 kDa。
尽管 pET 原核系统表达的外源蛋白缺少翻译加工功能,但表达产物依旧保持了良好的免疫原性。本研究利用表达的融合蛋白免疫小鼠制备了针对重组蛋白的多抗血清,Western blot 分析说明制备的多抗血清可与 DHV- 1 尿囊液中的 3C蛋白发生特异性反应,制备的多抗血清具有很好的特异性,可作为检测用抗体进一步应用于 DHV-1 3C 抗原的检测及功能研究。
[1] Asplin F. Duck hepatitis∶ vaccination against two serological types[J]. Vet Rec, 1965, 77(50)∶ 1529.
[2] Gough R, Borland E, Keymer I, et al. An outbreak of duck hepatitis type II in commercial ducks[J]. Avian Pathol,1985, 14(2)∶ 227-236.
[3] Gough R, Collins M, Borland E, et al. Astrovirus-like particles associated with hepatitis in ducklings[J]. Vet Rec, 1984, 114(11)∶ 279.
[4] Todd D, Smyth V J, Ball N, et al. Identification of chicken enterovirus-like viruses, duck hepatitis virus type2 and duck hepatitis virus type 3 as astroviruses[J]. Avian Pathol, 2009, 38(1)∶ 21-9.
[5] Liu M, Zhang T, Zhang Y, et al. Development and evaluation of a VP1-ELISA for detection of antibodies to duck hepatitis type 1 virus[J]. J Virol Methods, 2010,169(1)∶ 66-69.
[6] 刘艳, 李冰清, 孟红. 小 RNA 病毒 3C 蛋白酶及其裂解底物[J]. 生物技术通报, 2014, (8)∶ 8.
[7] 宋翠萍, 韩先干, 仇旭升, 等. I 型鸭肝炎病毒 VP1 的原核表达与免疫学检测[J]. 中国动物传染病学报, 2010,18(6)∶ 33-37.
[8] 赵金花, 沈志强, 朱辉, 等. 新型鸭肝炎病毒的分离鉴定及VP1基因序列分析[J]. 中国预防兽医学报, 2011, (10)∶772-775, 780.
PROKARYOTIC EXPRESSION AND DETECTION OF 3C OF DUCK HEPATITIS VIRUS TYPE 1
YANG Yang1, SONG Cui-ping2, LU Feng-ying2, DING Chan2, PENG Da-xin1
(1. College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China; 2. Shanghai Veterinary Research Institute, CAAS,Shanghai 200241, China)
In this study, the prokaryotic expression vector pET-32a was used to express 3C protein of serum type I Duck hepatitis virus(DHV-I) SH strain in competent E.coli. The recombinant bacteria were sonicated and lysed followed by SDS-PAGE. The soluble fusion protein pET-3C was purifi ed using a His-bind Resin kit and used to immunize mice to prepare antiserum for use in Western blot. The results showed that 3C protein was expressed in E.coli, and polyclonal antibodies prepared were reactive in Western blot.
Duck hepatitis virus type 1; 3C protein 1; prokaryotic expression
S852.659.6
A
1674-6422(2015)06-0037-05
2015-11-06
863项目(2011AA10A209);国家自然科学基金青年基金(31302099)
杨洋,男,硕士,主要从事动物分子病毒学研究
丁铲,E-mail:shoveldeen@shvri.ac.cn;彭大新,E-mail:daxinpeng@yahoo.com
