组蛋白H3K27乙酰化与H3S28磷酸化改变引起心脏发育相关基因的表达变化
2015-11-21林怡翔顾若漪曹银银刘斯达李烁琳王慧君黄国英
林怡翔 徐 君 顾若漪 曹银银 刘斯达 李烁琳 王慧君,2 黄国英,2
先天性心脏病(CHD)是一种常见的出生缺陷[1]。遗传与环境因素被认为对CHD的发病机制有较大影响[2]。遗传学研究已证实染色体异常和多个基因突变与CHD存在关联,但其低发生率和高变异不足以完全解释CHD的发病。环境因素对个体表型的影响及其相关机制尚未阐明[3,4]。组蛋白修饰与基因表达调控密切相关,广泛参与了转录的启动终止、基因表达沉默和染色体重构等过程,是表观遗传学的重要部分。本课题组前期研究证实法洛四联症患儿心肌组织中组蛋白整体乙酰化水平存在异常,其中组蛋白H3第27位赖氨酸残基(K27)的乙酰化修饰(H3K27ac)在 CHD患儿中明显降低[5]。有研究表明,H3K27三甲基化修饰异常能够影响基因的表观沉默,从而破坏正常基因时空表达,导致胎鼠心脏畸形[6]。近年来,研究者逐渐认识到单个位点的修饰无法解释组蛋白对基因表达影响;位点间的相互作用以及各位点修饰状态的组合,是构成组蛋白调控基因表达的主要基础[7,8]。组蛋白H3K27与其相邻的第28位点丝氨酸残基(S28)已被证实具有相互作用;S28的磷酸化(S28ph)状态可影响K27位点的修饰状态,从而影响基因的表达调控[8,9]。本研究以C2C12细胞为研究对象,用广谱的组蛋白去乙酰化酶(HDACs)抑制剂丁酸钠、组蛋白乙酰转移酶(HATs)抑制剂姜黄素及蛋白激酶C(PKC)的强激活物佛波酯[14]干预细胞,通过Western Blot检测C2C12细胞组蛋白H3K27的乙酰化和H3S28的磷酸化水平,用RT-PCR检测干预后细胞心脏发育相关基因的表达变化,从而探讨H3K27和H3S28位点修饰在CHD发病中的可能机制。
1 方法
1.1 材料 C2C12细胞购自中国科学院上海生命科学研究院细胞库;高糖DMEM细胞培养基购自美国HyClone公司;胎牛血清及青霉素链霉素双抗购自美国Invitrogen公司;丁酸钠、姜黄素购自Sigma公司;H3K28ac及H3S28ph抗体购自Cell SignalTechnology公司;β肌动蛋白(内参)抗体购自Abcam公司;蛋白酶抑制剂(PIC)及磷酸酶抑制剂(PI)购自美国Roche公司;蛋白定量试剂盒及Western显影试剂盒购自LifeTechnology公司;30%聚丙烯酰胺凝胶和硝酸纤维薄膜购自美国伯乐公司;RIPA(强)裂解液及Western Blot其他试剂购自上海威奥生物科技有限公司;Trizol试剂购自美国Invitrogen公司;反转录试剂盒和SYBR Green Real-time PCR Master Mix购自日本Takara公司;Real-time PCR仪(ABI-7900)为美国ABI公司产品。
1.2 细胞培养 C2C12细胞复苏后接种于10cm2培养皿,加入含10%FBS及1%双抗的高糖DMEM培养基,置37℃5%CO2培养箱培养。胰酶消化处理后传代;传代细胞长满后接种于12孔培养板,待细胞贴壁生长后进行干预。
1.3 分组和细胞处理 设丁酸钠组、姜黄素组、佛波酯组和对照组。丁酸钠以超纯水溶解,姜黄素、佛波酯溶于DMSO溶剂,并调整DMSO浓度为1/1000。药物处理接种于12孔板的细胞:丁酸钠浓度为50mmol·mL-1,姜黄素浓度为25μmol·mL-1,佛波酯浓度为50nmol·mL-1,均做3复孔;对照组和丁酸钠组加入含0.1%DMSO的培养基。加药后的细胞置于培养箱内培养24h后收集细胞并用PBS洗涤沉淀,行H3K27ac、H3S28ph和心脏发育相关基因表达检测。
1.4 Western Blot检测组蛋白H3K27ac与H3S28ph水平在RIPA(强)裂解液中加入0.1%蛋白酶抑制剂及2%磷酸酶抑制剂。取洗涤后细胞沉淀,加入100μL裂解液,充分吹打混匀,置冰裂解。裂解后离心分离沉淀,取上清液用试剂盒定量。定量后蛋白加入5×Loading上样缓冲液并配制为终浓度1mg·mL-1。制作浓缩胶与分离胶,加入蛋白样品并加入一个泳道的蛋白分子量Marker;在电泳槽中以130V电压电泳约70min。切取分离胶转至转膜槽,以0.35mA电流转膜90min,将蛋白及Marker转至硝酸纤维膜。以立春红染料染硝酸纤维膜,并根据Marker剪取目标分子量的膜上条带(组蛋白H325kD,β-肌动蛋白45kD)。洗涤后加入5%脱脂奶粉封闭非特异性抗原1h。加一抗置4℃冰箱孵育过夜。次日洗涤后加入二抗室温孵育1h,洗净二抗。用显影试剂盒显影,并用Las3000成像系统曝光拍照。用bandleader软件进行灰度扫描并计算目的条带与内参的灰度比值。
1.5 细胞总RNA抽提及反转录 采用Trizol法抽提总RNA。在洗涤后的细胞中加入1mLTrizol试剂,吹打混匀后置冰裂解完全。加入氯仿混匀离心,分离水相。加入预冷异丙醇沉淀RNA并离心,并用75%乙醇洗涤沉淀。沉淀干燥后加入DEPC水溶解沉淀。用紫外分光光度法测定RNA浓度;1%琼脂糖凝胶电泳检测RNA质量(有3条带为质量良好)。抽提后的总RNA用TAKARA逆转录试剂盒进行逆转录合成cDNA。
1.6 引物合成及实时荧光定量PCR(RT-PCR)检测基因表达 采用IDTdna公司提供的在线Realtime引物设计软件,对参与心脏发育过程的代表基因设计引物(表1),扩增片段均跨外显子,片段长度为100~200 bp。8个候选基因包括心脏发育相关转录因子家族(TBX2,GATA4,Sxi1)、信号通路基因(Bmp2,TGFβ2)以及心脏特异性基因(Nkx2.5,cTnT,Cx43)。PCR反应体系10μL:RT-PCR 引物1μL、cDNA 2μL(含1μg cDNA),超纯水2μL,SYBR Green Real-time PCR Master Mix 5μL。反应条件:95℃预变性120s;PCR循环:95℃5s,60℃30s,扩增40个循环。反应完成后,采用SDS 2.3软件输出结果。
1.7 丁酸钠和姜黄素浓度梯度处理细胞 对2种及以上药物处理基因表达与对照组相比有统计学差异的基因,进一步行药物浓度梯度处理。在培养细胞中加入不同浓度的丁酸钠(0、1、10和100mmol·mL-1)及姜黄素(0、0.1、1和10μmol·mL-1),并调整DMSO浓度为1/1 000。每个浓度均做3复孔,加药后处理1.3项下,行H3K27ac、S28ph水平和心脏发育相关基因表达检测。
1.8 统计学方法 用GraphPad Prism5软件分析实验结果。计量资料以±s表示。RT-PCR结果及Western灰度扫描结果采用单因素方差分析,组间差异用Bonferroni法比较。药物浓度与H3K27ac、S28ph水平和心脏发育相关基因表达相关分析采用Pearson相关检验,(P<0.05)为差异有统计学意义。
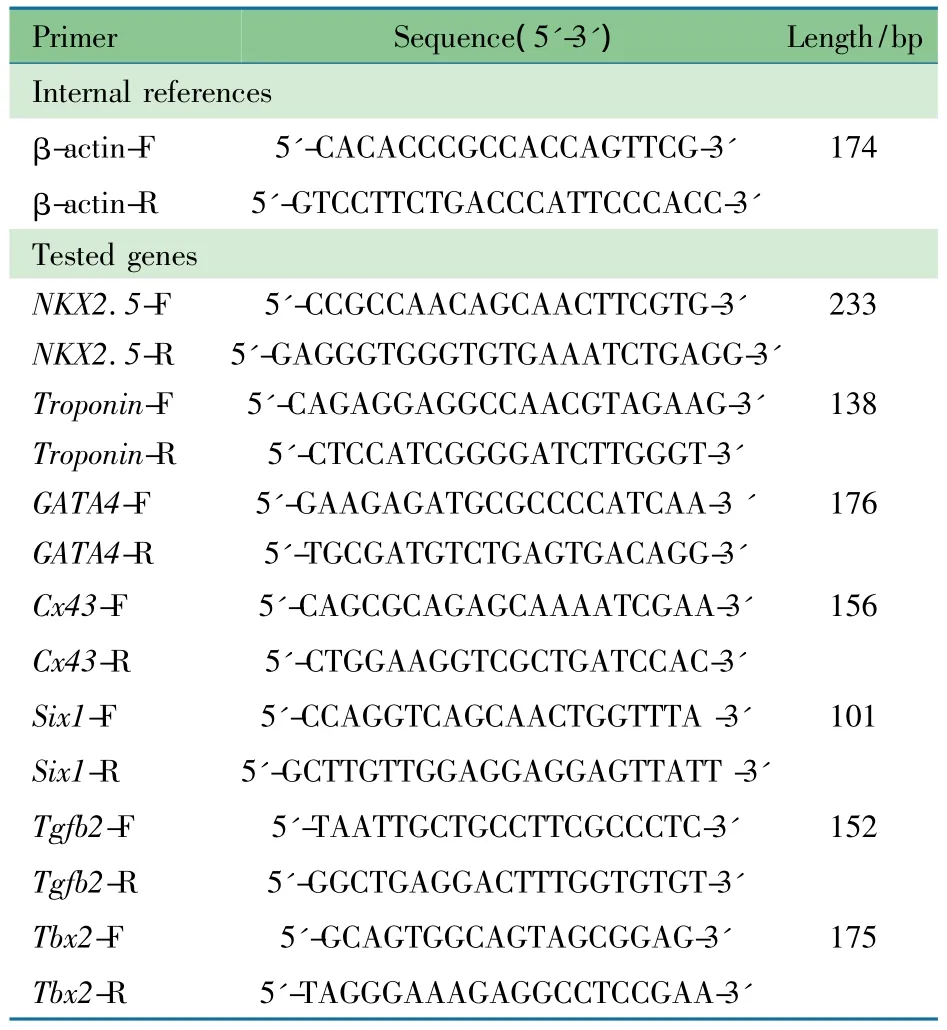
表1 实时荧光定量PCR引物序列Tab 1The sequences of primers in realtime PCR
2 结果
2.1 药物细胞生长情况 加药后用倒置相差显微镜观察处理细胞。细胞状况良好,大多贴壁生长,细胞形态成多角形,细胞核清晰可见。丁酸钠100mmol·mL-1处理后细胞有部分死亡漂起,贴壁细胞较其他组略少,细胞形态尚可,无大面积死亡现象。
2.2 药物处理后细胞整体组蛋白修饰水平变化 图1显示,丁酸钠组H3K27ac水平在4组中最高,姜黄素组H3K27ac水平在4组中最低,丁酸钠组H3S28ph水平明显低于其他3组。单因素方差分析显示,4组间H3K27ac、H3S28ph水平差异总体上有统计学意义((P<0.001)),Bonferroni检验提示丁酸钠组、姜黄素组、佛波酯组H3K27ac和H3S28ph水平分别与对照组比较差异均有统计学意义,H3K27ac:(1.90±0.04)、(0.04±0.00)、(1.67±0.00)vs(1.09±0.01),(P<0.05);H3S28ph:(0.04±0.01)、(0.97±0.06)、(1.58±0.03)vs(0.73±0.01),(P<0.05)。
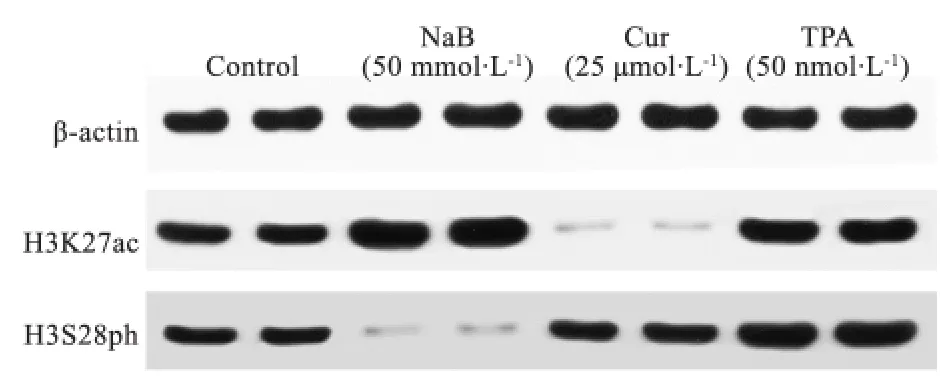
图1 4组组蛋白H3K27ac及H3S28ph Western BlotFig 1 Histone H3K27ac and H3S28ph examined by Western blot of 4 groups
2.3 药物处理后细胞心脏发育相关基因表达 RT-PCR结果显示(表2),8个心脏发育相关基因表达4组间差异总体上有统计学意义;相较于对照组,丁酸钠组有表达差异的基因6个(Cx43、cTnT、Nkx2.5、TBX2、Gata4 和Six1),姜黄素和佛波酯组有表达差异的基因分别为3个(cTnT、Six1、Tgfb2)和 4 个(Bmp2、cTnT、Gata4、Six1)。其中,cTnT基因对于3种药物处理产生的表达改变与对照组差异均有统计学意义,丁酸钠组cTnT表达显著低于对照组((P<0.05)),姜黄素与佛波酯组的cTnT表达显著高于对照组((P<0.05))。Cx43基因及Six1基因分别对2种药物处理有明显表达变化;丁酸钠组Cx43基因表达较对照组明显降低((P<0.05)),佛波酯组Cx43基因表达明显上升((P<0.05));姜黄素与佛波酯处理后的Six1基因表达较对照组明显升高((P<0.05)),上述3个基因进入后续药物浓度梯度分析。
表2 4组心脏发育相关基因表达(±s)Tab 2 Heartdevelopment related genes'expressions after treatments in 4 groups(±s)
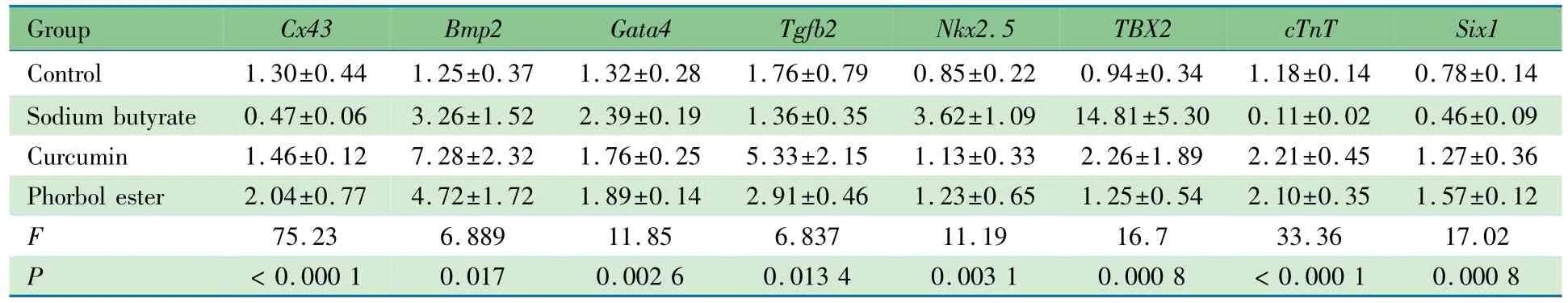
表2 4组心脏发育相关基因表达(±s)Tab 2 Heartdevelopment related genes'expressions after treatments in 4 groups(±s)
Group Cx43 Bmp2 Gata4Tgfb2 Nkx2.5TBX2 cTnT Six1 Control 1.30±0.44 1.25±0.37 1.32±0.28 1.76±0.79 0.85±0.22 0.94±0.34 1.18±0.140.78±0.14 Sodium butyrate 0.47±0.06 3.26±1.52 2.39±0.19 1.36±0.35 3.62±1.09 14.81±5.30 0.11±0.02 0.46±0.09 Curcumin 1.46±0.12 7.28±2.32 1.76±0.25 5.33±2.15 1.13±0.33 2.26±1.89 2.21±0.45 1.27±0.36 Phorbol ester 2.04±0.77 4.72±1.72 1.89±0.14 2.91±0.46 1.23±0.65 1.25±0.54 2.10±0.35 1.57±0.12 F 75.23 6.889 11.85 6.837 11.19 16.7 33.36 17.02 (P<0.001) 0.017 0.002 6 0.013 4 0.003 1 0.000 8 <0.000 10.000 8
2.4 药物浓度梯度处理C2C12细胞后组蛋白修饰变化及基因表达的变化 Western Blot结果显示,随着丁酸钠浓度增加,H3K27ac水平显著升高,H3S28ph水平明显降低;姜黄素浓度梯度处理后H3K27ac、H3S28ph水平变化趋势与丁酸钠相反(图2)。cTnT、Cx43及Six1基因表达结果显示,cTnT基因表达随丁酸钠浓度升高有降低趋势,随着姜黄素浓度升高有表达上升的趋势;Cx43随丁酸钠浓度升高表达呈显著下降趋势((P<0.01)),姜黄素浓度升高对其表达影响不明显;Six1基因随丁酸钠浓度升高表达呈降低趋势,姜黄素浓度升高后表达呈现升高趋势(表3)。
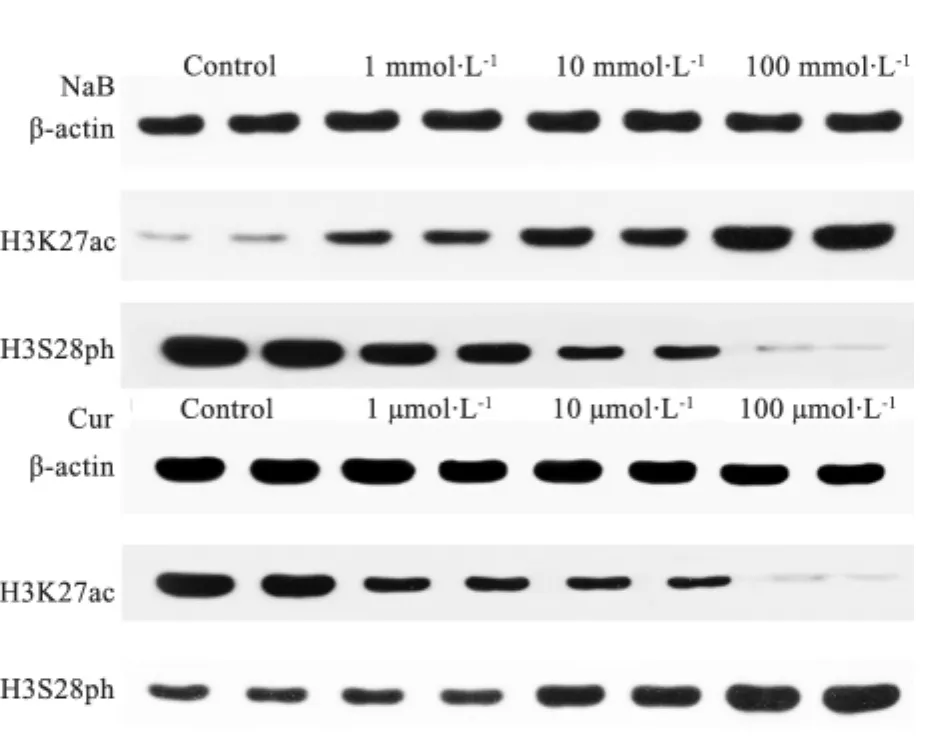
图2 丁酸钠和姜黄素浓度梯度处理H3K27ac及S28ph Western BlotFig 2 Histone H3K27ac and H3S28ph examined by Western blot after sodium butyrate and curcumin treatment
表3 丁酸钠及姜黄素梯度处理后基因表达变化(±s)Tab 3 Heartdevelopment related genes'expressions after NaB and curcumin ladder(±s)
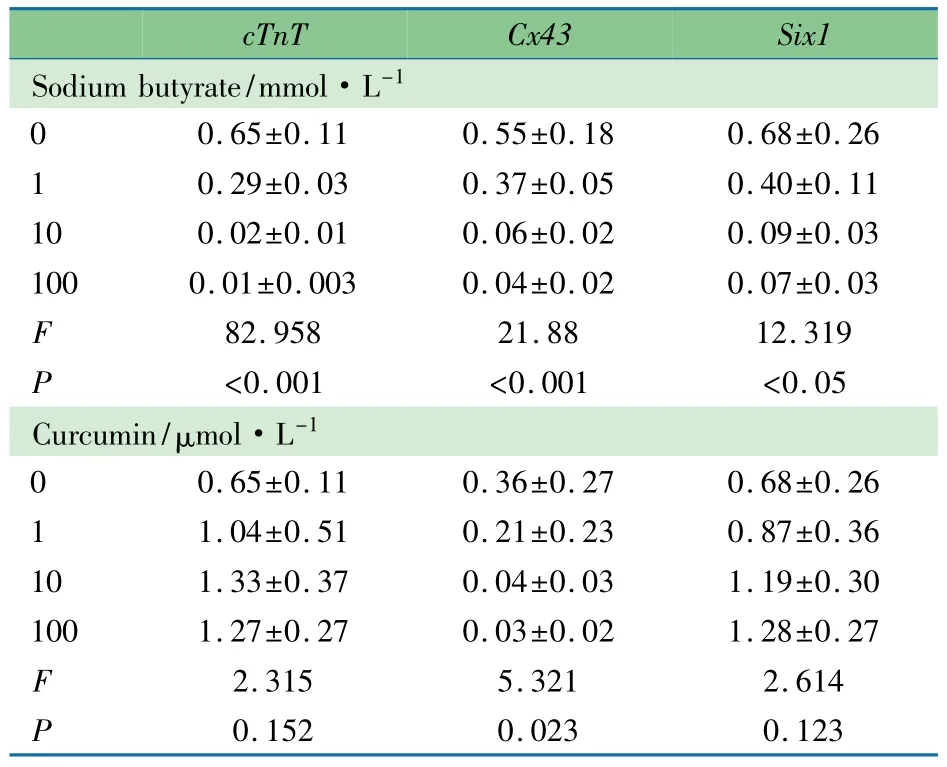
表3 丁酸钠及姜黄素梯度处理后基因表达变化(±s)Tab 3 Heartdevelopment related genes'expressions after NaB and curcumin ladder(±s)
cTnT Cx43Six1 Sodium butyrate/mmol·L-1 0 0.65±0.11 0.55±0.18 0.68±0.26 1 0.29±0.03 0.37±0.05 0.40±0.11 10 0.02±0.01 0.06±0.02 0.09±0.03 100 0.01±0.003 0.04±0.02 0.07±0.03 F 82.958 21.88 12.319 (P<0.001) <0.001 <0.05 Curcumin/μmol·L-1 0 0.65±0.11 0.36±0.27 0.68±0.26 1 1.04±0.51 0.21±0.23 0.87±0.36 10 1.33±0.37 0.04±0.03 1.19±0.30 100 1.27±0.27 0.03±0.02 1.28±0.27 F 2.315 5.321 2.614 P 0.152 0.0230.123
相关性分析显示,组蛋白H3K27ac水平与丁酸钠浓度的指数呈正相关(R2=0.963),H3S28ph水平与丁酸钠浓度指数呈负相关(R2=0.993);H3K27ac水平与姜黄素浓度指数呈负相关(R2=0.966),H3S28ph与姜黄素浓度指数呈正相关(R2=0.930)。
对组蛋白的总体修饰水平与cTnT、Cx43和Six1基因的表达相关分析显示,丁酸钠浓度梯度处理的H3K27ac水平与3个基因表达均呈负相关(R2分别为0.709、0.713和0.651),H3S28ph水平与3个基因表达均呈正相关(R2分别为0.866、0.822和0.766);姜黄素浓度梯度处理的H3K27ac、H3S28ph3水平与3个基因表达均无明显相关性(R2均<0.5)。
3 讨论
CHD发生机制在很大程度上受到非遗传因素影响。环境因素是主要的非遗传致病因素。既往研究证实,宫内感染、孕期药物使用、吸烟、孕妇酗酒、高海拔缺氧等环境因素与CHD发病存在关联[2,10~12]。环境致病因素暴露,伴有心脏基因表达变化和组蛋白乙酰化水平改变[11,12]。组蛋白修饰在心脏发育过程中参与了包括基因表达水平调节及基因的时序表达等重要过程。组蛋白修饰状态与基因表达调控的因果关系目前尚无明确结论。一方面组蛋白的乙酰化和磷酸化修饰在基因表达过程中处于动态变化过程[2],另一方面组蛋白甲基化修饰与表观沉默机制的深入研究明确了组蛋白修饰是某些特定基因表观沉默的成因或条件[13]。多项前期研究表明组蛋白修饰水平异常与CHD存在关联[5,6,9,13]。
组蛋白H3K27ac通常被认为是基因激活和表达的标志。近期研究表明,组蛋白H3S28ph修饰影响K27位点的修饰状态,人为磷酸化S28能够使得K27位点三甲基化沉默修饰失效并导致K27磷酸化和沉默基因重新表达[8,14]。有学者提出组蛋白H3K27与S28位点修饰状态及其调控类似细胞信号转导过程。研究K27与S28位点的修饰状态及其对心脏发育相关基因的影响,可以揭示本课题组前期发现的CHD心肌组织存在的组蛋白乙酰化异常以及该组蛋白通路在CHD发病中的可能机制。
本研究Western blot结果显示,丁酸钠处理的C2C12细胞H3K27ac水平升高,伴H3S28ph水平的下降;相反,姜黄素组的H3K27ac水平明显降低,H3S2ph水平明显提高。佛波酯组显示H3S28ph显著升高伴H3K27ac水平升高。既往研究表明磷酸化组蛋白H3S28位点促进K27ac,姜黄素抑制HATs之后,S28ph水平异常升高,提示S28ph可能是反馈性上调以促进K27ac。目前尚缺乏对K27位点去乙酰化机制的研究;本研究结果显示丁酸钠抑制HDACs后,K27位点去乙酰化受阻,S28位点磷酸化明显降低,提示S28ph可能参与K27ac机制。因此,预测S28磷酸化状态可能是组蛋白H3K27S28通路的调控节点,S28位点是否发生磷酸化是决定K27位点是否发生乙酰化的条件,从而调节了基因表达调控。然而上述结论是基于总体组蛋白的修饰水平,并未具体到某一个组蛋白H3分子或发生K27S28位点共同修饰的组蛋白所占的比例,因此无法证实该机制是否存在,需要进一步研究。
丁酸钠与姜黄素浓度梯度处理后,C2C12细胞的组蛋白修饰状态均产生与药物浓度相关的变化。相关性分析表明,H3K27ac、H3S28ph水平与丁酸钠及姜黄素剂量的指数在本实验浓度内有很高的相关性,证实了通过控制丁酸钠与姜黄素浓度,能够使得总体组蛋白H3K27乙酰化水平产生变化,同时影响其相邻的S28位点磷酸化作用。
本研究显示,丁酸钠组组蛋白高乙酰化修饰状态导致了8个被检测基因中6个发生了表达改变,姜黄素和佛波酯也分别通过影响组蛋白修饰导致3~4个基因表达改变。提示改变组蛋白H3K27S28整体修饰状态,能够改变心脏相关基因的表达,这与本课题组前期的研究[5]结果一致,并提示总体组蛋白修饰状态对CHD发病的影响,可能是通过影响心脏相关基因的正常表达。在丁酸钠梯度处理的细胞中,cTnT、Cx43和Six1基因表达与H3K27ac和S28ph存在相关性,但姜黄素组中未观察到显著相关性,因此无法确定被检测基因表达与这2个位点的某一修饰状态间是否存在相关性。另外,由于总体组蛋白修饰水平不能等同于某一特定基因上的组蛋白修饰状态,也无法确定被检测基因的确切组蛋白修饰情况,需要更深入的研究。
[1]Zhao QM, Ma XJ, Jia B, et al.Prevalence of congenital heart disease at live birth:an accurate assessment by echocardiographic screening.Acta Paediatr, 2013, 102(4):397-402
[2] Xu J(徐君), Wang HJ, Huang GY.Histone acetylation and congenital heart diseases.Chin J Pediatr(中华儿科杂志),2013,51(7):552-554
[3]Tromans A.Cardiovascular biology:how genes know their place.Nature, 2004, 432(7013):29
[4]Ozanne SE, Constancia M.Mechanisms of disease:the developmental origins of disease and the role of the epigenotype.Nat Clin Pract Endocrinol Metab,2007,3(7):539-546
[5]Xu J(徐君),Lin YX,Gu RY.Histone acetylation and expression of acetylation-related enzymes in children with tetralogy of Fallot.Chin J Contemp Pediatr(中国当代儿科杂志),2013,15(10):817-821
[6]He A, Ma Q, Cao J, et al.Polycomb repressive complex 2 regulates normal development of the mouse heart.Circ Res,2012,110(3):406-415
[7]Simon JA, Kingston RE.Occupying chromatin:Polycomb mechanisms for getting to genomic targets,stopping transcriptional traffic, and staying put.Mol Cell, 2013, 49(5):808-824
[8]Lau P N, Cheung P.Histone code pathway involving H3 S28 phosphorylation and K27 acetylation activates transcription and antagonizes polycomb silencing.Proc Natl Acad Sci U S A,2011,108(7):2801-2806
[9]Delgado-Olguin P, Huang Y, Li X, et al.Epigenetic repression of cardiac progenitor gene expression by Ezh2 is required for postnatal cardiac homeostasis.Nat Genet, 2012,44(3):343-347
[10]Wu G, Nan C, Rollo JC, et al.Sodium valproate-induced congenital cardiac abnormalities in mice are associated with the inhibition of histone deacetylase.J Biomed Sci, 2010, 17:16
[11]Zhong L, Zhu J, Lv T, et al.Ethanol and its metabolites induce histone lysine 9 acetylation and an alteration of the expression of heart development-related genes in cardiac progenitor cells.Cardiovasc Toxicol, 2010, 10(4):268-274
[12]Ding L, Pan R, Huang X, et al.Changes in histone acetylation during oocyte meiotic maturation in the diabetic mouse.The riogenology, 2012, 78(4):784-792
[13]Prezioso C, Orlando V.Polycomb proteins in mammalian cell differentiation and plasticity.FEBS Lett, 2011, 585(13):2067-2077
[14]Drobic B, Perez-Cadahia B, Yu J, et al.Promoter chromatin remodeling of immediate-early genes is mediated through H3 phosphorylation at either serine 28 or 10 by the MSK1 multiprotein complex.Nucleic Acids Res, 2010, 38(10):3196-3208
