α-Ala限域在螺手性SWBNNT(10,6)与水复合环境下的手性转变机理
2015-11-19杨小翠闫红彦梅泽民王佐成
佟 华,杨小翠,闫红彦,梅泽民,王佐成
(1.白城师范学院 物理学院,白城 137000;2.白城师范学院 化学学院,白城 137000)
手性分子α-丙氨酸(α-Ala),在生命体内左旋体是优构体,对预防肾结石、缓和低血糖、协助葡萄糖代谢等有重要作用.右旋体可作为手性合成的手性源、抑菌剂.已有实验研究证实[1-2]生命体内存在微量的α-Ala右旋体,并且体内过量的右旋α-Ala可导致某些疾病和过早衰老,猜测左旋体向右旋体转变是他的部分来源,但却没有给出其手性转变反应机理.
由于光学纯的α-Ala的重要性以及体内有微量右旋体存在,促使人们对α-Ala进行了广泛而深入的研究.刘凤阁等对α-Ala手性对映体的结构特性的理论研究[3],获得了α-Ala对映体优势几何构型、红外振动谱及VCD 谱.Stepanian 和Adamowicz组[4]用基于密度泛函理论的B3LYP方法,对α-Ala两种异构体进行了理论研究,得到了与实验数据比较吻合的α-Ala构象和振动频率.龚䶮等[5]对α-Ala对映体单晶变温偏振激光拉曼光谱的研究,发现α-Ala对映体的非偏振拉曼光谱相似.王文清组[6]利用单晶的中子衍射研究了295K 和60K 时,α-Ala对映体的结构特征以及由左旋体到右旋体转变的可能性.以往的研究[7-9]发现,α-Ala在孤立条件的手性转变需要越过326.5kJ·mol-1的能垒;在水环境的手性转变反应最高能垒被降到167.8kJ·mol-1.限域在直径较大的扶手椅型SWBNNT(9,9)内时[10],手性转变反应最高能垒被降到302.7kJ·mol-1;随着扶手椅型SWBNNT 直径的减小,限于其中的α-Ala手性转变需要越过的最高能垒不断降低,在SWBNNT(5,5)内最低可降至265.5kJ·mol-1[11].这些结果,对解释生命体内的右旋丙氨酸来源于左旋丙氨酸的异构化,使人们了解体内右旋丙氨酸的来源,具有一定的积极作用.但考虑到α-Ala在体内存在的环境及其复杂,体内有微量的硼和氮等元素的存在,一定有水和类似螺旋手性BNNT 性能相近的纳米螺旋通道共存的情形;利用纳米反应器实现α-Ala手性转变,考虑到氮化硼纳米管较好的耐高温和抗氧化性,以及均相催化都有水的存在.因此,研究限域在水与螺旋氮化硼纳米管复合环境的α-Ala的手性转变具有重要的理论和实际意义.基于此,考虑到α-Ala与水分子以氢键结合形成的水合分子的最大可能线度,并为使研究结果与单体α-Ala限域在扶椅型SWBNNT(9,9)的情形进行比较,研究了与SWBNNT(9,9)尺寸相近的螺旋型SWBNNT(10,6)和水复合环境下的α-Ala的手性转变机理.同时,考虑到生命体内存在氢氧根和微量的氢氧自由基,研究氢氧根或氢氧自由基分别与水分子构成的链对氢转移过程的影响.从理论上更好地揭示α-Ala在体内的手性转变,为实验上获得光学纯的α-Ala提供积极的参考作用.
1 研究与计算方法
采用量子化学的ONIOM(our Own N-layered Integrated molecule Orbit and Molecule mechanics)方法[12],研究在SWBNNT(10,6)和水复合环境下α-Ala的手性转变过程.将管内的反应物、产物、中间体和过渡态与纳米管形成的包结物体系分为两层来处理:内层QM 区为手性转变反应过程中的α-Ala与1个和2个水分子复合物的极小点及过渡态,每个极小点和过渡态的结构都是由16及19个原子构成的,采用基于密度泛函理论的B3LYP方法[13],基组选用6-31+G(d,p);外层MM 区为螺旋手性单臂氮化硼纳米管SWBNNT(10,6),B和N 的原子总数为354个,采用分子力学UFF(Universal Force Field)力场[14]处理,优化反应过程的极小点和过渡态[15-16].在ONIOM(MP2/6-311++G(3df,3pd):UFF)水平,计算各包结物的单点能.零点能校正后,绘制出反应过程的势能面.通过分析过渡态的虚频振动模式和对过渡态进行的IRC计算[17],确定过渡态的可靠性.α-Ala与SWBNNT(10,6)形成的包结物记为α-Ala@SWBNNT(10,6),其余体系的表示法类似.所有计算采用Gaussian 09软件包[18]完成.
2 结果与讨论
2.1 单体S型α-Ala和中间体INT1与其限域在SWBNNT(10,6)和水复合环境下主要几何参数的比较
在B3LYP/6-31+G(d,p)水平,优化的单体S型和R 型α-Ala的几何构型;单体S型α-Ala向R 型α-Ala转变过程中,H 在羧基内转移形成的中间体INT1的几何构型[3]见图1.与羧基内H(12)从O(11)向O(10)转移反应以及手性碳上的H(13)向羰基O(11)转移反应密切相关的键长、原子间距,见表1.
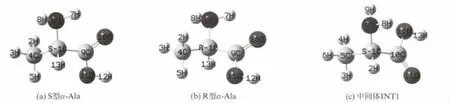
图1 在B3LYP/6-31+G(d,p)水平,S型α-Ala(a)、R 型α-Ala(b)和中间体INT1(c)的结构Fig.1 The geometry of S-type,R-typeα-Ala molecule and the intermediate INT1at the B3LYP/6-31+G(d,p)level
研究发现:α-Ala限域在螺手性SWBNNT(10,6)与水复合环境下的手性转变过程中,2个水分子作为媒介时,H 转移反应能垒被降的最低,氢氧自由基以及氢氧根与水分子构成的水链对H 迁移反应能垒降低的幅度更大,羧基内的H 转移变成了无势垒过程.为了从分子结构上解释说明这个现象,在ONIOM(B3LYP/6-31+G(d,p):UFF)水平,优化了S型α-Ala与羧基旁边的两个水分子形成的水合物,共同被SWBNNT(10,6)包结,形成的包结物S·2H2O@SWBNNT(10,6)的几何构型;优化了中间体INT1与其手性碳上的H 和羰基O 旁边的两个水分子形成的水合物被SWBNNT(10,6)包结,形成的包结物INT1·2H2On@SWBNNT(10,6)的几何构型;优化了Sα-Ala与羧基旁边的氢氧自由基以及氢氧根与1个水分子构成的水链被SWBNNT(10,6)包结,形成的包结物S·(·OH+1H2O)@SWBNNT(10,6)和S·(OH-1+1H2O)@SWBNNT(10,6)的几何构型,二者基本没有差别,只给出S·(OH-1+1H2O)@SWBNNT(10,6)的几何构型,以上各包结物见图2.实现H 转移要断键的键长,要转移的H 与其要转移到的目标原子的原子间距,结果见表1.

图2 S·2H2O@SWBNNT(10,6)、S·(OH-1+1H2O)@SWBNNT(10,6)和INT1·2H2O@SWBNNT(10,6)包结物结构图(a)、(b)、(c)Fig.2 Inclusion complex structure diagram of S·2H2O@SWBNNT(10,6)(a)、S·(OH-1+1H2O)@SWBNNT(10,6)(b)和INT1·2H2O@SWBNNT(10,6)(c)

表1 Sα-Ala和INT1与他们限域在SWBNNT(10,6)和水复合环境的S·2H2O@SWBNNT(10,6)、S·(OH-1+1H2O)@SWBNNT(10,6)和INT1·2H2O@SWBNNT(10,6)主要键长和原子间距对照表Tab.1 The comparison table of main bond lengths and interatomic distances of S·2H2O@SWBNNT(10,6)and S·(OH-1+1H2O)@SWBNNT(10,6)and INT1·2H2O@SWBNNT(10,6),α-Ala molecules,intermediate INT1and themselves limited in SWBNNT(10,6)/water compelx environment (Å)
从表1看出:S·2H2O@SWBNNT(10,6)与Sα-Ala相比较,涉及到氢转移的O-H 键长略长;H 与O 的间距短很多;S·(OH-1+1H2O)@SWBNNT(10,6)与S·2H2O@SWBNNT(10,6)相比较,涉及氢转移的O-H 键的键长和H 与O 的间距,又分别不同程度地变长和不同程度地变短.这预示着2H2O 构成的水链,对S型α-Ala向R 型α-Ala转变的H 迁移过程的反应能垒会有较好地降低作用;氢氧自由基以及氢氧根与1H2O 构成的链,对S 型α-Ala向R 型α-Ala转变的H 迁移过程会有更好的催化作用.INT1·2H2O@BNNT(10,6)与INT1相比较,涉及到氢转移的C-H 键长略长,H 于O 的距离变短,有的甚至短很多.这预示着2个H2O 构成的水链,对H 从手性C向羰基O 转移会有很好的催化作用.
2.2 α-Ala限域在SWBNNT(10,6)与水分子复合环境下的手性转变
研究发现,α-Ala在SWBNNT(10,6)与水分子复合环境下的手性转变反应有两个通道.第一通道是实现H 在羧基内从O(11)向O(10)的转移后,手性碳上的H(13)再转移到羰基O(11)上,然后O(10)上的H 在纸的里侧转移到手性碳的另一侧.此通道又分为两个路径a和b,a是先经氨基在纸面里外摆的过渡态,完成氨基的两个H 从纸面外进到纸面里的异构,然后是羧基内的H 迁移和H 从手性碳向羰基O迁移.b是先实现羧基内的H 迁移和H 从手性碳向羰基O 迁移,然后经氨基的2个H 在纸面里外摆动的过渡态,实现氨基的两个H 进到纸面里的异构.第二通道是手性碳上的H(13)以水分子为媒介以羰基O(10)为桥梁在纸面里迁移到手性碳的另一侧上.
2.2.1 限域在SWBNNT(10,6)与水分子复合环境下的α-Ala在第一通道的手性转变机理
首先a路径上,α-Ala在SWBNNT(10,6)与水分子复合环境下,α-Ala可与多个水分子以氢键结合,并被SWBNNT(10,6)包结.研究发现,对于α-Ala手性转变过程中的H 转移过程,可以有1个H2O 和2个H2O 构成的水分子链,分别作为H 转移媒介两种情况.已有研究表明[19],非断键的单分子异构反应,水环境对其反应能垒的影响可以忽略.因此,为简单起见,非断键的单分子异构过程可以不考虑水分子的存在.为了既不增加问题的复杂性,又尽可能得到连续的势能面的,氨基的2个H 从纸面外向右侧旋转的异构过程不考虑水分子的存在,从右侧向纸面里旋转异构过程考虑水分子的存在.研究发现,有1个H2O作为H 转移媒介的α-Ala手性转变反应过程是:首先S型α-Ala经氨基俯视逆时针旋转的过渡态aTS1@SWBNNT(10,6),形成中间体aINT1@SWBNNT(10,6);之后,aINT1与其羧基旁的1个水分子以氢键结合的水合物被纳米管包结的包结物aINT1·H2O@SWBNNT(10,6),经过H 在羧基内转移的过渡态aTS2·1H2O@SWBNNT(10,6),形成中间体包结物aINT2·1H2O@SWBNNT(10,6);aINT2·1H2O@SWBNNT(10,6)又经氨基俯视第二次逆时针旋转的过渡态aTS3·1H2O@SWBNNT(10,6),形成2个H 在纸面里的中间体aINT3m·1H2O@SWBNNT(10,6);aINT3和手性碳上H(13)与羰基O(11)附近的1H2O 以氢键结合,被纳米管包解的包结物aINT3n·1H2O@SWBNNT(10,6),经过渡态aTS4·1H2O@SWBNNT(10,6),实现手性碳上的H(13)向羰基O(11)转移,形成中间体aINT4m·1H2O@SWBNNT(10,6);aINT4和手性碳C(1)与羰基O(10)附近在纸面里的1H2O 以氢键结合,包结物aINT4n·1H2O@SWBNNT(10,6),经aTS5·1H2O@SWBNNT(10,6)过渡态,实现O(10)上的H在纸面里向手性碳C(1)转移,形成对映体产物aR·1H2O@SWBNNT(10,6),完成手性对映体转变.2个H2O 构成的水链作为H 转移媒介时,反应过程雷同,只是不存在氨基俯视第二次逆时针旋转的过渡态,而是aINT2·2H2On@SWBNNT(10,6),经过手性碳上的H 向羰基O(11)转移的过渡态aTS3·2H2O@SWBNNT(10,6),形成中间体包结物aINT3·2H2Om@SWBNNT(10,6)的同时,氨基的2个H 协同旋转进到纸面里,不再赘述.
在b路径上,主要考虑到与a路径上最高反应能垒的对比,突出主要问题又兼顾篇幅,只讨论手性转变的主要过程.在b路径的手性转变反应,同样有1H2O 和2H2O 作为H 转移媒介两种情况.
有1H2O 的主要反应过程是:首先是bS·1H2O@SWBNNT(10,6)经H 在羧基内转移的过渡态bTS1·1H2O@SWBNNT(10,6),形成中间体包结物bINT1m·1H2O@SWBNNT(10,6);而后是bINT1与其手性碳C(1)和羰基O(11)附近的1个水分子以氢键结合的纳米管包结物bINT1n·1H2O@SWBNNT(10,6),经过过渡态bTS2·1H2O@SWBNNT(10,6),实现手性碳上的H(13)向羰基O(10)转移,形成中间体包结物bINT2·1H2O@SWBNNT(10,6).而后是bINT2经氨基的2个H 里外摆的过渡态bTS3@SWBNNT(10,6),形成有利于O(10)上的H 在纸的里面向手性碳转移的中间体bINT3@SWBNNT(10,6),后面的过程同于a路径上,1H2O 作为氢转移媒介,手性转变过程的aINT4·H2On@SWBNNT(10,6)之后的过程,从略.2H2O 作为H 转移媒介时,主要反应过程雷同,也不再赘述.
氢氧根与H2O 构成的链,作为羧基H 迁移反应媒介的过程是:Sα-Ala与羧基旁的(OH-1·H2O)链以氢键结合并被纳米管包结的包结物S·(OH-1·H2O)@SWBNNT(10,6),经过渡态TS·(OH-1·H2O)@SWBNNT(10,6),实现了H 在羧基内的转移,形成产物中间体INT·(OH-1·H2O)@SWBNNT(10,6).氢氧自由基与1H2O 构成的链作为羧基H 迁移反应媒介的过程相同,从略.
在ONIOM(B3LYP/6-31+g(d,p):UFF)水平,对a和b路径上的1H2O 和2H2O 分别作为H 转移媒介,手性转变反应过程的极小点和过渡态,以及氢氧根和氧自由基与1H2O 构成的链作为媒介,羧基H迁移反应过程的极小点和过渡态,进行几何优化并计算频率,得到各个包结物体系的结构与过渡态虚频振动模式(图3)和图4(b路径上2个H2O 作为氢转移媒介主要过程相同,各包结物结构、过渡态振动模式等雷同与a路径的2H2O 作为氢转移媒介的手性转变主要过程,从略).零点振动能,见表2.对各个过渡态的沿着虚频两个振动方向微调结构进行的优化,以及对过渡态进行的IRC 计算,确定了过渡态的可靠性.反应过程的示意图,见图3和图4.
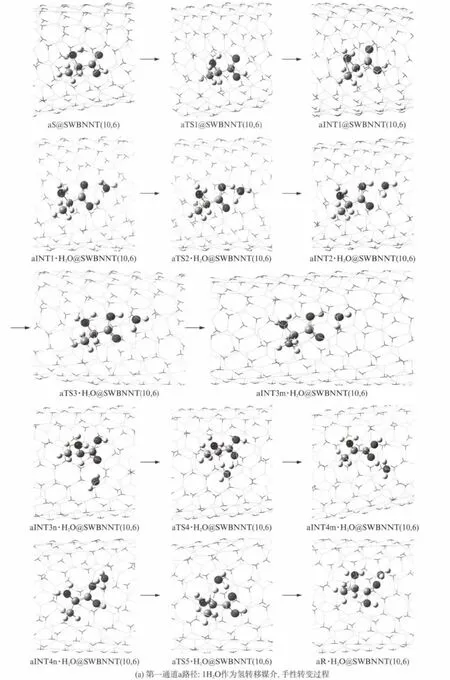

图3 α-Ala限域在螺手性SWBNNT(10,6)与水分子复合环境,在第一个反应通道,手性转变反应过程极小点和过渡态的结构、过渡态的虚频振动模式及反应过程示意图Fig.3 The diagrams and the structures of mimimum points and transition states and the vibration modes of virtual frequencies of transition states in the first reaction channel whenα-Ala molecular confined in SWBNNT(10,6)

图4 氢氧自由基与水分子链以及氢氧根与水分子链作为媒介,α-Ala羧基内H 迁移反应过程的反应物、产物和过渡态结构、过渡态虚频振动模式图Fig.4 The diagrams of chiral transition,the structures of reactants and transition statesand the vibration modes of virtual frequencies of transition states,when hydrogen transfer ofα-Ala carboxyl using hydroxyl radical and hydroxyl respectively with water molecules as bridge
为获得高水平的能量,在ONIOM(MP2/6-311++G(3df,3pd):UFF)水平,计算了第一个反应通道,手性转变反应过程所有极小点和过渡态包结物体系的单点能,计算了氢氧自由基与水分子以及氢氧根与水分子作为媒介,羧基内H 迁移过程的反应物、产物和过渡态包结物体系的单点能,结果见表2;利用Etotal=Esp+ZPVE 计算了体系的总能量之后,选取S@SWBNNT(10,6)、aINT1·1H2O@SWBNNT(10,6)、aINT3n·1H2O@SWBNNT(10,6)、aINT4n·1H2O@SWBNNT(10,6)、aINT1·2H2O@SWBNNT(10,6)、aINT2n·2H2O@SWBNNT(10,6)、bS·1H2O@SWBNNT(10,6)、bINT1n·1H2O@SWBNNT(10,6)、bINT2@SWBNNT(10,6)、bS·2H2O@SWBNNT(10,6)、bINT1n·2H2O@SWBNNT(10,6)、S·(OH-1+H2O)@SWBNNT(10,6)和S·(·OH+H2O)@SWBNNT(10,6)的能量,为相应阶段反应过程的相对总能量的零点,计算的体系相对总能量,结果见表2.

表2 α-Ala限域在SWBNNT(10,6)与水的复合环境,在手性转变第一通道,极小点、过渡态和包结物体系的零点振动能、单点能及相对总能量Tab.2 The zero-point vibrational energies,single point energies,and relative total energies of minimal points and thetransition states on the first reaction channel of Chiral shift when α-Ala molecular confined in SWBNNT(10,6)/water compelx environment
从图5可以看出,α-Ala限域在螺手性SWBNNT(10,6)与水分子复合环境,在第一个手性转变反应通道里,a和b两个路径上的最高能垒,均来自手性碳上的H(13)向羰基O(11)转移的过渡态,以2H2O为H 转移媒介时的最高能垒值比以1H2O 为H 转移媒介时均低30 kJ·mol-1以上,分别为151.0kJ·mol-1和151.9kJ·mol-1.因此,α-Ala在螺手性SWBNNT(10,6)与水分子复合环境下的手性转变反应,第一个反应通道的a和b路径,2H2O 为H 转移媒介时为最佳途径.由于a路径第一步羧基旋转是无势垒过程,所以a路径更具优势.151.0kJ·mol-1的能垒,在体内温度下,考虑到温度的涨落、分子之间的碰撞和体内某种催化作用酶的存在等诸多因素,是能被越过的.这说明了生命体内可以实现α-Ala从左旋体向右旋体的转变,并且发生在体内的螺手性纳米生物通道与水的复合环境下.这说明螺手性SWBNNT(10,6)纳米管与水的复合环境,对α-Ala手性转变过程中的氢转移有极好的催化作用,可作为理想的纳米反应器.

图5 在ONIOM(MP2/6-311++G(3df,3pd):UFF)//ONIOM(B3LYP/6-31+G(d,p):UFF)水平,α-Ala在螺手性SWBNNT(10,6)与水分子复合环境下,在第一个手性转变反应通道,手性转变不同阶段的反应过程势能面示意图Fig.5 The complete potential energy surfaces of chiral transition at different stages,whenα-Ala molecular confined in SWBNNT(10,6)/water complex environment in the first reaction channel at ONIOM(MP2/6-311++G(3df,3pd):UFF)//ONIOM(B3LYP/6-31+G(d,p):UFF)
从由图5还可知,氧自由基和氢氧根分别与水分子构成的链,使羧基内的H 迁移变成了无势垒过程.氧自由基和氢氧根分别与水分子构成的链,对手性碳上的H 向羰基转移也会起到极好的催化作用.由于体内存在微量的氧自由基和氢氧根,因此我们断言,体内微量的右旋丙氨酸一定有一部分来源于其左旋体.若过度的增加碱性食品的摄入量,会加快生命体内α-Ala从左旋体向右旋体的转变的速度,会给人们的健康带来危害,这指导人们要适量地摄入碱性食品.同时,此结论对于指导在实验上把α-Ala限域在纳米反应器与碱性溶液中,实现α-Ala的手性转变,从而获得光学纯的丙氨酸具有十分积极的理论指导意义.
2.2.2 限域在SWBNNT(10,6)与水分子复合环境下的α-Ala在第二通道的手性转变
研究发现,在第二通道里的手性转变反应只有一个路径.此路径也有1H2O 和2H2O 作为H 转移媒介两种情况.
有1H2O 时的完整反应过程是:首先S型α-Ala和手性碳上的H(13)与羰基O(10)附近的一个水分子以氢键结合被纳米管包结的包结物S·H2O@SWBNNT(10,6),经过渡态TS1·1H2O@SWBNNT(10,6),H(13)以1个H2O 为媒介转移到与羰基O(10)上,形成中间体INT1·H2O@SWBNNT(10,6);而后INT1@SWBNNT(10,6)经氨基上的两个H 摆向纸面里侧的过渡态TS2@SWBNNT(10,6),形成中间体INT2@SWBNNT(10,6);INT2的O(11)上的H 在纸面里侧,INT2与O(11)上的H 和C(1)附近的1个H2O 以氢键结合的水合物被纳米管包结,包结物INT2·1H2O@SWBNNT(10,6)经过O(11)上H 在纸面里向手性碳转移的过渡态TS3·1H2O @SWBNNT(10,6),形成R 型中间体INT3·1H2Om @SWBNNT(10,6);最后INT3与其羧基旁的1个H2O 的水合物被纳米管包结的包结物INT3·1H2O@SWBNNT(10,6)经H 在羧基内从O(10)到O(11)的回迁的过渡态TS4·H2O @SWBNNT(10,6),形成产物对映体R·H2O@SWBNNT(10,6),完成手性对映体转变.有2H2O 的反应过程类同于有1H2O 的情况,这里不再赘述.
篇幅所限,在此通道只讨论反应的第一步,目的是与手性转变反应第一通道最高的反应能垒进行比较,1个H2O 作为H 迁移媒介时,此过程表示为:S·H2O@SWBNNT(10,6)→TS1·1H2O@SWBNNT(10,6)→INT1·H2O@SWBNNT(10,6);2个H2O 作为H 迁移媒介时,与1个H2O 时雷同,从略.
在ONIOM(B3LYP/6-31+g(d,p):UFF)水平,对第一步反应过程的稳定点和过渡态进行几何优化与频率计算.得到各个包结物体系的结构、过渡态虚频振动模式及反应过程的示意图见图6(第538页).零点振动能见表3(第538页).对各个过渡态的沿着虚频两个振动方向微调结构进行的优化,以及对过渡态进行的IRC计算,确定了过渡态的可靠性.


图6 α-Ala限域在SWBNNT(10,6)与水分子复合环境,在第二个反应通道主要过程,极小点和过渡态的结构、过渡态的虚频振动模式及反应过程示意图(a)、(b)Fig.6 The diagrams(a)and(b),the structures of mimimum points and transition states and the vibration modes of virtual frequencies of transition states in the main processes of second reaction channel whenα-Ala molecular confined in SWBNNT(10,6)/water compelx environment
为获得高水平的体系能量,在ONIOM(MP2/6-311++G(3df,3pd):UFF)水平,计算了各体系的单点能,见表1.利用Etotal=Esp+ZPVE 计算体系的总能量,选取S·H2O@SWBNNT(10,6)和S·2H2O@SWBNNT(10,6)的能量为相应阶段反应过程的相对总能量的零点,计算了体系的相对总能量,结果见表3.

表3 α-Ala限域在SWBNNT(10,6)与水的复合环境,手性转变第二通道主要过程,极小点、过渡态包结物体系的零点振动能、单点能及相对总能量Tab.3 The zero-point vibrational energies,single point energies,and relative total energies of minimal points and the transition statesin the main processes of chiral shift second reaction channel whenα-Ala molecular confined in SWBNNT(10,6)/water compelx environment
从表3可以看出,α-Ala限域在螺手性SWBNNT(10,6)与水分子复合环境,在第二个手性转变反应通道上,以1个H2O 和2个H2O 为氢迁移媒介时的最高能垒,分别为193.9kJ·mol-1和166.5kJ·mol-1;以2H2O 为H 转移媒介比以1H2O 为H 转移媒介时低27.4kJ·mol-1.因此,α-Ala在螺手性SWBNNT(10,6)与水分子复合环境下的手性转变反应,第二个反应通道以2H2O 为H 转移媒介时为最佳途径.166.5kJ·mol-1左右的能垒,在体内温度下,考虑到温度的涨落、分子之间的碰撞和体内某种催化作用酶的存在等诸多因素,是能被越过的.这说明了生命体内可以实现α-Ala从左旋体向右旋体的转变,并且发生在体内的螺手性纳米生物通道与水的复合环境下.这从理论上说明,螺手性SWBNNT(10,6)纳米管与水的复合环境,对α-Ala手性转变过程中的氢转移过程具有较好的催化作用,可以作为理想的纳米反应器.
分子结构计算表明:S·2H2O@SWBNNT(10,6)与Sα-Ala相比较,涉及到氢转移的O-H 键长略长;H 与O 的间距短很多;S·(OH-1+1H2O)@SWBNNT(10,6)与S·2H2O@SWBNNT(10,6)相比较,涉及到氢转移的O-H 键的键长和H 与O 的间距,分别不同程度地变长和变短.这是2个H2O 构成的水链,对H 迁移反应能垒有较好地降低作用,是氢氧自由基以及氢氧根与1H2O 构成的链,对H 迁移过程有更好的催化作用的根本原因.INT1·2H2O@SWBNNT(10,6)与INT1 相比较,涉及到氢转移的C-H 键长略长,发生转移的H 与其要转移到的目标原子O 的距离变短,有的甚至短很多.
反应通道研究发现:在SWBNNT(10,6)与水复合环境的α-Ala手性转变反应有2个通道.1是羧基内的H 转移和H 从手性碳向羰基转移顺次实现;2是手性碳上的H 先以水分子为媒介从手性碳转移到羰基O(10).第一通道分为氨基先异构和羧基先异构2条路径,第二通道只有1条路径;每条路径上的氢转移都能以1个或2个H2O 为媒介实现.
势能面计算发现:手性转变过程中的最高能垒均来自H 从手性C向羰基O 转移的过渡态;在第一通道里的两个路径上,以2个H2O 为氢转移媒介时最高能垒被降到最小,最小值为151.0和151.9kJ·mol-1.比只在SWBNNT(9,9)内的302.7kJ·mol-1明显降低,比只在水环境的167.8kJ·mol-1也有所降低.在第二通道的反应路径上,以2个H2O 为氢转移媒介时最高能垒被降到最小,最小值为166.5kJ·mol-1.在第一通道里的a路径上,第一步羧基旋转是无势垒过程,所以a路径更具优势.氧自由基和氢氧根分别与水分子构成的链,使羧基内的H 迁移变成了无势垒过程.
结果表明:SWBNNT(10,6)与水的复合环境,对α-Ala实现手性转变具有较好的催化作用.可以作为理想的纳米反应器,并且在碱性环境中纳米催化的效果更好.α-Ala可以在生命体内螺手性纳米生物通道与水的复合环境下实现从左旋体向右旋体的转变;氢氧根和氢氧自由基与水分子构成的链,对α-Ala在生命体内纳米螺旋通道,实现从左旋体向右旋体的转变也起了不可忽略作用.
[1]George H F,Antimo D'Aniello,Amedeo V,et al.Free D-aspartate and D-alanine in normal and Alzheimer brain[J].Brain Research Bulletin,1991,26(6):983-985.
[2]Robert J T,Archie Bouwer H G,Daniel A P,et al.Pathogenicity and immunogenicity of a listeria monocytogenes strain that requires D-alanine for growth[J].Infection and Immunity,1998,66(8):3552-3561.
[3]刘凤阁,赵衍辉,钱 研,等.孤立条件下手性α-丙氨酸分子结构特性的理论研究[J].吉林师范大学学报,2013,34(4):47-51.
[4]Stepanian S G,Reva I D,Adamowicz L,et al.Conformational behavior ofα-alanine matrixisolationinfrared and theoretical DFT and ab initio study[J].Physical Chemistry A,1998,102(24):4623-4629.
[5]龚 䶮,易 芳,王文清.丙氨酸对映体单晶的变温偏振激光拉曼光谱研究[J].光散射学报,2002,14(3):145-149.
[6]王文清,刘轶男,龚 䶮.手性分子的宇称破缺:D 和L 丙氨酸的变温中子结构研究[J].物理化学学报,2004,20(11):1345-1351.
[7]王佐成,刘凤阁,吕 洋,等.孤立条件下α-丙氨酸分子手性转变机制的DFT 研究[J].吉林大学学报:理学版,2014,52(4):825-830.
[8]王佐成,佟 华,梅泽民,等.水环境下α-丙氨酸分子手性转变机制的理论研究[J].吉林大学学报:理学版,2015,53(1):134-141.
[9]王佐成,赵衍辉,梅泽民,等.α-丙氨酸分子手性转变反应通道及水分子作用的理论研究[J].浙江大学学报:理学版.2015,42(2):189-197.
[10]王佐成,梅泽民,吕 洋.α-丙氨酸分子在扶手椅型SWBNNT(10,6)内的手性转变机制[J].南京大学学报:自然科学版,2015,51(1):206-216.
[11]王佐成,梅泽民,佟 华,等.扶手椅型单壁硼氮纳米管的尺寸对α-丙氨酸手性转变的限域影响[J].武汉大学学报:理学版,2015,61(3):239-246.
[12]Svensson M,Humbel S,Froese R D J,et al.ONIOM:A multilayered integrated MO +MM method for geometry optimizations and single point energy predictions.A test for Diels Alder reactions and Pt(P(t-Bu)3)2 +H2oxidtivae addition[J].Physical Chemistry,1996,100(50):19357-19363.
[13]PARR R G,YANG W.Density-Functional Theory of Atoms and Molecules[M].Oxford University Press,USA,1994.
[14]Rappe A K,Casewit C J,Colwell K S,et al.UFF,a full periodic table force field for molecular mechanics and molecular dynamics simulations[J].Journal of the American Chemical Society,1992,114(25):10024-10053.
[15]Garrett B C,Truhlar D G.Generalized transition state theory.Classical mechanical theory and applications to collinear reactions of hydrogen molecules[J].Journal of Physical Chemistry,1979,83(8):1052-1079.
[16]Garrett B C,Truhlar D G.Criterion of minimum state density in the transition state theory of bimolecular reactions[J].The Journal of Chemical Physics,1979,70(4):1593-1598.
[17]Ishida K,Morokuma K,Komornicki A.The intrinsic reaction coordinate.An ab initio calculation for HNC→HCN and H-+CH4→CH4+H-* [J].The Journal of Chemical Physics,1977,66(5):2153-2156.
[18]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09.Revision D.01[CP].Pittsburgh,U S A:Gaussian,Inc.,Wallingford CT,2013.
[19]梅泽民,王佐成,赵衍辉,等.水环境下布洛芬分子的手性转变机理[J].吉林大学学报:理学版,2015,53(2):331-339.
