人类干细胞线粒体外膜蛋白PPI网络构建与分析
2015-11-19罗天龙
罗天龙,钟 扬
(复旦大学 生命科学学院,上海 200438)
线粒体是真核细胞内由双层高度特化的单位膜包被的重要细胞器,主要功能是通过氧化磷酸化作用合成三磷酸腺苷(ATP),为细胞各种生理活动提供能量.近几年研究发现线粒体还参与细胞分化、细胞信号转导和细胞凋亡等过程,从而调控细胞周期和细胞生长[1-3].线粒体功能异常不仅在肿瘤等疾病的发生发展中具有重要作用,而且在衰老过程中的核心作用已被生物医学界广泛认同[4-5].目前多能干细胞或iPSC技术应用于线粒体相关疾病的机制研究,证实线粒体与多能干细胞的干性维持、分化及体细胞重编程等有着密切关系[6-7].
而线粒体的某些功能只有在特定的组织细胞中才能展现.细胞吞噬新机制的研究,发现吞噬细胞上的线粒体膜蛋白UCP2能降低线粒体膜电位,调控吞噬细胞吞噬凋亡细胞的能力,保持吞噬细胞自身平衡[8].因此,了解人类干细胞中线粒体蛋白的功能及相互作用网络,有助于我们深入认识调控和改善线粒体功能以及修复损伤的线粒体对于衰老疾病预防和治疗的重要作用.
人类线粒体蛋白由核基因和线粒体基因共同编码,包含大约1 500多种蛋白质,现阶段已建立了资源丰富的数据库,包括MitoMiner(http:∥mitominer.mrc-mbu.cam.ac.uk),UniProt(http:∥www.uniprot.org/)、MitoCarta(http:∥www.broadinstitute.org/)、MitoP2(http:∥www.mitop.de)等.其中MitoMiner收录了经过质谱研究和绿色荧光蛋白定位等已公布的线粒体蛋白,还整合了UniProt及MitoCarta中人类和小鼠的资源.这些蛋白质通过相互作用参与相同或相关的细胞活动.如PINK1的转运需要借助线粒体外膜受体蛋白Tom20和转运通道蛋白Tom40,此过程受阻能够导致早发的青少年帕金森氏病[9].而外膜蛋白VDAC1与线粒体内膜蛋白ANT1组成四聚体调控线粒体膜电位,在黑色素瘤细胞的自噬性死亡和转移中具有重要作用[10].神经精神疾病研究表明线粒体外膜蛋白Miro1介导BDNF共同调节线粒体的运输和分布[11].尽管许多线粒体外膜蛋白的功能已经阐明,但目前对于由线粒体外膜蛋白导致的疾病之间是否存在内在的联系还不是很清楚,尤其尚不清楚外膜蛋白之间的互作网络关系.
线粒体外膜蛋白仅占线粒体蛋白总量的约1%,但通过蛋白质的相互作用参与多种重要的生物学过程,影响或决定相关细胞活动.建立蛋白质相互作用关系网络,已成为认识蛋白质功能和蛋白质组学领域的研究热点[12-13].Pagliarini等于2008年报道了哺乳动物线粒体蛋白质组和线粒体疾病的系统鉴定结果,其中分析了14种小鼠组织的线粒体蛋白质组[14].线粒体膜蛋白参与多种生化反应,与线粒体膜间隙蛋白相互作用,调节膜的通透性,促进细胞凋亡等[15-16].线粒体外膜蛋白质间存在着众多调控关系,对其相互作用的研究对于解释线粒体外膜蛋白质的功能和作用机制具有重要意义.本研究旨在通过整合公共数据库资源,建立一个线粒体外膜蛋白互作网络,从中挖掘有用的信息,注释差异基因/蛋白相互作用关系图,解释这些蛋白与生物学功能相关联的途径,为后续生物学意义的深度挖掘提供支持.
1 数据与方法
1.1 线粒体外膜蛋白数据的收集
选择权威谷歌(Google)搜索引擎点击率测试排名前10位的线粒体蛋白公共数据库,通过对涉及的物种以及更新时间进行考察与筛选,确定具备更新速度快、数据量丰富和蛋白同源分析功能等特征的数据库,分别为MitoMiner、SwissProt和MitoP2.以这三个数据库为基础进行线粒体外膜蛋白筛选.经条件过滤,选择具有文献与实验支持的蛋白数据,分别获得98、87和45个注释为定位于线粒体外膜上的蛋白.合并三个数据库的线粒体外膜蛋白,并去除冗余数据.
1.2 线粒体外膜蛋白PPI网络构建
从http:∥www.ncbi.nlm.nih.gov/geo获取人类胚胎干细胞和诱导性多功能干细胞的基因表达谱数据GSE22499[17].该数据集包含15个人类干细胞不同条件下的基因转录变化数据.表达谱数据的处理采用R-project解析,需要用到扩展包Affy和hgu133plus2hsrefseqcdf等(http:∥www.r-project.org).转录表达基因继续放入UniProt蛋白质数据库(http:∥www.uniprot.org)中验证测试,获得干细胞及干细胞线粒体的真实有效表达蛋白数据.
从BioGRID网站(http:∥thebiogrid.org)下载人类蛋白质的PPI数据.在BioGRID首页进入downloads页面,选择BIOGRID-organism,即按物种分类的数据,进行下载.打开压缩包,从中找到人类的相关数据文件BIOGRID-organism-Homo_sapiens.zip并解压,得到全部人类蛋白相互作用数据.
基于BioGRID 的人类蛋白质PPI数据,获得干细胞及线粒体中有效表达蛋白数据对应的PPI数据.PPI网络的图形绘制应用Cytoscape软件(http:∥www.cytoscape.org)实现.
1.3 GO 和KEGG分析
选择网站WebGestalt(http:∥bioinfo.vanderbilt.edu/webgestalt/)提供的GO(Gene Ontology)层次聚类方法,对线粒体外膜蛋白及互作蛋白进行功能分类,及KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集方法,鉴别具有显著意义的富集通路[18].两种分析分别选择hypergeometric测试,统计意义上的显著性P 值取小于0.001.
2 结果
2.1 线粒体蛋白质数据库的选择和比较
现阶段国内外已经建立了许多资源丰富的在线线粒体基因及蛋白质数据库.经过权威谷歌(Google)检索引擎的点击率测试,检索到排名前10 位的线粒体蛋白数据库,分别是MitoMiner、SwissProt、MitoP2、LOCATE、MitoCarta、HMPDb、AMPDb、YMP、Mitoproteome、MTDb(表1).其中点击量最高的是MitoMiner,它较全面地收录了已公布了的质谱研究结果以及绿色荧光蛋白定位鉴定的线粒体蛋白,包含来自人类的321种和小鼠的166种线粒体亚细胞定位的蛋白;并且整合了PubMed、UniProt、GO、OMIM(Online Mendelian Inheritance in Man)、KEGG的资源.这10个数据库收集的线粒体蛋白信息,涉及的物种包含人类、小鼠、果蝇、酵母、脉孢菌、拟南芥、疟原虫、牛、四膜虫等.目前涉及物种最全的是MitoMiner和SwissProt,而收集人和鼠的线粒体蛋白数据库数量较多.YMP数据库是法国人较早研究酵母线粒体蛋白而建立的数据库,近几年没有更新(表1).AMPDb则是由澳大利亚人建立的拟南芥线粒体蛋白数据库,包括实验和软件预测两部分数据.SwissProt现在已经被UniProt整合收并,这也使得数据量更丰富,另外,MitoP2虽然不如MitoMiner和SwissProt数据库优秀,但是它具有蛋白质同源分析、线粒体蛋白质定位等功能.
通过对涉及物种以及更新时间进行考察与筛选(表1),确定具备更新速度快、数据量丰富和蛋白质同源分析功能等特征的数据库,分别为MitoMiner、SwissProt和MitoP2,以此作为线粒体外膜蛋白数据挖掘的基础.

表1 点击率最高的10个线粒体蛋白数据库及涵盖的物种范围Tab.1 The top 10mitochondrial protein database and the species range covers
2.2 线粒体外膜蛋白的筛选和注释信息整理
初步筛选MitoMiner、SwissProt和MitoP2数据库,经条件过滤,选择具有文献与实验支持的蛋白质数据.MitoMiner数据库中存在178个线粒体蛋白,进一步手动筛选找到107个有数据支持的线粒体外膜蛋白.SwissProt数据库比较人性化,从搜索引擎中直接找到84个实验验证的线粒体外膜蛋白.MitoP2数据库中存在935个线粒体蛋白,进一步手动筛选亚细胞定位注释,获得45个线粒体外膜蛋白.3个数据库分别获得107、84和45个注释定位于线粒体外膜上的蛋白质.去除冗余数据后,共得到92个具有文献支持的明确定位于线粒体外膜的蛋白(表2).

表2 数据库中具有文献与实验支持的线粒体外膜蛋白Tab.2 The mitochondrial outer membrane proteins which have literature and experimental support in the database
2.3 线粒体外膜蛋白PPI网络的构建
为了获得人类细胞中与线粒体外膜蛋白可以产生相互作用的蛋白,选择人类胚胎干细胞和诱导性多功能干细胞的基因表达谱数据(GEO number:GSE22499),分析结果显示,在干细胞及线粒体中表达的基因为35 252个.该数据集包含15个人类干细胞不同条件下真实的转录组数据,于UniProt蛋白质数据库验证测试后获得18 710个蛋白,最后至人类蛋白质的PPI数据库BioGRID 中发现14 349条数据.基于BioGRID查询结果和筛选获得的线粒体外膜蛋白数据,确定出干细胞及干细胞线粒体内与线粒体外膜蛋白具有相互作用的真实有效PPI关系数据为3 055个.
PPI关系数据细分以后,发现目前在BioGRID 数据库中记录的线粒体外膜蛋白90个,而与这些蛋白具有直接关系的蛋白数量为1 170个.与线粒体外膜蛋白相关的PPI关系数据中去除冗余数据等,获得1 889条蛋白互作数据.为了直观地展示线粒体外膜蛋白与其他蛋白之间的相互作用关系,利用Cytoscape构建蛋白相互作用网络图(图1).

图1 Cytoscape分析绘制的烟花状PPI网络图Fig.1 The PPI network diagram analysis and drawing by the Cytoscape
连接数前三位蛋白分别是ATF2,DDX3X 和BCL2,链接数分别是191,123和90.而PPI关系网络中hub节点(无标度网络中小部分具有较多连接的节点)的结构重要性与其功能重要性之间存在着相关性.图1展现出链接数最大的节点为ATF2(链接数191),其次两个蛋白为DDX3X 和BCL2(链接数分别为123和90).线粒体外膜蛋白的链接数目大于50的有11个,而链接数目大于10的外膜蛋白数目有46个,占一半以上.蛋白质相互作用网络中具有密集链接的hub节点蛋白,其节点结构重要性与其功能重要性之间存在着相关性[19].此网络中ATF2已被报道与多种癌症有关,还与神经系统方面的肿瘤相关[20].
2.4 GO 和KEGG pathway分析结果
为了证实与线粒体外膜蛋白的互作蛋白,具有功能重要性和通路富集,采用WebGestalt网站提供的分析工具,进行GO 功能分类和KEGG 通路富集.1 260个蛋白的GO 生物途径分类结果如图2所示,细胞凋亡(GO:0016265)和细胞代谢过程(GO:0044237)远高于其他类别.另一方面,KEGG 富集通路结果,表明癌症等疾病和凋亡通路位于前10位.这说明线粒体外膜蛋白的作用,是细胞生长和凋亡所需的基础代谢,其功能异常将会容易导致肿瘤及癌症的发生.
3 讨论
线粒体在真核细胞中参与多种重要的细胞生物学过程,与肿瘤和癌症等疾病密切相关,而线粒体蛋白质跨线粒体内外膜通道转运是维持线粒体功能的重要环节.本研究旨在建立线粒体外膜蛋白与细胞中其他蛋白相互作用的子网络,为研究者提供一种整合数据形成PPI网络及分析网络模体或通路的方法.
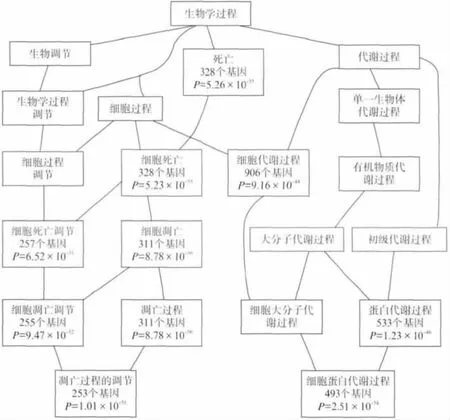
图2 通过WebGestalt获得的GO 分类,线粒体外膜蛋白的互作蛋白富集于细胞凋亡(GO:0016265)和细胞代谢过程(GO:0044237)Fig.2 GO classification obtained by WebGestalt,mitochondrial outer membrane protein interaction protein enriched in apoptosis(GO:0016265)and cell metabolic processes(GO:0044237)
线粒体外膜蛋白的表达具有组织及细胞种类的特异性,本研究不仅整合了MitoMiner、SwissProt和MitoP2等网络数据库,获取线粒体外膜蛋白数据,而且还收集了15个人类干细胞不同条件下的转录组数据集.另外,还需应用数据挖掘等一系列生物信息学方法,筛选及去冗余等,方可获得具有文献支持的高可信度的线粒体外膜蛋白清单.而由人类干细胞转录组数据集,可有效降低其他特定组织细胞中表达蛋白的影响,进而获得干细胞内真实有效的与线粒体外膜蛋白具有相互作用的完整蛋白集合.于BioGRID数据库中找出对应PPI关系数据,Cytoscape进行作图,初步绘制出直观的PPI网络图.
如何从PPI关系网络中识别出跟线粒体外膜蛋白功能相关的模体或通路,是研究生物网络结构和功能的关键一步.hub节点网络结构在生物学上具有显著意义,在本研究结果中的线粒体外膜蛋白与其他蛋白之间的PPI网络中(图1),ATF2是其中链接数最多的蛋白(链接数191),其次两个蛋白为DDX3X 和BCL2(链接数分别为123和90).它们参与多种生物学过程,例如转录、运输、凋亡、癌症肿瘤等.另一方面,PPI网络成员的功能分类及通路富集有助于此网络主要功能的理解.线粒体外膜蛋白PPI网络参与蛋白的GO 和KEGG 结果均表明,细胞凋亡和代谢途径为其富集功能,这为我们认识和理解线粒体外膜蛋白在癌症等疾病中的作用提供了帮助.
[1]Schatz G.The magic garden[J].Annu Rev Biochem,2007,76:673-678.
[2]Hanahan D,Weinberg R A.Hallmarks of cancer:The next generation[J].Cell,2011,144(5):646-674.
[3]Schieke S M,Ma M,Cao L,et al.Mitochondrial metabolism modulates differentiation and teratoma formation capacity in mouse embryonic stem cells[J].J Biol Chem,2008,283(42):28506-28512.
[4]Cheng J,Türkel N,Hemati N,et al.Centrosome misorientation reduces stem cell division during ageing[J].Nature,2008,456(7222):599-604.
[5]Florian M C,Dörr K,Niebel A,et al.Cdc42activity regulates hematopoietic stem cell aging and rejuvenation[J].Cell Stem Cell,2012,10(5):520-530.
[6]Xu X,Duan S,Yi F,et al.Mitochondrial regulation in pluripotent stem cells[J].Cell Metab,2013,18(3):325-332.
[7]Le R,Kou Z,Jiang Y,et al.Enhanced telomere rejuvenation in pluripotent cells reprogrammed via nuclear transfer relative to induced pluripotent stem cells[J].Cell Stem Cell,2014,14(1):27-39.
[8]Park D,Han C Z,Elliott M R,et al.Continued clearance of apoptotic cells critically depends on the phagocyte Ucp2protein[J].Nature,2011,477(7363):220-224.
[9]Silvestri L,Caputo V,Bellacchio E,et al.Mitochondrial import and enzymatic activity of PINK1mutants associated to recessive parkinsonism[J].Hum Mol Genet,2005,14(22):3477-3492.
[10]Wang W J,Wang Y,Chen H Z,et al.Orphan nuclear receptor TR3acts in autophagic cell death via mitochondrial signaling pathway[J].Nat Chem Biol,2014,10(2):133-140.
[11]Su B,Ji YS,Sun X L,et al.Brain-derived neurotrophic factor(BDNF)-induced mitochondrial motility arrest and presynaptic docking contribute to BDNF-enhanced synaptic transmission[J].J Biol Chem,2014,289(3):1213-1226.
[12]Walhout A J,Sordella R,Lu X,et al.Protein interaction mapping in C.elegans using proteins involved in vulval development[J].Science,2000,287(5450):116-122.
[13]Uetz P,Giot L,Cagney G,et al.A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae[J].Nature,2000,403(6770):623-627.
[14]Pagliarini D J,Calvo S E,Chang B,et al.A mitochondrial protein compendium elucidates complex I disease biology[J].Cell,2008,134(1):112-123.
[15]Krauss S,Zhang C Y,Lowell B B.The mitochondrial uncoupling-protein homologues[J].Nat Rev Mol Cell Biol,2005,6:248-261.
[16]Mick D U,Dennerlein S,Wiese H,et al.MITRAC links mitochondrial protein translocation to respiratory-chain assembly and translational regulation[J].Cell,2012,151(7):1528-1541.
[17]Guenther M G,Frampton G M,Soldner F,et al.Chromatin structure and gene expression programs of human embryonic and induced pluripotent stem cells[J].Cell Stem Cell,2010,7(2):249-257.
[18]Zhang B,Kirov S,Snoddy J.WebGestalt:An integrated system for exploring gene sets in various biological contexts[J].Nucleic Acids Res,2005,33:741-748.
[19]Ning K,Ng H K,Srihari S,et al.Examination of the relationship between essential genes in PPI network and hub proteins in reverse nearest neighbor topology[J].BMC Bioinformatics,2010,11:505.
[20]Gozdecka M,Breitwieser W.The roles of ATF2(activating transcription factor 2)in tumorigenesis[J].Biochem Soc Trans,2012,40(1):230-234.
