δ-MnO2的制备和电化学性能研究
2015-11-19朱杨军温祖标
于 峰,朱杨军,李 莉,章 磊,温祖标
(江西师范大学 化学化工学院,南昌 330022)
电化学电容器(Electrochemical Capacitors,ECs)又称超级电容器(SuperCapacitors,SCs),是介于电池与传统电容器之间的一种新型储能器件[1],具有高功率密度、长循环寿命与良好的温度特性等优点,而广泛应用在电动汽车、智能电网、移动发电机设备、不间断电源等领域.根据电能储存与转化机理不同,电化学电容器可分为双电层电容器和法拉第电容器.前者的电极材料为碳材料,以活性炭最为常见[2];后者的电极材料有导电聚合物[3]和过渡金属氧化物[4].在过渡金属氧化物中,如Ru、Mn、Ni、Co、Mo等的氧化物各有其特点[5].其中,MnO2因具有资源丰富、价格低廉、环境友好,多种价态[6]和存在α,β,γ,δ(层状二氧化锰)与λ等[7-8]晶型,自然引起更多科研工作者的兴趣.
δ-MnO2是由[MnO6]八面体通过共用其角顶点和棱,沿一定方向延伸形成的层状结构,其层间距为0.7nm;该层状结构使MnO2具有良好的贯通性、高孔隙度和热稳定性,在层与层之间的通道中,可填有可交换的金属离子M(M=Li,Na+,K+,Cs+,Mg2+,Ca2+,Co2+,Ni2+,Cu2+,Zn2+等).因此,正因为具有优异的离子交换[9]、氧化还原、吸附性能[10]与催化性能[11]等而备受研究者的关注,而被广泛应用于超级电容器[12]、传感器[13]、电池[14-15]、催化等领域.目前,制备δ-MnO2常见的方法有固相反应法[16],水热合成法[17],溶胶-凝胶法[18],液相氧化-还原法[19]等方法.
Anderson等[20]用溶胶-凝胶法制备了MnO2,结果发现,电极材料电容达到了700 F·g-1(在0.1mol·L-1Na2SO4电解液中),并且其材料循环1 500次电容仍高达90%以上;张宝宏等人[21]用固相法制备的纳米MnO2,该材料在1mol·L-1KOH 电解液中电势窗口为-0.1~0.6V,循环伏安测试表明,在不同电流密度下,电极的比电容高达240~325F·g-1,恒流充放电5 000次后电容量衰减很小.以上表明δ-MnO2材料有很大的发展潜力.
本文通过常温下的液相-氧化还原法制备了层状δ-MnO2,用X 射线衍射(X-Ray Diffraction,XRD)、扫描电子显微镜(Scanning Electron Microscopy,SEM)对其物理性质进行了表征、并对其在1 mol·L-1LiOH 和1mol·L-1KOH 电解液中的电化学性能进行了研究.实验结果表明,δ-MnO2在扫描速度为1mV·s-1的速度下,电容达到218F·g-1,甚至在扫描速率高达500mV·s-1时,仍表现出明显的氧化-还原性能,这表明该δ-MnO2具有大电流快速充放电的特性.
1 实 验
1.1 二氧化锰电极材料的制备
在三口烧瓶中加入30mL NaOH 溶液(6mol·L-1),搅拌条件下,逐滴加入0.5mol·L-1MnSO4·H2O 溶液20mL反应10min后,滴加0.5mol·L-1(NH4)2S2O814mL溶液,生成黑色沉淀物,过滤,用去离子水、乙醇洗涤数次,60 ℃干燥得纳米(NH4)-δ-MnO2.然后将其放入马沸炉中于250 ℃下煅烧20min,以除去填充离子NH4+,得纳米δ-MnO2.实验中所用药品均为分析纯试剂.
1.2 材料的表征
用XRD(Cu靶,D8ADVANCE,Bruker,德国)对材料的晶相结构进行分析,扫描范围为5°~90°,管压为40kV,扫描速度10℃·min-1;在空气氛围下采用WRT-3P型热失重分析仪对前驱体进行差热分析,升温速率为5℃·min-1;采用SEM(VEGA3LMU 型,捷克Tescan 公司)观察材料颗粒大小和表面形貌;用BRUKER TENSOR27(德国)傅立叶红外光谱仪测试试样的傅立叶红外光谱(Fourier Transform Infrared Spectroscopy,FT-IR),测试范围4 000~400cm-1,测试前将样品均匀分散在KBr粉末中,压制成透明薄片.
1.3 电池的制备及电化学性能的测试
分别准确称取纳米δ-MnO2、导电石墨烯、粘合剂(Polytetrafluoroethylene,PTFE)试样各0.4g、0.05g、0.05g于一洁净烧杯中,加入适量乙醇,在功率1kW,振幅20%的条件下超声1h,使其混合均匀.在40℃的烘箱中烘干多余的乙醇,然后在辊轧机上压成厚度为0.3mm 的薄片,用打孔器在薄片上截直径为1cm 的圆形电极片,并置于烘箱内干燥至恒重,在10MPa的压力下,压在镍网集流体上,制成电容器的工作电极.
在三电极体系中,以制备的δ-MnO2为工作电极、镍网为对电极、饱和甘汞电极(Saturated Calomel Electrode,SCE)为参比电极.用1mol·L-1LiOH 和1mol·L-1KOH 为电解液,并测定其电化学性能.
2 结果与讨论
2.1 δ-MnO2电极材料的物理表征
2.1.1 δ-MnO2的热重分析
图1是δ-MnO2在空气气氛中的TG 和DTG 曲线.从图中可以看出,试样热失重大致分为3个阶段:(1)脱水阶段:在50~140℃区间,失重为35%,原因是δ-MnO2表面水分子的蒸发和内部结晶水失去,图1对应的分别是80℃和120.9℃两个热吸收峰.(2)层间填充离子失去阶段:此阶段失重区在200~500℃失重量达10%,失重主要原因是因为填充在二氧化锰层与层之间的等离子摆脱二氧化锰物理吸附引起的,在分解过程吸收大量的热,在DTG 图上为390℃处的吸热峰.(3)晶型转变阶段:在500~600℃左右的区间内,出现明显的失重,主要原因是δ-MnO2发生了晶型转变[22].
根据图1的TG图和DTG曲线分析结果可知,在250℃左右煅烧可以把δ-MnO2层与层之间的NH+4除去.

图1 δ-MnO2的TG 和DTG 曲线Fig.1 The TG and DTG curves ofδ-MnO2

图2 δ-MnO2的XRD 图Fig.2 XRD diagram ofδ-MnO2
2.1.2 δ-MnO2电极材料试样XRD 测试
图2是制备试样的XRD 图,从图可知,2θ=12.2°和24.5°处出现两个明显的特征峰[23],在2θ=35°~90°区间内没有衍射峰,由此可知,所制试样为δ-MnO2.
2.1.3 δ-MnO2的傅立叶红外光谱
红外光谱可解释样品的内部精细结构,图3 为δ-MnO2的FT-IR 谱.从图中可知,在波数为3 440.6 cm-1处出现了O-H 伸缩振动吸收谱(3 600~3 000 cm-1),1 635.5,1 384.3,1 194.5,1 111.4cm-1处出现了水中O-H 的弯曲振动吸收谱[24],这可能是因为样品中存有少量水导致的;在450~700cm-1之间为Mn-O 键的吸收谱带,其中有3个明显的特征峰,约636.7cm-1处对应的是Mn(Ⅳ)-O的振动吸收峰,而在500cm-1处为Mn(Ⅲ)-O 的振动吸收峰,这两者不同的主要原因是锰元素的氧化数不同引起的[25],在500cm-1处的吸收峰分裂为511.2cm-1和481.6cm-1两个吸收峰,其原因应该是由于Mn(Ⅲ)-O 所处的化学环境发生细微的变化引起的[26].
2.1.4 δ-MnO2的扫描电镜

图3 δ-MnO2的红外光谱图Fig.3 Infrared spectra ofδ-MnO2
图4是δ-MnO2的SEM 图.从图中可以清楚地看到,样品是由一层层不规则的薄片构成,小薄片之间的分界比较明显,尺度分布较为均匀;这正是δ-MnO2的形貌特征[27].对于作为电极材料而言,材料的大小和相互间的结合方式对其性能的影响很大,总体来看该材料的尺度大小均匀,约为1μm 左右,这使得电极反应时,能充分利用其表面积,这对减少材料的极化和提高材料的电容量有促进作用.

图4 δ-MnO2的SEM 图Fig.4 The SEM images ofδ-MnO2
2.2 δ-MnO2电极材料的电化学性能
2.2.1 δ-MnO2电极材料的循环伏安特性
图5和图6是分别在1mol·L-1KOH 和1mol·L-1LiOH 电解液中不同扫描速率下δ-MnO2的循环伏安行为.从图5,6中可以看到,在两种电解液中,当扫描速率从2mV·s-1增大到500mV·s-1的过程中,一直有明显的氧化还原峰.这说明该材料可用于大电流下快速充放电.对比该材料在两种不同的电解液中的电势窗口可以发现,LiOH 中电势窗口要略大于在KOH 中.这暗示着该材料在LiOH 中的比电容会比在KOH 中的比电容更大.为了证实这一点,我们分别计算了δ-MnO2在两种电解液中不同扫描速率下的比电容,图7所示.

图5 δ-MnO2在KOH 中的循环伏安曲线Fig.5 The curves of cyclic voltammograms ofδ-MnO2in 1mol·L-1 KOH

图6 δ-MnO2在LiOH 中的循环伏安曲线Fig.6 The curves of cyclic voltammograms ofδ-MnO2in 1mol·L-1 LiOH
通过图7 这些实验数据,我们可以大致地知道δ-MnO2的电容量,以及影响电容量的一些因素.在LiOH溶液中电容量由1mV·s-1的261.7F·g-1迅速下降并最终维持在30F·g-1的水平上.而在KOH 溶液中由1mV·s-1的141.7 F·g-1开始迅速下降到最终的20F·g-1左右.由此可以看出,在LiOH 溶液中该材料的电容量要高于(大约33%)在KOH 溶液中,其主要原因是因为Li+的半径要小于K+的半径.使得Li+相对于K+更容易在二氧化锰的层与层之间吸附和脱嵌.并且容易看出,在一定范围内,随着扫描速率增大,对该材料的影响是很大的,超过一定的范围,扫描速率继续增大其电容量基本不发生很大的变化.
2.2.2 δ-MnO2电极材料的恒流充放电特性

图7 LiOH 和KOH 电容量随扫描速率的关系Fig.7 Specific capacitance ofδ-MnO2with scan rate in LiOH and KOH
图8(a)是在LiOH 溶液中的恒流充放电曲线,图8(b)是在KOH 溶液中的恒流充放电.从图8中我们可知,该材料在两种不同的溶液中都具有快速充放电的特点.然而对比发现,在LiOH 中充放电平台会比在KOH 中的充放电平台更长,从这方面也表明δ-MnO2在LiOH 中的比电容大于在KOH 中的比电容,这与循环伏安法测试的结果相吻合.
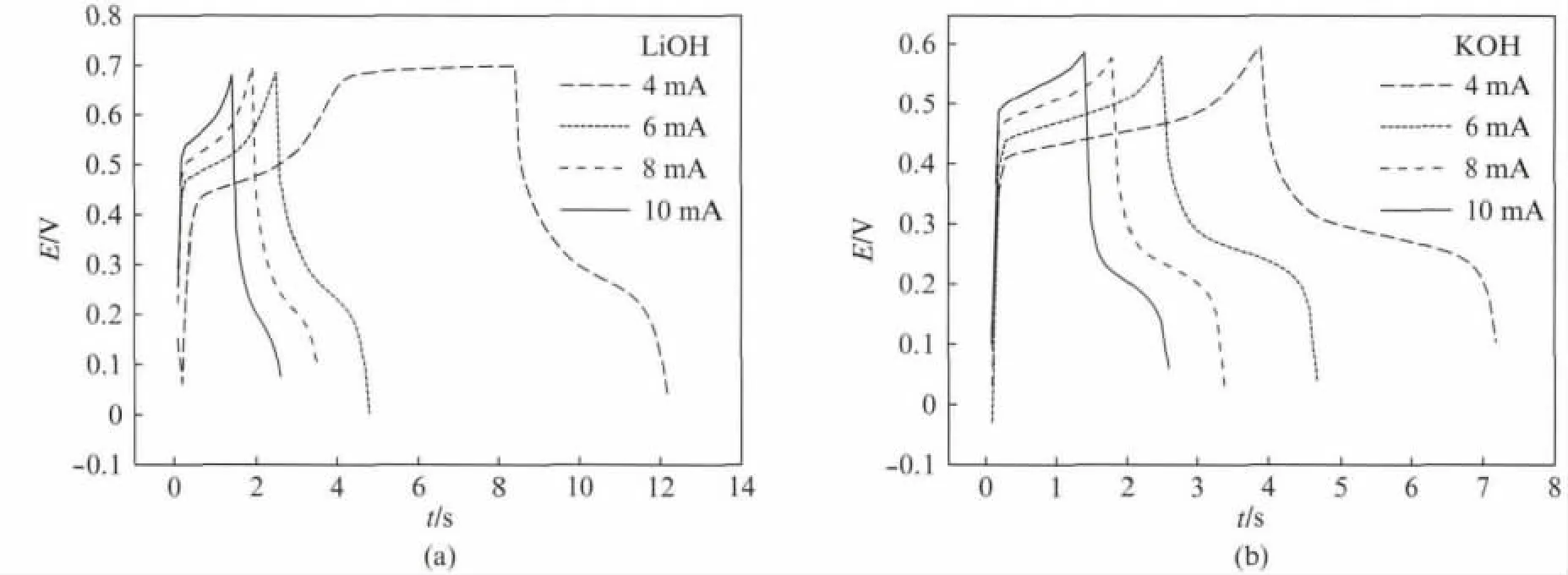
图8 δ-MnO2的恒流充放电图Fig.8 The galvanostatic charge-discharge curves ofδ-MnO2
2.2.3 δ-MnO2电极材料的交流阻抗特性
交流阻抗又叫电化学阻抗谱,是研究ECs电容特性的重要方法之一,图9 是δ-MnO2在LiOH 电解液和KOH 中的交流阻抗曲线.曲线在低频区由部分的圆弧组成,在中频区由近似45°斜线组成.这体现出该材料具有多孔的结构[28].从图中可以知道,曲线的起始点非常接近坐标的零点,这说明该材料的欧姆电阻很小.它包括隔膜、电解液、集流体、电极材料等的电阻以及彼此间的接触电阻[29-30].Nyquist图上的直线斜率偏离虚轴是由于赝电容的影响.用常相元器件(CPE)代替双电层电容元件所得的等效电路图与实验数据相吻合.这也是在500mV·s-1时具有较好行为的CV 曲线的原因.
2.2.4 δ-MnO2电极材料的其他电化学性能
(1)循环寿命性能 图10是δ-MnO2在LiOH 电解液中扫描速率为20mV·s-1时循环1 000次的循环伏安曲线,从图中我们可以发现该材料在循环1 000次之后其形状基本保持不变,而材料的电容量与图形围成的面积有密切关联.所以可认为其比电容量在循环1 000次之后基本不变,说明该材料具有很好的循环稳定性.

图9 δ-MnO2在LiOH 和KOH 中的交流阻抗图Fig.9 Nyquist plots ofδ-MnO2in LiOH and KOH

图10 δ-MnO2在LiOH 电解液中扫描速率为20mV·s-1时循环1 000次Fig.10 The cyclic life ofδ-MnO2at scan rate of 20mV·s-1 in LiOH circular 1 000times

图11 δ-MnO2的电流-时间曲线Fig.11 The current-time curve ofδ-MnO2
(2)漏电流性能 漏电流是在施加恒定电压下,检测饱和充电电容器的残余电流,即“漂流电流”,便可获得漏电流,在保持工作电压的条件下,记录电流随时间的变化趋势,而其最终趋于稳定的电流即为电容器的漏电流,漏电流的来源主要是电解质的不可逆分解和电极材料表面官能团的氧化还原反应[31],从图11中可以看到,该材料的漏电流0.014A.说明该材料性能较好,较稳定.
本文采用溶液氧化还原的方法制备了δ-MnO2.通过X 射线衍射、傅立叶红外光谱、扫描电子显微镜和热重分析等表征手段,发现该δ-MnO2具有比较大的比表面积.测试其循环伏安法我们发现扫描速率从2mV·s-1一直增大到500mV·s-1的过程中,该材料一直有很明显的氧化还原峰出现.表明该物质具有较好的电化学性能,可适用于大电流的充放电.另一方面观察其比电容量与扫描速率的关系可以发现,增大其扫描速率,其比电容量迅速降低并维持一稳定值左右.对比该材料在LiOH 和KOH 两种电解液中的电化学性质可以发现在LiOH 电解液中的比电容量以及最大放电电流等均优于KOH 电解液,这为在δ-MnO2作为电极材料时电解液的选择提供了参考依据.通过测试他的循环寿命发现,在循环1 000次之后该材料比电容量基本不变,说明该材料具有很好的循环稳定性,这一发现为在选择对电池寿命要求高的行业提供了一种新的材料.
[1]吴宇平,张汉平,吴 锋.绿色电源材料[M].北京:化学工业出版社,2008.
[2]高 强,刘亚菲,胡中华,等.中等比表面积高容量活性炭电极材料制备和表征[J].复旦学报:自然科学版,2009,48(1):79-86.
[3]Wang L,Ye Y J,Lu X P,et al.Hierarchical Nanocomposites of Polyaniline Nanowire Arrays on Reduced Graphene Oxide Sheets for Supercapacitors[J].Sci Rep,2013,3(3568):1-9.
[4]Liu Y,Zhang B H,Yang Y Q,et al.Polypyrrole-coatedα-MoO3nanobelts with good electrochemical performance as anode materials for aqueous supercapacitors[J].J Mater Chem A,2013,1(43):13582-13587.
[5]谢小英,张 辰,杨全红.超级电容器电极材料研究进展[J].化学工业与工程,2014,31(1):63-71.
[6]Ghaemi M,Ataherian F,Zolfaghari A,et al.Charge storage mechanism of sonochemically prepared MnO2as supercapacitor electrode:Effects of physisorbed water and proton conduction[J].Electrochim Acta,2008,53(14):4607-4614.
[7]Thackeray M.Manganese oxides for lithium batteries[J].Prog Solid State Chem,1997,25(1):1-71.
[8]Post J.Manganese oxide minerals:Crystal structures and economic and environmental significance[J].Prepr Pap Am Chem Soc,1999,96(7):3447-3454.
[9]吴晓梅,杨春生,奚 峻,等.微米级锂离子电池正极材料尖晶石LiMn2O4的合成及性能[J].复旦学报:自然科学版,2004,43(4):524-529.
[10]茶丽梅,张鹏翔,哈伯迈尔.双层锰氧化物薄膜的制备及其物理性质[J].物理学报,2003,52(2):498-502.
[11]Ahn M,Filley T,Jafvert C,et al.Birnessite mediated debromination of decabromodiphenyl ether[J].Chemosphere,2006,64(11):1801-1807.
[12]Zhao J,Chen H,Shi J,et al.Electrochemical and oxygen desorption properties of nanostructured ternary compound NaxMnO2directly templated from mesoporous SBA-15[J].Microporous Mesoporous Mater,2008,116(1-3):432-438.
[13]Sauvage F,Baudrin E,Tarascon J M.Study of the potentiometric response towards sodium ions of Na0.44-xMnO2for the development of selective sodium ion sensors[J].Sens Actuators B,2007,120(2):638-644.
[14]张敬华,舒 东,张永生,等.层状锂锰氧化物制备及性能改进[J].电池,2004,34(3):196-198.
[15]王永在,廖立兵,黄振宇.多孔锰氧化物材料的制备与性能研究进展[J].材料导报,2004,6(18):43-47.
[16]Gaillot A,Drits V,Manceau A.Structure of synthetic K-Rich phyllomanganate birnessite obtained by high-temperature decomposition of KMnO4-substructures of K-rich birnessite from 1 000 degrees C experiment[J].Microporous Mesoporous Mater,2007,98(2):267-282.
[17]Xu Y H,Feng Q,Kajiyoshi K.Hydrothermal intercalation reaction of nickel hydroxide into layered manganese oxides[J].Chem Mater,2002,14(2):697-703.
[18]Ching S,Welch E J,Hughes S M.Nonaqueous sol-gel syntheses of microporous manganese oxides[J].Chem Mater,2002,14(3):1292-1299.
[19]shen X F,Ding Y S,Liu J.Control of nanometer-scale tunnel sizes of porous manganese oxide octahedral molecular sieve nanomaterials[J].Adv Mater,2005,17(7):805-809.
[20]Pang S C,Anderson M A,Chapman T W.Novel electrode materials for thin-film ultracapacitors:comparison of electrochemical properties of sol-gel-derived and electrodeposited manganese dioxide[J].J Electrochem Soc,2000,147(2):444-450.
[21]张宝宏,张 娜.纳米MnO2超级电容器的研究[J].物理化学学报,2003,19(3):286-288.
[22]杨顺毅,王先友,魏建良,等.Na-Mn-O 正极材料的合成及电化学性能[J].物理化学学报,2008,24(9):1669-1674.
[23]Parant J P,Olazcuaga R,Devalette M,et al.Sur quelques nouvelles phases de formule NaxMnO2[J].Solid State Chem,1971,3(1):1-11.
[24]Devaraj S,Munichandraiah N.Effect of crystallographic structure of MnO2on its electrochemical capacitance properties[J].J Phys Chem C,2008,112(11):4406-4417.
[25]冯传启,张克立,孙聚堂.锂离子电池正极材料尖晶石LiMn2O4的研究现状[J].化学研究与应用,2003,15(2):141-145.
[26]Suresh P,Shukla K,Munichandraiah N.Characterization of Zn and Fe-substituted LiMnO2as cathode materials in Li-ion cells[J].J Power Sources,2006,161(2):1307-1313.
[27]Laurence A,Francois M,Romain D,Variation of the MnO2birnessite structure upon charge/discharge in an electrochemical supercapacitor electrode in aqueous Na2SO4electrolyte[J].J Phys Chem C,2008,112(18):7270-7277.
[28]高 强,刘亚菲,胡中华,等.氧化锰表面改性活性炭电极材料的电化学特性[J].物理化学学报,2009,25(2):229-236.
[29]Rodrigues S,Munichandraiah N,Shukla A.AC impedance and state-of-charge analysis of alkaline zinc/manganese dioxide primary cells[J].J Appl Electrochem,2000,30(3):371-377.
[30]温祖标,刘亚菲,胡中华,等.薄层晶状α-MnO2/活性炭复合电极材料的制备和电化学性质[J].化学学报,2010,68(15):1473-1480.
[31]Hsieh C,Teng H.Influence of oxygen treatment on electric double-layer capacitance of activated carbon fabrics[J].Carbon,2002,40(5):667-674.
