人类SEPT6蛋白对胰腺导管癌细胞系PANC-1迁移和侵袭能力的影响
2015-11-19徐成栋余文博
徐成栋,余 龙,余文博
(1.复旦大学 生命科学学院,上海 200438;2.复旦大学 遗传工程国家重点实验室,上海 200438)
Septin家族成员最早在芽殖酵母中被发现,由于当时只是证明了这些蛋白和细胞的分裂周期有关,所以命名为CDC3,CDC10,CDC11,CDC12[1-4].它们所具有的共通的特点是在蛋白质序列中有一段保守的GTP绑定区域[5].随后人们在哺乳动物中共发现14种septin基因(其中septin13只在人类中发现,septin14只在人类和小鼠中发现)[6],并根据其结构同源性,将它们分成了4类[7].
人类SEPT6是Septin家族中表达谱较广的一类蛋白,它的基因定位于X 染色体上.SEPT6可以以同聚或异聚体的形式发挥功能,有文章报道SEPT2,SEPT6,SEPT7可以形成对称排列的六聚体接头复合物[8],该复合物对细胞和应力纤维的极性有一定的调节作用,并且通过与SOCS7(Suppressor Of Cytokine Signaling 7)互作影响接头蛋白NCK 的入核.当有外界压力使得细胞DNA 发生损伤时,这个三联复合体结构将消失,SOCS7将介导NCK 进入细胞核仁从而通过激活p53蛋白对DNA 的损伤作出应答[9].SEPT6还可以与SEPT9以及SEPT12互作,其中与SEPT12的互作将会改变HeLa细胞的微丝结构[10]等.除此以外,SEPT6和微管之间也存在某种联系,内源消减SEPT6的表达可以提高细胞微管的稳定性[11].
人类SEPT 蛋白家族在病理学上的意义也不容小觑,目前发现了很多由于SEPT 蛋白的过表达、缺失或是融合导致的疾病[12].其中有报道指出在急性淋巴细胞白血病中有MLL 和SEPT6 的融合转录本的出现,这证明了由于染色体异位造成的这种MLL-SEPT6融合蛋白可能会使细胞向恶性增殖转化[13].在前期免疫组化实验中,我们发现了SEPT6在胰腺导管癌中的表达量大大超过了正常组织和癌旁组织,而胰腺导管癌又是众所周知的恶性程度高,手术成功率低并且预后不良的一类癌症,为此我们选取了不同组织来源的细胞系做了Western blot层面的检测,发现在上皮细胞肿瘤中,SEPT6 的表达量略高于其他组,并且在胰腺导管癌来源细胞PANC-1 中量较高.随后我们通过细胞划痕以及Transwell实验观察SEPT6蛋白对PANC-1迁移率和变形能力的影响,意在评估其在生物体内与癌细胞侵袭能力的强弱是否密切相关,期望能为下一步认识和阐述SEPT6的分子工作机制提供一个新的思路和方法.
1 材料和方法
1.1 材料
1.1.1 质粒和细胞株
质粒:pCMV-SEPT6(载体上带有氨苄抗性基因),人类宫颈癌来源的HeLa细胞系,人类结肠癌来源的SW620细胞系,人类胰腺导管癌来源的PANC-1细胞系和SW1990细胞系,人类内皮细胞癌来源的ECV304细胞系(建系时有膀胱癌污染),人类脐静脉内皮细胞系Huvec的原代细胞,人类乳腺癌来源的MCF-7细胞系,人类肝癌来源的Focus细胞系,以上细胞系全为贴壁生长特性.
1.1.2 试剂
DAB显色试剂盒(武汉博士德生物工程有限公司),ECL显色试剂盒(Santa Cruze公司),辣根过氧化物酶联羊抗兔二抗(武汉博士德生物工程有限公司),山羊血清(武汉博士德生物工程有限公司).
1.1.3 SEPT6RNA 干扰片段
干扰片段由吉玛生物公司提供,针对SEPT6 mRNA 位点1 的片段的正向序列为:5’-GAGC UAAAGAUCCGAAGAGdTdT-3’,反向序列为5’-CUCUUCGGAUCUUUAGCUCdTdT-3’,针 对SEPT6mRNA 位点2的片段的正向序列为5’-CGGAGUCCAGAUCUAUCAGdTdT-3’,反向序列为5’-CUGAUAGAUCUGGACUCCGdTdT-3’.
1.2 方法
1.2.1 免疫组织化学
将病理包埋于石蜡中,切片(厚度约5μm),烘干,然后切片置于二甲苯中,浸泡15min后取出依次置无水酒精、95%酒精、80%酒精和70%酒精中依次浸泡5min.用自来水冲洗15min后置于PBS中浸泡.将切片置于3%过氧化氢中浸泡15min,用PBS冲洗干净.取配置好的柠檬酸钠缓冲液100mL,将切片浸没其中,置于微波炉中以中火煮至微沸后1min,取出后室温下自然冷却.随后PBS浸泡,取出滴加50μL 10%二抗同源血清封闭后,将切片放至37℃孵育30min.滴加适当浓度的一抗稀释液(用PBS 稀释),4℃杂交过夜.随后PBS浸泡,5min×3次.切片滴加一定浓度的二抗,37℃孵育30min.随后PBS冲洗.滴加SABC复合物(1∶100)后,37℃孵育30min.置适当量DAB显色剂于切片上,镜检观察显色然后切片置于自来水中冲洗10 min.随后苏木精进行复染并经过与脱蜡步骤相反的脱水的过程,封片后用Olympus BH2光学显微镜进行拍照.
1.2.2 Western blot
收集一定数量细胞室温1 000r/min离心5min回收细胞,用0.5mL PBS清洗细胞两次,弃去上清.在沉淀中加入适量的裂解缓冲液,在4℃转轮上放置30min后12 000r/min离心15min,收集上清.将上清与等量的2×SDS上样液混合煮沸变性后进行聚丙烯酰胺凝胶电泳(先用80V 电泳3min,再用120V电泳80min)然后用BioRad转移系统,将蛋白从聚丙烯酰胺凝胶转至硝酸纤维素薄膜上,冰浴中转移2h,电压为100V.将膜置于丽春红染色液中5~10min,水洗掉染料,标记蛋白标准分子量条带.然后将膜放置于脱脂牛奶封闭缓冲液中,室温下置于摇床1h.将膜置于1∶1 000(2.5%脱脂牛奶稀释)一抗中于4℃摇床上孵育过夜;用洗涤缓冲液洗膜3次,每次10min.按1∶5 000的稀释比加入HRP耦联的抗鼠(兔、羊)抗体,室温下摇床孵育1h;用洗涤缓冲液洗膜4次,每次10min.在膜上加入ECL 发光试剂后于暗室中曝光.
1.2.3 细胞划痕实验
在一块6孔板的底部背面每孔下用记号笔划3条平行的直线,然后将6孔板中接种入转染组与对照组细胞,每孔大约接种4×105个细胞,用完全培养基培养1d,使细胞贴壁(每组做一个复孔).然后换成无血清DMEM 饥饿培养1d.吸走培养基,用白枪头在每孔里划3条平行的线(垂直记号笔所划的线).用灭过菌的PBS轻轻洗3遍,吸走,加入无血清DMEM 培养基.即刻在Olympus BH2光学显微镜下对准交点处观察,每孔选取9个点进行拍照,并记录划痕的宽度,然后置于37℃温箱中培养.6,12,18,24,30h后分别拍照并记录下对应处划痕的宽度变化情况,计算划痕愈合速度.
这2种人工判别方式均依靠经验和技巧进行辨别,依赖监控员的经验和责任感,容易出现人为失误,甚至是舞弊行为。
1.2.4 Transwell实验
按照转染细胞的操作将pCMV-SEPT6质粒,干扰片段分别转染进PANC-1细胞.将细胞中的培养基换为0.5%胎牛清的DMEM,饥饿1d.撤掉培养基,胰酶消化下来,培养基中和,显微镜下计数.1 000r/min离心5min后弃去上清,用0.5%胎牛血清DMEM 重悬,保证细胞密度大约为3×105/mL.在Transwell小室的下层里加入500μL含10%胎牛血清的DMEM.上层里接种入稀释好的细胞200μL.并缓慢放入24孔板中.在12h,24h后对穿过膜的细胞进行10%甲醛固定20min.用棉花擦去小室内侧的细胞,并用台盼蓝对小室外侧的细胞进行染色后Olympus BH2光学显微镜下进行细胞计数.
2 结果
2.1 SEPT6在胰腺导管癌细胞中高表达
我们对从人来源的不同细胞系进行内源的Western blot杂交,其中包括有胰腺导管癌细胞系PANC-1、胰腺导管癌细胞系(脾转移灶)SW 1990、宫颈癌细胞系HeLa、乳腺癌细胞系MCF-7、结肠癌细胞系SW 620、血管内皮(在建立该细胞系时就有被膀胱癌细胞污染)ECV 304,肝癌细胞系Focus,人脐静脉内皮原代细胞Huvec,我们发现SEPT6确实是一类能在不同细胞中表达的广谱蛋白,在非肿瘤来源的Huvec细胞中表达量较低,而在PANC-1、HeLa、MCF-7、SW620,ECV304中的表达量都相对比较高(图1),后者的这些细胞所具有的共同特点都是上皮来源的肿瘤细胞系,它们所形成的肿瘤通常侵袭正常组织能力强,并且恶性程度高.
针对胰腺导管癌细胞SEPT6表达量较高的情况,我们选取了11例不同的胰腺导管癌的肿瘤切片样本做免疫组化,结果显示SEPT6在胰岛、淋巴细胞、胰腺导管上皮细胞中都有较高表达.同时,我们在正常的胰腺导管上皮细胞和癌化的胰腺导管中共取了105个细胞做灰度值评价,发现在肿瘤细胞中SEPT6表达含量非常高,差异性显著(P<0.01)(图2).我们注意到这些高表达的上皮肿瘤细胞中,大部分都是贴近导管的单层柱状上皮或是粘液上皮,而这些肿瘤正是胰腺导管癌最为高发且恶性程度最高的部位.所以我们有理由相信SEPT6和胰腺导管癌的侵袭能力存在一定的联系.

图1 不同细胞系中SEPT6蛋白的表达含量Fig.1 Expression of SEPT6in different cell lines

图2 SEPT6在正常胰腺导管和胰腺导管癌中的表达Fig.2 SEPT6expression in normal pancreas ductal epithelium and pancreatic ductal adenocarcinoma
2.2 SEPT6表达量与胰腺导管癌细胞PANC-1的迁移和侵袭呈正相关
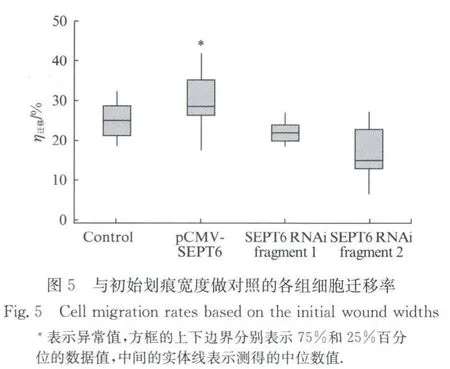
我们将PANC-1细胞的划痕实验分成4组:对照组、pCMV-SEPT6质粒瞬转组、SEPT6干扰片段1瞬转组和SEPT6干扰片段2瞬转组,我们每组分别取14个点进行记录,通过在划痕之后的每6个h记录划痕的宽度,观察细胞的划痕愈合情况,结果如图3所示.与此同时,为验证划痕实验的4 组样本其SEPT6的表达量是否如预期,我们又选取部分细胞做了Western blot实验,结果如图4 所示.实验发现,转染了pCMV-SEPT6 的PANC-1 迁移能力得到增强,划痕的愈合速度也更快.而SEPT6干扰组则迁移性受到了一定的阻碍,特别对于SEPT6干扰片段2瞬转组的情况,其迁移能力下调的结果非常明显(用t-test检验其与对照组的P 值在任何检验时间点都小于0.02).同时,我们选取24h为测量标准时间,计算得到的PANC-1细胞迁移率如图5所示.我们以“划痕愈合宽度/初始划痕宽度”作为在该段时间内PANC-1的细胞迁移率数值.对照组、转入pCMV-SEPT6质粒组、瞬转SEPT6干扰片段1组和SEPT6干扰片段2组中的细胞迁移率分别是0.25±0.04,0.31±0.09,0.22±0.03,0.16±0.06.比较各组之间的数据有统计学意义(P<0.05).

图3 PANC-1细胞划痕实验Fig.3 Wound healing assay for PANC-1cells

在Transwell实验中,我们每组中一孔小室内部接种约6×104个PANC-1细胞.接种完成后的24h和48h分别取出一个小室固定染色,在200倍显微镜下的观察结果如图6(a),我们可以非常明显的观察到在24h,转染pCMV-SEPT6质粒的细胞穿孔数量比对照组高近乎一倍.而转染了SEPT6干扰片段1和片段2的细胞穿膜效果则非常不明显.同样,在48h,这种效果依然在持续.
在24h时,我们观察显微镜视野下穿过小孔基质覆盖的底膜的细胞数如图6(b)所示,我们选取的显微镜200倍视野大约等于1/36的基膜的面积,我们由此可以根据初始的细胞接种量估算出对照组、过量表达SEPT6组和两个SEPT6干扰组的PANC-1的穿膜率分别为(1.58±0.41)%、(2.71±0.34)%、(0.92±0.15)%和(0.77±0.13)%,并且通过48h的计数,我们发现随着时间的延长,各组的穿膜率都会有所增加,但是其穿膜率与时间之间不存在绝对的正比例关系.
3 讨论

图6 Transwell实验结果Fig.6 Result of Transwell assay
我们知道,胰腺导管癌是一类常见的并且预后较差的肿瘤,它的恶性程度体现在两个方面:一个是该癌细胞的增殖能力,另一方面则是癌细胞迁移能力和对其他正常细胞的侵袭能力.后者决定了该细胞能在多大的程度上从身体组织的一个病原灶移动到另一个组织或区域中,借助血道转移或是淋巴转移更快地扩散到全身的部位.所以检测胰腺导管癌细胞的迁移和侵袭能力非常重要.
通过Western blot实验,我们发现在胰腺导管癌、宫颈癌、乳腺癌、结肠癌以及带有膀胱癌特性的细胞中SEPT6的表达含量都比较高,它们都是上皮来源的肿瘤细胞系.同时,我们可以观察到如Huvec的原代细胞中,SEPT6表达量不高,我们推测SEPT6在正常细胞和肿瘤细胞中存在有表达差异.另外,我们注意到SW1990也是一株胰腺导管癌细胞,但SEPT6表达量没有预期的高,我们推测由于PANC-1属低度分化癌细胞,其恶性程度明显高于属于中度分化的SW1990癌细胞,其迁移和侵袭能力比后者强出很多,而SEPT6在这其中发挥了重要的生物学作用.因此最终导致了SEPT6表达量上的差异.
对11例胰腺导管癌病理样本的SEPT6杂交免疫组化实验也如我们所预期的那样,SEPT6的表达量比起正常胰腺导管有显著上升,并且在胰腺导管癌的好发且恶性程度高的部位,如柱状上皮和粘液上皮中SEPT6表达量较高.可以想象,当胰腺导管的上皮细胞发生病变之后,SEPT6的表达量会因为某些分子的调控而异常升高,同时,这层癌变的细胞过快地增殖使得细胞向管腔内突起形成肿瘤,并有癌细胞脱落顺着导管内的胰腺分泌物进入十二指肠或其他身体组织,再侵袭其他的正常细胞.结合正常和癌变胰腺导管的组织芯片分析数据,可以得到胰腺导管癌的病理分型依据,以此可以将SEPT6蛋白杂交作为病理判断的初步筛选工具,结合其他的诊断指标,更为快速和方便的为病患服务.
PANC-1细胞划痕实验和Transwell的实验结果都趋向一致,显示了SEPT6超量表达组较快的划痕愈合速度及较高的变形穿膜能力,提示SEPT6表达量与PANC-1细胞的迁移和侵袭能力正相关,SEPT6干扰组的结果则正好相反.实际上,无论是正常或是病理的细胞,在迁移和侵袭的过程中,都会牵涉到细胞骨架的重构,SEPT 家族的蛋白在这中间扮演了如脚手架蛋白等之类的角色[15],意义重大,如果能观察到SEPT6在大部分的肿瘤中都承担着这样的生物学功能,则SEPT6有望成为一个检验肿瘤的侵袭力的标志物.而我们针对SEPT6蛋白的药物设计是否也可以对肿瘤的治疗和预防有借鉴和应用的价值?
对于本实验来说,我们发现的只是胰腺导管中存在的某个生物学现象,但是并未对其分子学机制做更深一步的探究,特别是在与迁移相关的关键信号传导开关分子上,如Rac,Rho等小家族中,我们可以通过互作关系找出它们之间存在的关系网络.或者观察SEPT6是否与细胞膜上分子如β-catenin等分子的表达量之间的联系来作为切入点,更准确地判断SEPT6对细胞迁移和侵袭是直接还是间接的促进作用.
值得我们注意的是,在实验中,我们发现SEPT6蛋白在上皮肿瘤细胞中的含量是比较高的.而上皮细胞在胚胎发育过程中具有活动能力,在向间质细胞转化的过程类似于肿瘤形成的过程.基于以上的研究事实,我们可以大胆地猜测是否存在着SEPT6调控上皮细胞间质化的可能性,并使得形成的癌细胞与周围细胞分离,通过血液循环播种形成新肿瘤病灶.
肿瘤的发生发展是一个复杂而漫长的过程,现代科学所认知的也仅仅是冰山一角.我们认为可以进一步的揭示SEPT 家族蛋白的生物学功能,并且发现其与肿瘤之间的联系,以期在临床的快速诊断和预防中得以应用,为病患提供快速地针对性治疗方案打下基础.
[1]CHANT J.Septin scaffolds and cleavage planes in Saccharomyces[J].Cell,1996,84(2):187.
[2]COOPER J A,KIEHART D P.Septins may form a ubiquitous family of cytoskeletal filaments[J].The Journal of Cell Biology,1996,134(6):1345-1348.
[3]LONGTINE M S,DEMARINI D J,VALENCIK M L,et al.The septins:roles in cytokinesis and other processes[J].Current Opinion in Cell Biology,1996,8(1):106-119.
[4]HARTWELL L H,CULOTTI J,PRINGLE J R,et al.Genetic control of the cell division cycle in yeast[J].Science,1974,183(4120):46-51.
[5]HALL P A,RUSSELL S E.The pathobiology of the septin gene family[J].The Journal of Pathology,2004,204(4):489-505.
[6]HALL P A,JUNG K,HILLAN K J,et al.Expression profiling the human septin gene family[J].The Journal of Pathology,2005,206(3):269-278.
[7]KINOSHITA M.Assembly of mammalian septins[J].Journal of Biochemistry,2003,134(4):491-496.
[8]MOSTOWY S,COSSART P.Septins:The fourth component of the cytoskeleton[J].Nature Reviews Molecular Cell Biology,2012,13(3):183-194.
[9]KREMER B E,ADANG L A,MACARA I G.Septins regulate actin organization and cell-cycle arrest through nuclear accumulation of NCK mediated by SOCS7[J].Cell,2007,130(5):837-850.
[10]DING X,YU W,LIU M,et al.SEPT12interacts with SEPT6and this interaction alters the filament structure of SEPT6in HeLa cells[J].Journal of Biochemistry and Molecular Biology,2007,40(6):973.
[11]KREMER B E,HAYSTEAD T,MACARA I G.Mammalian septins regulate microtubule stability through interaction with the microtubule-binding protein MAP4[J].Molecular Biology of the Cell,2005,16(10):4648-4659.
[12]CONNOLLY D,ABDESSELAM I,VERDIER-PINARD P,et al.Septin roles in tumorigenesis[J].Biological Chemistry,2011,392(8-9):725-738.
[13]CERVEIRA N,MICCI F,SANTOS J,et al.Molecular characterization of the MLL-SEPT6fusion gene in acute myeloid leukemia:identification of novel fusion transcripts and cloning of genomic breakpoint junctions[J].Haematologica,2008,93(7):1076-1080.
[14]SURKA M C,TSANG C W,TRIMBLE W S.The mammalian septin MSF localizes with microtubules and is required for completion of cytokinesis[J].Molecular Biology of the Cell,2002,13(10):3532-3545.
[15]SPILIOTIS E T,KINOSHITA M,NELSON W J.A mitotic septin scaffold required for Mammalian chromosome congression and segregation[J].Science,2005,307(5716):1781-1785.
