上皮性卵巢癌组织中ATG5、Beclin1与P53的表达及相关性研究
2015-11-18曹蒙赵书君郭欢欢刘星烁韩会会张敏李红雨
曹蒙 赵书君 郭欢欢 刘星烁 韩会会 张敏 李红雨
(郑州大学第三附属医院 妇产科 河南郑州 450052)
上皮性卵巢癌是妇科常见的恶性肿瘤之一,死亡率居妇科肿瘤首位。因缺乏早期诊断指标,多数患者确诊时已属晚期,5年生存率不超过30%[1]。近年研究表明,自噬是细胞内物质代谢的一条重要途径,自噬调控机制的失活与肿瘤的发生发展密切相关[2-3]。自噬相关基因ATG5、Beclin1是参与自噬调节的关键基因,P53是参与肿瘤发生、发展及细胞凋亡的重要基因。已有研究显示ATG5除参与自噬过程外,在促凋亡进程中也起到重要作用[4]。而目前关于ATG5在上皮性卵巢癌中的表达及其与P53表达相关性研究较少,因此本研究采用免疫组化SP法及RTPCR检测ATG5、Beclin1及P53在不同卵巢组织的表达,探讨ATG5、Beclin1在上皮性卵巢癌发生、发展中的作用及其与P53的关系,旨在为卵巢癌的治疗寻找新的方向。
1 材料与方法
1.1 标本采集 收集郑州大学第三附属医院和第一附属医院2013年9月至2015年6月的84例标本,其中上皮性卵巢癌标本34例,良性卵巢组织及正常卵巢组织各25例,正常卵巢组织来源于因子宫肌瘤、子宫腺肌症等行子宫及单/双附件切除者的卵巢。恶性卵巢组织中浆液性癌20例;黏液性癌7例;其他类型7例;按国际妇产科(FIGO 2000)临床分期及病理分级标准:Ⅰ期5例,Ⅱ期9例,Ⅲ期9例,Ⅳ期11例;G19例,G211例,G314例。标本经病理学证实,均未接受术前放疗、化疗。
1.2 主要试剂 免疫组化主要试剂:ATG5、Beclin1及P53多克隆抗体(武汉三鹰生物科技公司);两步法兔/鼠通用免疫组化试剂盒(武汉三鹰生物科技公司)RTPCR主要试剂:RNA提取试剂盒(康为世纪)、反转录试剂盒(TOYOBO),引物合成(金瑞斯生物科技)。
1.3 研究方法
1.3.1 免疫组化染色检测 采用免疫组化SP法,按照试剂盒方法进行操作。石蜡切片常规脱蜡水化,置于枸橼酸缓冲液中煮沸进行抗原修复,然后逐步滴加过氧化物酶阻断剂(37°避光20 min),血清封闭(1%脱脂奶粉避光30 min),一抗(4°孵育过夜),二抗(37°孵育30 min),DAB染色,苏木紫复染,脱水,透明,封片。以PBS代替一抗作阴性对照。
判断标准:阳性结果判定:胞质或胞核内出现棕黄色颗粒为阳性。依照切片中细胞的染色强度(抗原含量)和阳性细胞总数进行分析。每张切片至少观察5~10个高倍镜视野。细胞阳性着色程度:背景清晰无色为0分,轻度着色为1分;中度着色为2分;重度着色为3分。阳性细胞数量:①1分:阳性细胞数<25%;②2分:阳性细胞数25%~75%;③3分:阳性细胞数>75%。①+②为0~2分,计作免疫组织染色阴性,3~6分计作免疫组织染色阳性。
1.3.2 RT-PCR方法 ①组织RNA的提取:将组织在液氮中磨碎,每50~100 mg组织加入1 ml RNA提取液,溶液裂解后经氯仿等提取细胞总RNA以DNA/RNA测定仪测定RNA的纯度和浓度,调整mRNA浓度在1.8~2.0。②cDNA的合成按反转录试剂盒说明进行。③引物设计见表1,以NADPH作为内参照,反应体系为:2×PCRMaster-Mix 10μl,上、下游引物各0.6μl,cDNA模板10μl,去离子水8.4μl,总体积为20μl。PCR条件为:95℃1 min,95℃15 s,60℃45 s,共40个循环。每个样本设置3个复孔,同时设置无cDNA模板的空白对照。记录每个反应管中的荧光信号达到所设定的阈值时所经历的循环数(即CT值)。用2-△△CT表示mRNA的相对表达量(△CT=CT目的基因-CT内参,△△CT=△CT实验组-△CT对照组)。

表1 ATG5、Beclin1及P53的引物设计
1.4 统计学分析 应用SPSS 16.0软件进行统计学处理,RT-PCR数据采用t检验,阳性率比较采用Fisher确切概率法,相关性检验采用Spearman法,P<0.05为差异具有统计学意义。
2 结果
2.1 免疫组化
2.1.1 ATG5、Beclin1及P53在不同卵巢组织中的表达 ATG5、Beclin1的表达主要在细胞质内,P53主要表达在胞核内,见图1。ATG5、Beclin1在正常卵巢组织、良性卵巢肿瘤组织及卵巢癌组织中的表达阳性率,两两比较差异均有统计学意义(P<0.05)。P53在卵巢癌组织中的表达阳性率与良性卵巢组织、正常卵巢组织相比,差异有统计学意义(P<0.01),而良性卵巢组织与正常卵巢组织表达阳性率比较,差异无统计学意义(P>0.05)。见表2。
2.1.2 卵巢癌组织中ATG5、Beclin1和P53的表达与临床病理特征的关系 不同临床分期、病理分期的卵巢癌组织中的ATG5、Beclin1及P53的表达比较,差异均有统计学意义(P<0.05),而不同年龄、病理类型及淋巴转移的ATG5、Beclin1及P53的表达比较,差异均无统计学意义(P>0.05)。见表3。
2.1.3 上皮性卵巢癌组织中ATG5、Beclin1及P53蛋白表达的相关性 Spearman相关性分析显示,上皮性卵巢癌组织中ATG5与Beclin1蛋白表达呈正相关、ATG5与P53、Beclin1与P53蛋白表达均呈负相关(P<0.05)。见表4、表5。

表2 ATG5、Beclin1及P53在不同卵巢组织中的表达阳性率(n,%)

表3 卵巢癌组织中ATG5、Beclin1和P53的表达与临床病理特征的关系(n,%)
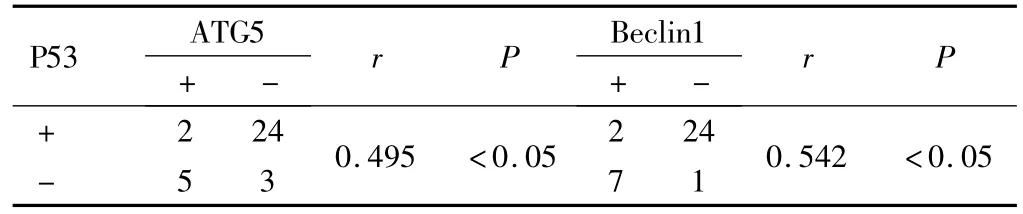
表4 上皮性卵巢癌组织中P53与ATG5、Beclin1蛋白表达的相关性
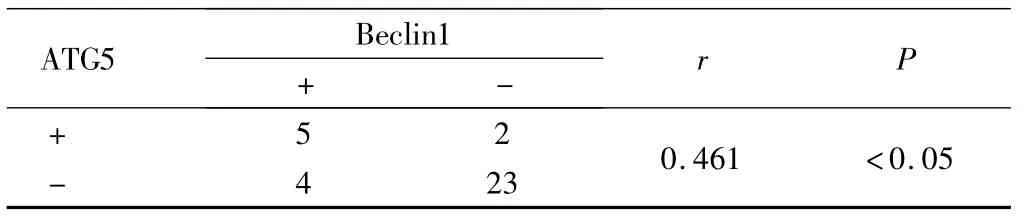
表5 上皮性卵巢癌组织中ATG5与Beclin1蛋白表达的相关性
2.2 RT-PCR 上皮性卵巢癌组织中ATG5、Beclin1的表达低于良性卵巢肿瘤组织及正常卵巢组织,良性卵巢组织低于正常卵巢组织(P<0.05)。上皮性卵巢癌组织中P53的表达高于良性卵巢组织及正常组织(P<0.05),但良性卵巢组织与正常卵巢组织相比,差异无统计学意义(P>0.05)。见表6。
3 讨论
在真核细胞中,自噬是细胞通过降解自身胞质中的部分蛋白和部分细胞器以度过饥饿,并清除氧化损伤的异常大分子及细胞器,从而在应激中维持细胞稳态的过程[5]。目前关于肿瘤细胞自噬的研究报道不一,有研究表明肿瘤细胞的自噬活性降低,也有研究显示某些肿瘤细胞保持了较高的自噬活性,如胃癌、结肠癌、肝癌、乳腺癌、宫颈癌等[6-7]。
表6 ATG5、Beclin1与P53在不同卵巢组织中mRNA的相对表达量(±s)
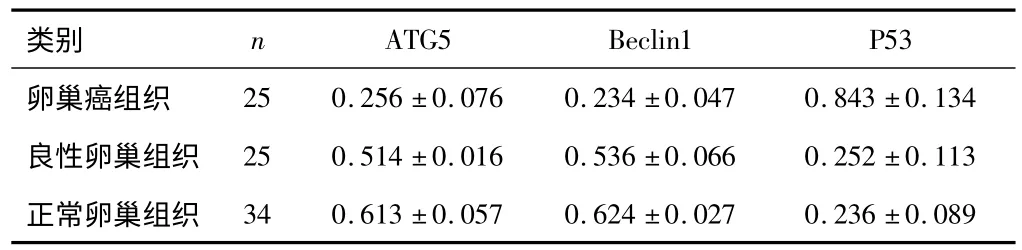
表6 ATG5、Beclin1与P53在不同卵巢组织中mRNA的相对表达量(±s)
类别 n ATG5 Beclin1 P53卵巢癌组织25 0.256±0.076 0.234±0.047 0.843±0.134良性卵巢组织 25 0.514±0.016 0.536±0.066 0.252±0.113正常卵巢组织34 0.613±0.057 0.624±0.027 0.236±0.089

图1 ATG5、Beclin1及P53在不同卵巢组织中的蛋白表达情况(×400)
ATG5是调控自噬的重要基因,在自噬体膜的延伸阶段需要2个类泛素蛋白质系统介导:ATG5-Atg12结合系统和ATG8-PE结合系统。ATG5与Atg12形成的复合物定位于自噬体的表面,促进自噬体膜的延伸扩张,诱导自噬体的形成,是自噬体形成的必要因素[8]。Beclin1是第一个发现的哺乳动物自噬基因。研究表明,Beclin1主要对自噬体的形成和成熟进行调控,进而诱导自噬以促进肿瘤细胞凋亡,并抑制其增殖功能[9]。P53在自噬中也发挥着重要的作用,在细胞核中P53可通过激活mTOR上游一些调节因子而上调细胞自噬,这些因子主要包括PTEN、AMPK、TSC2、sestrin1和sestrin2等;而在细胞质中,P53对细胞自噬具有负性调节作用,可抑制细胞自噬的发生。虽调节机制复杂,但P53突变可使P53介导自噬发生改变导致肿瘤发展[10]。
本研究显示,在卵巢癌组织中ATG5、Beclin1呈低表达,P53呈高表达,且随病理分期的改变而不同。ATG5与Beclin1呈正相关,二者与P53呈负相关。在正常情况下,机体通过细胞自噬清除衰老的细胞器,维持自我更新。当肿瘤细胞增殖活跃时,引起P53的活性改变,P53促使自噬相关基因ATG、Beclin1表达降低,从而降低肿瘤本身的自噬活性。由于肿瘤细胞凋亡不足、自噬功能下降,导致本应该通过凋亡或自噬性死亡的细胞不能发生凋亡或自噬性死亡,引起细胞异常增多,最终导致癌变。
综上所述,卵巢癌自噬相关基因ATG5、Beclin1与凋亡相关基因P53在卵巢癌的发生、发展中起协调作用,对其进行联合检测,有助于了解和判断卵巢癌的进展程度及患者的预后情况,为寻找治疗卵巢癌提供新的治疗靶点。
[1]姚俊阁,李红雨,赵书君,等.卵巢上皮性癌组织中SOX2和CyclinD1的表达[J].郑州大学学报(医学版),2014,49(3):247-250.
[2]Helgason G V,Holyoake T L,Ryan K M.Role of autophagy in cancer prevention,development and therphy[J].Essays Biochem,2013,55(1):133-151.
[3]Leone R D,Amaravadi R K.Autophagy targetable linchpin of cancer cell metabolism[J].Trends Endocrinol Metab,2013,24(4):209-217.
[4]Yousefi S,Simon H U.Apoptosis regulation by autophagy gene5[J].Crit Rev Oncol Hematol,2007,63(3):241-244.
[5]Coto-Montes A,Boga J A,Rosales-Corral S,et al.Role of melatonin in the regulation of autophagy and mitophagy:are-view[J].Mol Cell Endocrinol,2012,361(1/2):12-23.
[6]Leone R D,Amaravadi R K.Autophagy:a targetable linchpin of can-cer cell metabolism[J].Trends Endocrinol Metab,2013,24(4):209-217.
[7]Pandey S,Chandravati.Autophagy in cervical cancer:an emerging therapeutic target[J].Asian Pac JCancer Prev,2012,13(10):4867-4871.
[8]Kaiser S E,Mao K,Taherbhoy A M,et a1.Noncanonical E2 recruitment by the autophagy E1 revealed by Atg7-Atg3 and Atg7-Atg10 structures[J].Nat Struct Mol Biol,2012,19(12):1242-1249.
[9]许传杰,赵广通,孔德娟,等.电离辐射对卵巢癌细胞SKOV3中Beclin1基因的影响[J].中华放射医学与防治杂志,2011,31(5):551-554.
[10]韦艳,吴冰.细胞自噬与肿瘤[J].海南医学,2014,(16):2413-2415.
