经穿膜肽与PEG修饰的核糖体失活蛋白Gelonin抗肿瘤作用的研究
2015-11-18张娅洁王慧媛陈应之汤懿斯杨志民黄永焯
张娅洁,王慧媛,陈应之,汤懿斯,3,杨志民,黄永焯
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津 300070;2.中国科学院上海药物研究所,上海 201203;3.广州中医药大学热带医学研究所,广州 510405;4.美国密西根大学药学院,美国密西根州 48109)
论著
经穿膜肽与PEG修饰的核糖体失活蛋白Gelonin抗肿瘤作用的研究
张娅洁1,2,王慧媛2,陈应之2,汤懿斯2,3,杨志民1,4,黄永焯2
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津 300070;2.中国科学院上海药物研究所,上海 201203;3.广州中医药大学热带医学研究所,广州 510405;4.美国密西根大学药学院,美国密西根州 48109)
目的:通过对核糖体失活蛋白Gelonin进行化学修饰,利用穿膜肽和聚乙二醇(PEG)偶联来提高其到达肿瘤部位和进入肿瘤细胞的能力,使Gelonin更高效地发挥抑瘤作用。方法:利用FPLC Superdex75分子筛预装柱纯化系统对所修饰的Gelonin进行纯化后,在不同细胞系测试细胞毒性;通过倒置荧光显微镜、流式细胞分析技术等对药物进入纤维肉瘤细胞HT1080的能力进行评价;采用小动物活体成像技术考察药物体系在荷瘤动物体内的分布情况。结果:采用分子筛色谱纯化可以得到纯度相对较高的修饰产物,其毒性较无修饰的Gelonin强,且在HT1080细胞系作用最明显;细胞摄取结果显示,与未修饰的Gelonin相比,该药物体系具有更高的细胞摄取效率;动物成像结果表明,PEG5000修饰可以改变Gelonin在动物体内的分布情况,增加在肿瘤的药物蓄积。结论:穿膜肽和PEG5000修饰后的Gelonin有较高的肿瘤细胞摄取和杀伤能力,药物在肿瘤的蓄积量较高,从而增强了药物的抑瘤效果。
核糖体失活蛋白;聚乙二醇;低分子量鱼精蛋白;抗肿瘤;Gelonin
Gelonin是一种来源于植物、具有高效细胞杀伤效力的核糖体失活蛋白。一旦能进入细胞内,只要极少分子的Gelonin便可以杀灭一个肿瘤细胞[1-2]。然而,同其他生物大分子药物一样,体内稳定性差、半衰期短以及细胞摄取效率低成为影响Gelonin抗肿瘤应用的瓶颈问题。细胞穿膜肽(cell-penetrating peptides,CPPs)介导大分子给药是近年来蛋白药物的研究热点。CPPs是一类富含精氨酸或赖氨酸的多肽,序列一般少于20个氨基酸。通过共价偶联、基因重组等手段可以将穿膜肽与包括细胞毒素在内的蛋白连接,介导后者入胞。低分子量鱼精蛋白(low molecular weight protamine,LMWP)是从经嗜热菌蛋白酶处理的天然鱼精蛋白酶解产物中分离得到一个多肽[3-6],由Yang教授的研究团队发现,是目前研究较广泛的穿膜肽。体内研究实验表明,LMWP没有免疫原性,是安全性较好的细胞穿膜肽[7-8]。聚乙二醇(polyethylene glycol,PEG)修饰是在1977年由Abuchowski等[9-10]发展的一种蛋白修饰方法,主要用于提高蛋白的稳定性及体内半衰期。
1 材料与方法
1.1 蛋白的分离与纯化重组Gelonin蛋白的C端通过酰胺键与LMWP的N端半胱氨酸上的氨基偶联,然后将末端含有马来酰亚胺基团的PEG5000-Mal与Gelonin-LMWP末端半胱氨酸的巯基进行反应,从而得到蛋白修饰产物。采用快速蛋白液相色谱(flow protein liquid chromatography,FPLC)的Superdex 75(GE Healthcare)分子筛柱将连接产物提纯。先后用20%的乙醇和超纯水以0.3 mL/min流速冲洗预装柱20 min后,用流动相磷酸盐缓冲液(phosphate buffered saline,PBS)进行柱平衡,检测波长为280 nm。基线到达平衡后,将样品(0.22 μmol滤膜过滤)推入1 mL上样环内,控制FPLC的七通阀将样品注入柱内,进行分离纯化。
利用SDS聚丙烯酰胺凝胶电泳对收集产物的纯度进行鉴定。将FPLC纯化后所收集的两个吸收峰的收集液分别用10 kDa的超滤管(美国Merk Millipore公司)超滤浓缩至1 mL。分别取10 μL浓缩液加入2.5 μL加样缓冲液后,沸水浴煮样10 min变性蛋白。以每孔5 μL的量上样到10%的SDS聚丙烯酰胺凝胶胶孔。以80 V电压跑胶150 min后,用固定液(10%乙酸和2.5%异丙醇的水溶液)固定凝胶3 min,考马斯亮蓝染色3 h后用洗脱液(10%乙酸)洗脱,5 h后拍摄。
1.2 细胞培养人纤维肉瘤HT1080细胞与人脑星形胶质母细胞瘤U87细胞的培养液为DMEM基本培养基加10%FBS(胎牛血清)。人乳腺癌MCF-7细胞与人宫颈癌HeLa细胞的培养液为RPIM1640培养基加10%FBS。所有细胞均在5%二氧化碳培养箱中37℃恒温培养。
1.3 细胞毒性测试利用MTT法对核糖体失活蛋白在HT1080、U87、MCF-7和HeLa 4种肿瘤细胞中的毒性进行检测。将细胞以5×103的孔密度接种到96孔板中,上述培养条件下培养12 h后分别将Gel(即Gelonin)、Gel-LMWP-PEG5000加入细胞,终浓度为10-9至10-5mol/L。37℃恒温培养72 h后,将孔内培养基轻轻吸出,加入100 μL含有5‰MTT溶液的培养基。继续培养4~6 h后,轻轻吸出孔内所有液体并加入200 μL DMSO(二甲基亚砜),室温震摇孵育至孔底无紫色不溶物。最后用酶标仪检测各孔在OD490 nm和OD650 nm的吸收波长,利用以下公式进行计算:
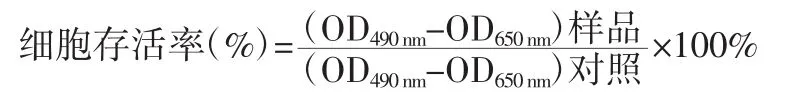
使用Prism软件计算各种细胞的IC50(半数抑制浓度)并绘制曲线。
1.4 肿瘤动物模型建立取处于对数生长期的HT1080细胞消化后离心,弃去上清后用PBS吹洗并离心。用一定量PBS重悬细胞后,以细胞计数板计数。将待接种裸鼠(Balb/C nude)放入生物安全柜的麻醉装置中,加入异氟烷对小鼠进行麻醉。用75%酒精棉球擦拭待接种部位后,用无菌注射器将200μL细胞悬液(约107个细胞)注入皮下。待肿瘤体积约150mm3,使用该肿瘤模型动物进行后续实验。
1.5 荧光标记
1.5.1 FITC标记称取一定量的FITC(异硫氰酸荧光素)粉末溶于无水DMSO中,使终浓度为50 mmol/L。将充分溶解的FITC以摩尔比1∶5(蛋白∶FITC)缓慢滴加入蛋白溶液,反应体系为pH 7.4的PBS缓冲液,置于4℃,轻摇反应过夜。利用FPLC脱盐柱(GE Healthcare,流动相为PBS,流速为1 mL/ min)除去游离FITC。将标记后的蛋白冷冻干燥,加入1 mL PBS复溶冻干样品,BCA法测量蛋白浓度。
1.5.2 CY5标记称取一定量NHS-CY5(N-羟基琥珀酰亚胺修饰的三氢-吲哚菁型染料)粉末溶于无水DMSO中,使终浓度为30 mmol/L。将充分溶解的CY5以摩尔比1∶3(蛋白药物∶CY5)缓慢滴加入蛋白溶液,反应体系为pH 7.4的PBS缓冲液,4℃震摇反应过夜。利用FPLC脱盐柱(GE Healthcare,流动相为PBS,流速为1 mL/min)除去游离CY5。将标记蛋白冷冻干燥,加入1 mL PBS复溶冻干样品,并用BCA法测量蛋白浓度。
1.6 细胞摄取
1.6.1 细胞摄取观察利用倒置荧光显微镜(日本奥林巴斯公司,IX81)观察人纤维肉瘤HT1080细胞对药物体系的摄取情况。将细胞以5×104的孔密度接种到24孔板中,细胞培养箱中培养24 h。将FITC标记的Gelonin、Gelonin-LMWP-PEG5000分别以5 μmol/L的终浓度加入孔中,37℃培养3.5 h后,加入Hochest 33342(终浓度为5 μg/mL)避光孵育20 min。弃掉培养基,用PBS润洗后,用台盼蓝在37℃下孵育10 min以淬灭胞外荧光。PBS洗净台盼蓝后加入4%多聚甲醛,37℃下固定10 min,PBS洗净后,采用倒置荧光显微镜观察。
1.6.2 细胞摄取定量检测利用流式细胞仪(美国Becton Dickinson公司,FACS Calibur)对人纤维肉瘤HT1080细胞对药物体系的摄取情况进行定量考察。具体做法如下:将细胞以2×105的孔密度接种到6孔板中,在细胞培养箱中培养24 h。将FITC标记的Gelonin、Gelonin-LMWP-PEG5000分别以5 μmol/L的终浓度加入孔中,37℃培养4 h后消化并收集细胞,离心后用PBS重悬,重复3次,洗去细胞表面的荧光物质和残余培养基、胰酶等。最后用1 mL PBS重悬,采用流式细胞仪检测细胞内荧光强度。
1.7 动物成像用1%戊巴比妥钠按照8.5 g/kg的剂量进行腹腔注射麻醉小鼠。待小鼠不再自主活动后立即用小动物活体成像仪(PekingElmer)进行成像。分别向各组中的3只小鼠尾静脉注射CY5标记后的Gelonin、Gelonin-LMWP-PEG5000,于10 min、1 h、3 h、6h、12 h、24 h等特定时间点拍摄其组织分布情况。
2 结果
2.1 蛋白纯化采用FPLC蛋白纯化系统可以得到纯度较高的Gelonin修饰产物。根据修饰前后蛋白体系分子量的变化,利用Superdex75分子筛预装柱纯化修饰产物,分别在约40 min、46 min时得到两个较高的吸收峰。SDS聚丙烯酰胺凝胶结果显示,出现的第1个峰为分子量较大的PEG5000修饰产物,条带位置在44 kDa(PEG修饰后的蛋白在凝胶中会出现拖尾和位移,所处的条带位置并非分子量直接叠加);峰2主要为未经PEG5000修饰的蛋白(图1)。

图1 蛋白药物的纯化及鉴定Fig 1Purification and identification of toxin
2.2 细胞毒性采用MTT法检测了修饰后的蛋白药物体系对HT1080、U87、MCF-7和HeLa 4种肿瘤细胞的杀伤能力。结果显示,与未修饰Gelonin比较,修饰蛋白的细胞毒作用有所增强,在4种细胞系中的IC50均有所降低;其中,HT1080对蛋白毒素较为敏感,其IC50最低,未修饰蛋白与修饰蛋白的IC50分别为2.69 μmol/L、0.22 μmol/L(图2、3,表1)。
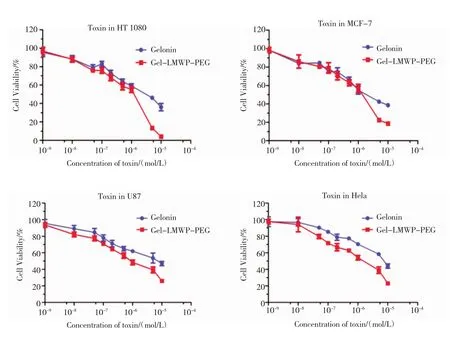
图2 药物在不同细胞系中的MTT毒性测试Fig 2Toxicity of protein drugs in different cell lines

图3 不同细胞系中修饰前后蛋白药物的IC50值比较Fig 3Comparison of IC50value between native and modified toxins in different cell lines
2.3 细胞摄取
2.3.1 定性观察利用倒置荧光显微镜拍摄HT1080细胞对蛋白药物的摄取情况。结果显示,采用LMWP和PEG5000修饰蛋白处理的细胞,其绿色荧光明显强于未修饰蛋白组,说明修饰后的蛋白毒素药物体系进入HT1080细胞的能力增强(图4)。
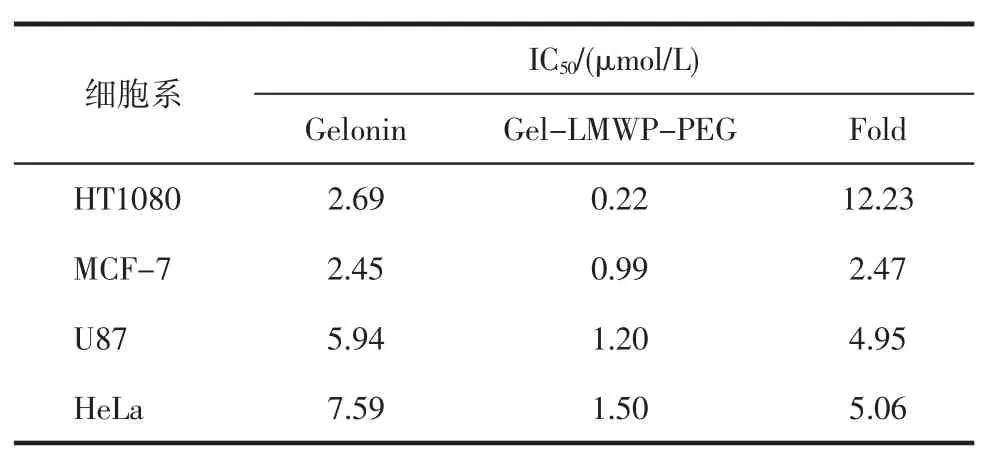
表1 修饰前后的蛋白药物在4种细胞系中的IC50值Tab 1IC50values of the toxins in different cell lines with or without modification
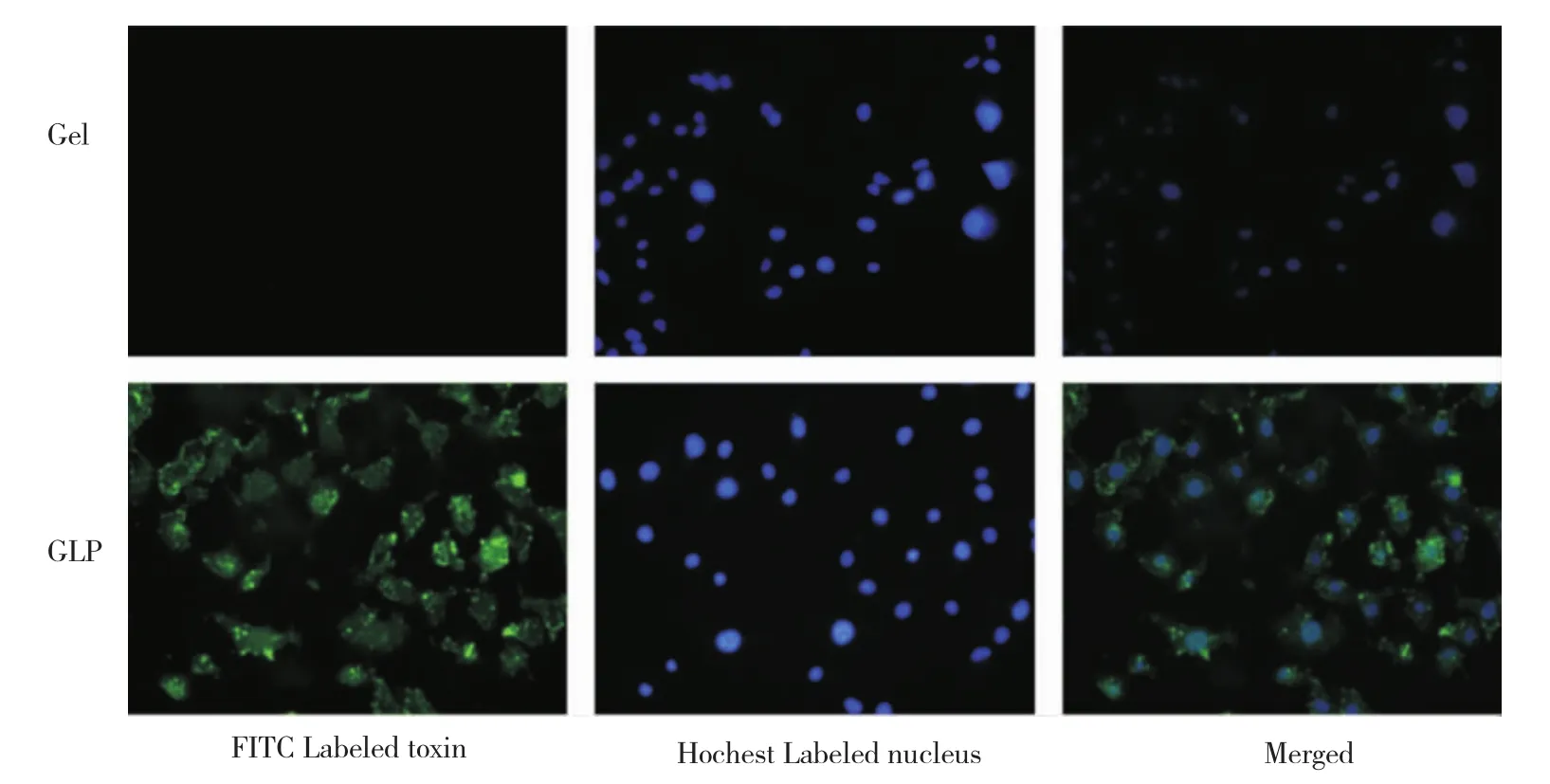
图4 HT1080细胞对蛋白药物的摄取Fig 4Cellular uptake of toxins in HT1080
2.3.2 定量检测利用流式细胞分析技术检测HT1080细胞对核糖体失活蛋白的摄取能力。实验结果表明,经LMWP和PEG5000修饰后的蛋白,平均荧光强度及荧光强度中位数显著高于未修饰组(修饰后蛋白体系的平均荧光强度是未修饰蛋白的58.9倍,荧光中位数为64.2倍),表明了修饰蛋白在HT1080细胞的摄取效率有显著地提高(图5、6)。

图5 流式细胞仪检测HT1080对蛋白药物摄取结果Fig 5FACS results of cellular transduction of toxins in HT1080 cell line

图6 修饰前后的蛋白药物在HT1080中荧光强度对比图Fig 6Comparison of fluorescence intensity between native and modified toxins in HT1080 cell line
2.4 动物体内分布采用小动物成像技术对药物在动物体内的分布进行研究。实验结果表明,未修饰的Gelonin在动物肾脏内荧光强度较高,肾脏蓄积非常明显,且肿瘤内几乎没有荧光;而经LMWP 与PEG5000修饰后的蛋白药物在12 h时肿瘤中出现荧光,24 h时肾脏累积消失,同时有明显的肿瘤聚积。未修饰的药物在动物体内3 h时的总荧光强度最高,而修饰后药物组的最强总荧光强度则出现在12 h。这些结果提示PEG化延长了药物的长循环作用,减少了药物在肾脏的蓄积,提高了蛋白药物在肿瘤的累积(图7)。

图7 蛋白药物在HT1080荷瘤小鼠体内的分布Fig 7In-vivo distribution of toxins in HT1080 tumor-bearing animal model
3 讨论
核糖体失活蛋白Gelonin的作用机制是通过切除位于真核细胞28S亚基核糖体RNA中保守sarcin/ricin环的特殊位点A-4324的腺嘌呤,令核糖体失活,通过终止核糖体的蛋白质生物合成功能而杀死真核细胞[11-12]。其杀伤细胞的效率非常高,因此,可以成为治疗肿瘤的生物大分子药物。
CPPs不仅能携带小分子的化学药物入胞,还可以介导核酸、蛋白、脂质体、高分子聚合物和无机纳米材料等穿越细胞膜而进入细胞[13]。CPPs介导大分子或纳米载体转运入细胞基本不受细胞类型的影响,对包括脑部在内的绝大部分器官或组织的细胞均有效[14]。穿膜肽与蛋白的连接方式主要有化学偶联(即共价连接)、基因重组、静电吸附(即非共价连接)和蛋白载体表面修饰等[15]。所连接的蛋白种类也十分广泛:生长因子、胰岛素、酶类、细胞毒素、抗体等。因此,穿膜肽技术被形象地比喻为“特洛伊木马”[16]。在肿瘤的诊断与治疗方面,Shin等[17-18]通过静电吸附作用将肝素修饰的癌胚抗原单克隆抗体与穿膜肽修饰的蛋白毒素形成具有靶向性的药物复合物;Reilly团队将TAT连接于抗EGF诱导的p21抗体上,用于进行乳腺肿瘤的诊断[19-21];Harada等[22]构建了一种由穿膜肽Tat、氧依赖降解域ODD和凋亡酶原pro-Caspase-3构成的融合蛋白,这种蛋白在缺氧条件下具有稳定性,pro-Caspase-3可被激活成Caspase-3,从而激活细胞凋亡;该体系还应用于肿瘤抑制蛋白P53,所形成的TAT-ODD-P53融合蛋白在体外实验中显示了促进H1299细胞凋亡的作用,在荷瘤小鼠体内也发挥了明显的抑瘤作用[23-24]。
聚乙二醇化(PEGylation)是蛋白的常用修饰方法之一。PEG不仅自身具有免疫惰性,还可以通过遮蔽蛋白表明的抗原决定簇或阻止抗原与抗体的结合而抑制免疫反应的发生,且通过稳定蛋白构象、增加蛋白分子量、遮挡蛋白等作用,使PEG化后蛋白的生物化学性质更趋稳定,同时阻碍蛋白被蛋白酶水解,延长蛋白的体内半衰期,降低其在体内的血浆清除率和免疫原性。
本研究通过蛋白纯化、毒性检测、细胞摄取和小动物成像等实验,对Gelonin-LMWP-PEG5000进行表征和研究。实验结果表明,利用FPLC蛋白纯化系统的分子筛对修饰产物进行纯化后,可以得到纯度相对较高的Gel-LMWP-PEG5000;在对修饰前后蛋白毒素在不同细胞系中的毒性进行探究后发现,人纤维肉瘤HT1080对毒素最为敏感,故后续实验均采用HT1080细胞株进行。在细胞摄取方面,细胞穿膜肽(低分子量鱼精蛋白)可以高效的携带蛋白毒素进入HT1080细胞;由于所修饰的PEG5000为长链状,蛋白与PEG5000的修饰比例为1∶1,LWMP/PEG5000与Gelonin蛋白呈现“Y”字型结构,穿膜肽介导药物体系进入细胞的能力得到了明显地提高。此外,PEG修饰可提高蛋白药物在生理环境中的稳定性,从而也有利于更多的药物进入细胞内。动物成像实验表明,虽然PEG5000修饰后的产物在肾脏仍有一定的积累,但蓄积量明显减少,而分布在肿瘤部位的药量明显增加,从而提高了蛋白毒素在肿瘤部位的生物利用度。
[1]Antignani A,Fitzgerald D.Immunotoxins:the role of the toxin[J]. Toxins(Basel),2013,5(8):1486
[2]Atkinson S F,Bettinger T,Seymour L W,et al.Conjugation of folate via gelonin carbohydrate residues retains ribosomal-inactivating properties of the toxin and permits targeting to folate receptor positive cells[J].J Biol Chem,2001,276(30):27930
[3]Byun Y,Singh V K,Yang V C.Low molecular weight protamine:a potential nontoxic heparin antagonist[J].Thromb Res,1999,94(1): 53
[4]Chang L C,Liang J F,Lee H F,et al.Low molecular weight protamine(LMWP)as nontoxic heparin/low molecular weight heparin antidote(II):in vitro evaluation of efficacy and toxicity[J]. AAPS Pharm Sci,2001,3(3):E18
[5]Chang L C,Lee H F,Yang Z,et al.Low molecular weight protamine (LMWP)as nontoxic heparin/low molecular weight heparin antidote (I):preparation and characterization[J].AAPS Pharm Sci,2001,3(3): E17
[6]Lee L M,Chang L C,Wrobleski S,et al.Low molecular weight protamine as nontoxic heparin/low molecular weight heparin antidote(III):preliminary in vivo evaluation of efficacy and toxicity using a canine model[J].AAPS Pharm Sci,2001,3(3):E19
[7]Tsui B,Singh V K,Liang J F,et al.Reduced reactivity towards antiprotamine antibodies of a low molecular weight protamine analogue [J].Thromb Res,2001,101(5):417
[8]Liang J F,Zhen L,Chang L C,et al.A less toxic heparin antagonist--low molecular weight protamine[J].Biochemistry (Mosc),2003,68(1):116
[9]Abuchowski A,van Es T,Palczuk N C,et al.Alteration of immunological properties of bovine serum albumin by covalent attachment of polyethylene glycol[J].J Biol Chem,1977,252(11): 3578
[10]Abuchowski A,Mccoy J R,Palczuk N C,et al.Effect of covalent attachmentofpolyethyleneglycolonimmunogenicityand circulating Life of bovine liver catalase[J].J Biol Chem,1977,252(11):3582
[11]Stirpe F,Olsnes S,Pihl A.Gelonin,a new inhibitor of protein synthesis,nontoxic to intact cells.Isolation,characterization,and preparation of cytotoxic complexes with concanavalin A[J].J Biol Chem,1980,255(14):6947
[12]Puri M,Kaur I,Perugini M A,et al.Ribosome-inactivating proteins: current status and biomedical applications[J].Drug Discov Today,2012,17(13/14):774
[13]Langel Ü.Cell-Penetrating peptides:methods and protocols[M].[S.l.]: Human press,2011:45-62
[14]Schwarze S R,Ho A,Vocero-Akbani A,et al.In vivo protein transduction:delivery of a biologically active protein into the mouse [J].Science,1999,285(5433):1569
[15]Huang Y,Jiang Y,Wang H,et al.Curb challenges of the"Trojan Horse"approach:smart strategies in achieving effective yet safe cell-penetrating peptide-based drug delivery[J].Adv Drug Deliv Rev,2013,65(10):1299
[16]Dietz G P,Bähr M.Delivery of bioactive molecules into the cell:the Trojan horse approach[J].Mol Cell Neurosci,2004,27(2):85
[17]Shin M C,Zhang J,Min K A,et al.Combination of antibody targeting and PTD-mediated intracellular toxin delivery for colorectal Cancer therapy[J].J Control Release,2014,194:197
[18]Shin M C,Zhao J,Zhang J,et al.Recombinant TAT-gelonin fusion toxin:synthesis and characterization of heparin/protamine-regulated cell transduction[J].J Biomed Mater Res A,2015,103(1):409
[19]Hu M,Chen P,Wang J,et al.Site-specific conjugation of HIV-1 tat peptides to IgG:a potential route to construct radioimmunoconjugates for targeting intracellular and nuclear epitopes in Cancer[J]. Eur J Nucl Med Mol Imaging,2006,33(3):301
[20]Hu M,Wang J,Chen P,et al.HIV-1 tat peptide immunoconjugates differentially sensitize breast cancer cells to selected antiproliferative agents that induce the cyclin-dependent kinase inhibitor p21WAF-1/CIP-1[J].Bioconjug Chem,2006,17(5):1280
[21]Hu M,Chen P,Wang J,et al.123I-labeled HIV-1 tat peptide radioimmunoconjugates are imported into the nucleus of human breast cancer cells and functionally interact in vitro and in vivo with the cyclin-dependent kinase inhibitor,p21(WAF-1/Cip-1)[J].Eur J Nucl Med Mol Imaging,2007,34(3):368
[22]Harada H,Hiraoka M,Kizaka-Kondoh S.Antitumor effect of TAT-oxygen-dependent degradation-caspase-3 fusion protein specifically stabilized and activated in hypoxic tumor cells[J].Cancer Res,2002,62(7):2013
[23]Yu Z,Wu J,Wu S,et al.A recombinant cell-permeable p53 fusion protein is selectively stabilized under hypoxia and inhibits tumor cell growth[J].Cancer Lett,2009,279(1):101
[24]Lee J H,Lu H.Chimeric p53 as an alternative therapy for hypoxic tumors[J].Cancer Biol Ther,2011,11(1):108
(2015-04-17收稿)
Study on cell-penetrating peptide modified and PEGylated ribosome inactive protein Gelonin
ZHANG Ya-jie1,2,WANG Hui-yuan2,CHEN Ying-zhi2,TANG Yi-si2,3,YANG Victor C1,4,HUANG Yong-zhuo2
(1.Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnosis,School of Pharmacy,Tianjin Medical University,Tianjin 300070,China;2.Shanghai Institute of Materia Medica,Chinese Academy of Sciences,Shanghai 201203,China;3.Teopical Medicine Institute,Guangzhou University of Chinese Medicine,Guangzhou 510405,China;4.College of Pharmacy,University of Michigan,Michigan 48109,USA)
Objective:To improve anti-tumor effect of Gelonin,the plant-sourced RIP is modified by chemically conjugating a cellpenetrating peptide and polyethylene glycol(PEG).Methods:Purified protein was obtained after being performed on FPLC(fast protein liquid chromatography)Superdex75 column.Cytotoxicity was detected by MTT assay.The cellular uptake by HT1080 cells was studied by using inverted fluorescence microscopy and flow cytometry.In-vivo imaging technology was utilized for investigation of the in-vivo drug distribution in the HT1080 tumor-bearing mice.Results:The modified product was purified by using gel filtration chromatergraphy. Moreover,compared with native Gelonin,the cytotoxicity of modified protein was increased,especially in HT1080,presumably due to the enhanced cellular uptake.The in-vivo imaging results suggested that drug accumulation in tumor was improved by PEGylation. Conclusion:Modified Gelonin can improve cellpenetration and cytotoxicity in tumor cells.PEGylation can increase tumor accumulation of the protein drug,and thereby enhance its anti-tumor effect.
ribosome inactivating protein;polyethylene glycol;low molecular weight protamine;anti-tumor;Gelonin
R9
A
1006-8147(2015)05-0369-06
国家自然科学基金资助项目(81172996,81373357,8136 1140344,81422048)
张娅洁(1988-),女,硕士在读,研究方向:药剂学;通信作者:杨志民,E-mail:vcyang@med.umich.edu;黄永焯,E-mail:yzhuang@ simm.ac.cn。
