体外表达GLP-1多拷贝的最优条件研究
2015-11-18林松峰张瑞王丹丹郭刚
林松峰,张瑞,王丹丹,郭刚
(1.天津医科大学代谢病医院内分泌研究所,天津 300070;2.协和干细胞基因工程有限公司,天津 300384;3.天津长和生物技术有限公司,天津 301925)
体外表达GLP-1多拷贝的最优条件研究
林松峰1,3,张瑞1,王丹丹2,郭刚1
(1.天津医科大学代谢病医院内分泌研究所,天津 300070;2.协和干细胞基因工程有限公司,天津 300384;3.天津长和生物技术有限公司,天津 301925)
目的:探讨胰高血糖素样肽-1(GLP-1)的序列拷贝数及拷贝温度、时间与其体外表达水平的关系。方法:首先将以4拷贝数为单位的GLP-1序列插入到pET-22b(+)中构建GLP-1多拷贝表达载体,然后将表达载体转化至大肠杆菌BL21(DE3)中进行蛋白体外培养表达。取不同温度和诱导时间段进行蛋白表达,检测GLP-1在不同条件下的蛋白表达量,优化蛋白最适表达条件。结果:GLP-1多拷贝在BL21菌株中的最佳表达温度为26℃,最适诱导时间为8 h。拷贝数与GLP多拷贝表达量呈负相关性,拷贝数越多,蛋白产量越低。结论:GLP多拷贝最佳体外表达条件为4拷贝,26℃培养IPTG诱导8 h。
GLP-1;多聚体;基因表达
胰高血糖素样肽(glucagon-likepeptide-1,GLP-1)是一种由哺乳动物肠道L细胞分泌的一种由31个氨基酸所组成的多肽类激素,可以促进高血糖状态下胰岛素的分泌[1-2]。促进胰岛分泌的研究要追溯到100年前,Moore等[3]用来自十二指肠的一种分泌物治疗糖尿病。人们发现小肠L细胞能够分泌很多促进胰腺分泌的因子,无论是口服还是注射葡萄糖都能诱导胰岛素的分泌,故而分泌物又称为肠促胰岛素[4]。GLP-1是近来研究最多的一种新型促胰岛素合成的因子,GLP-1与细胞表面受体结合后可以激活胰岛素信号通路中的一系列基因转录。从而促进cAMP水平升高,增加胰岛素合成[5-8]。GLP-1属于胰高血糖素原基因的翻译后组织特异性蛋白水解产物,进食可引起肠L细胞释放GLP-1,产生葡萄糖浓度依赖性促胰岛素分泌效应。近来研究发现:GLP-1对机体多种组织和器官,尤其是胰岛具有诸多功能调节效应[9-10]。但GLP-1体内半衰期不足2 min,活性肽可被二肽基肽酶迅速降解,从而限制了其生物活性的发挥。所以优化GLP-1结构就变得无比重要。利用串联的方法合成多拷贝活性肽可以有效防止蛋白被肽酶降解,本实验通过串联不同拷贝数的GLP-1构建到能在大肠杆菌中诱导表达的原核表达载体pET-22b(+)中,希望能够得到能防止或抵抗二肽基肽酶降解的串联GLP-1肽,同时对培养温度和诱导时间进行优化,提高多拷贝肽的表达量。
1 材料与方法
1.1 材料大肠杆菌BL21(DE3),质粒载体:pET-22b(+)均购自Novagen(美国)公司;将GLP-n-拷贝数序列插入克隆质粒pMD,自行构建pMD-GLP-n;IPTG购自Sigma(美国)公司;限制性内切酶以及修饰酶购自TAKARA生物技术公司。
1.2 方法
1.2.1 克隆载体的构建
(1)引物设计:GLP-1 cDNA序列,由NCBI中Genbank数据库检索获得。序列号:FW565320.1。序列为:
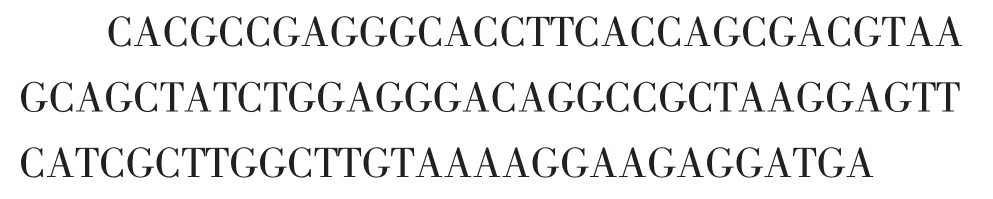
扩增引物由生物学软件Primer premier 6.0设计,5′和3′引物两端分别引入SalI和XhoI酶切位点。为避免GLP-1α-螺旋间的空间位阻影响,本实验在GLP-1中7-36AA结构域间引入了4个甘氨酸。

其中单线部分为SalI和XhoI酶切位点,双线部分为甘氨酸序列,斜体部分为引物,加粗部位为酶切位点。SalI和XhoI为同尾酶,所以分别经SalI 和XhoI酶切后DNA片段粘性末端可相互连接,连接后序列则无法重新被SalI或XhoI酶识别切割。经PCR和相应酶切连接分别获得2、4、8、16多拷贝GLP-1编码序列。
(2)EcoRI或SmaI酶切位点引入:EcoRI或SmaI酶切位点的引入方法同上。该酶切位点的引入是为了将目的片段插入到克隆载体pMD-18T中。
正向引物:5′GAA TTC CAC GCC GAG GG 3′反向引物:5′CCC GGG TCA TCC TCT TCC 3′1.2.2表达载体的构建蛋白表达载体示意图见图1。提取pMD-18T-(GLP-1)n质粒,用Bam HI和Hinc II酶切得到多拷贝GLP-1串联序列。然后用Sal I将表达载体pET-22b(+)线性化,pfuDNA聚合酶将各自的粘性末端补平,再以Bam HI对上述得到平末端片段进行酶切,利用T4连接酶连接到pET-22b(+)的开放阅读框内。连接产物通过转化实验得到阳性转化子,送生工测序,验证质粒构建是否成功。采用CaCl2转化法制备感受态细胞。50 mL对数生长期BL21(OD600=0.6)5 000 r/min离心5 min,预冷ddH2O重悬2次,去除上清。10mL0.1mol/L CaCl2重悬菌体,离心去上清。取2 mL 0.1 mol/L CaCl2悬浮沉淀,冰上分装感受态细胞。500 ng连接产物与150 μ L新鲜制备的感受态细胞混合后,热击法转化,用pET-22b(+)质粒作为阴性对照。
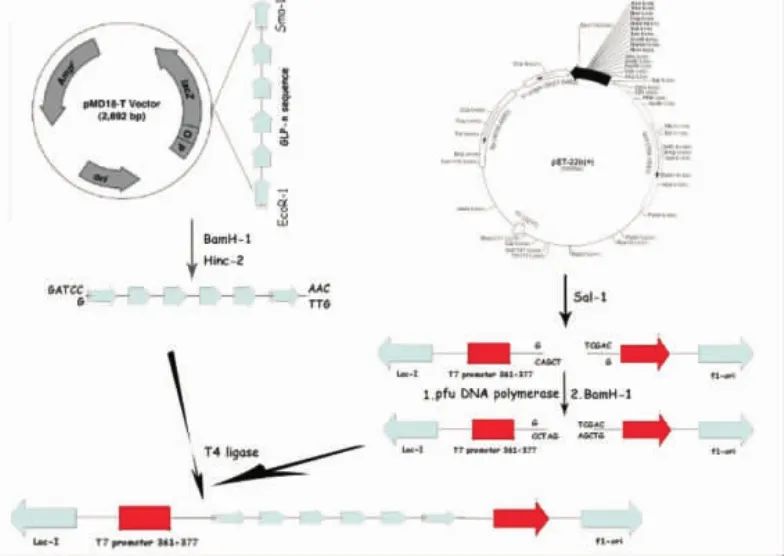
图1 表达载体pET-22b-(GLP-1)n的构建示意图Fig 1The construction scheme of expression vector pET-22b-(GLP-1)n
1.2.3 多拷贝GLP-1的诱导表达优化从1.2.2测序正确的阳性转化子中划线挑取单克隆,接种于10 mL含100 μg/mL氨苄霉素的LB液体培养基中,230 r/min 37℃培养至菌液OD600达到0.6。将对数生长期的菌液按1:20接种到新鲜LB培养基中,230 r/min分别孵育培养于26℃和37℃直至菌液OD600达到0.6。加入IPTG诱导表达目的蛋白,IPTG诱导浓度为0.4 mmol/L。从加入诱导物开始计时,每隔2 h取样直至12 h。菌液立即在4℃,12 000 r/min条件下离心10 min,-80℃保存上清蛋白溶液和菌体。
1.2.4 细胞内蛋白的提取和浓缩用1×PBS(pH 7.2)洗涤菌体离心后重悬,-80℃反复冻融2~3次后超声破碎。超声破碎条件设定为:150 W,30 s/次,冰浴间隔60 s,600次。裂解液4℃,5 000 r/min离心20 min,收集上清(含可溶性蛋白)和沉淀(包涵体及细胞碎片)。将获得的蛋白上清液再次离心,4℃,12 000 r/min,10 min,再次收集上清(可溶性蛋白)和沉淀(包涵体)以备表达蛋白的检测。取不同诱导条件的样品上清液,4℃,12 000 r/min再次离心10 min去杂。上清液采用甲醇和氯仿抽提法浓缩蛋白。
1.2.5 多拷贝GLP-1的表达检测SDS-PAGE电泳检测1.2.4中得到的上清液和沉淀,鉴定目的蛋白的表达情况。分别取样,上清液加入等体积的2×上样缓冲液(2%SDS,5%巯基乙醇,10%甘油,2%溴酚蓝,0.01 mTris-HCl(pH8.0)),沉淀直接加入1×上样缓冲液溶解。两种样品100℃沸水浴5 min使蛋白充分变性,取出待上样液恢复至常温后上样电泳。每孔上样10 μL,1%SDS的Tris-HCl电泳缓冲液(pH 8.3),横流10 mA在浓缩胶中电泳,后改为30 mA分离胶中电泳,直至指示剂电泳至距凝胶底部1 cm处左右停止电泳。
凝胶采用考马斯亮蓝法染色。固定液(50%甲醇、10%冰乙酸)固定1 h。蒸馏水洗2次,每次1 min,然后加入染色液(0.125 g考马斯亮蓝加20 mL固定液)染色1 h以上。蒸馏水洗3次,每次3 min,加入脱色液(10%冰乙酸和20%甲醇)脱色,直至条带清晰。
2 结果
2.1 pET-22b(+)-(GLP-1)n表达载体的构建将载体与GLP-1不同拷贝数的目的片段连接后转入大肠杆菌BL21中,载体在酶切和连接后开放阅读框保持不变(图2)。转化子通过Amp抗性的LB固体平板筛选,得到了抗Amp抗性的转化子。挑取单个菌落阳性转化子37℃过夜培养,质粒小提试剂盒提取质粒。BamHI和HindIII双酶切验证,确认多拷贝GLP-1编码序列正确插入。质粒酶切结果见图3。从结果可以看出:质粒经BamHI和HindIII双酶切后,每条泳道都出现2条条带。大片段都是4 500 bp左右,为pET-22b载体。小片段大小分别在2 000 bp,1 350 bp,900 bp和450 bp左右,这与GLP-1肽编码序列16拷贝、12拷贝、8拷贝和4拷贝片段大小预测值相一致。
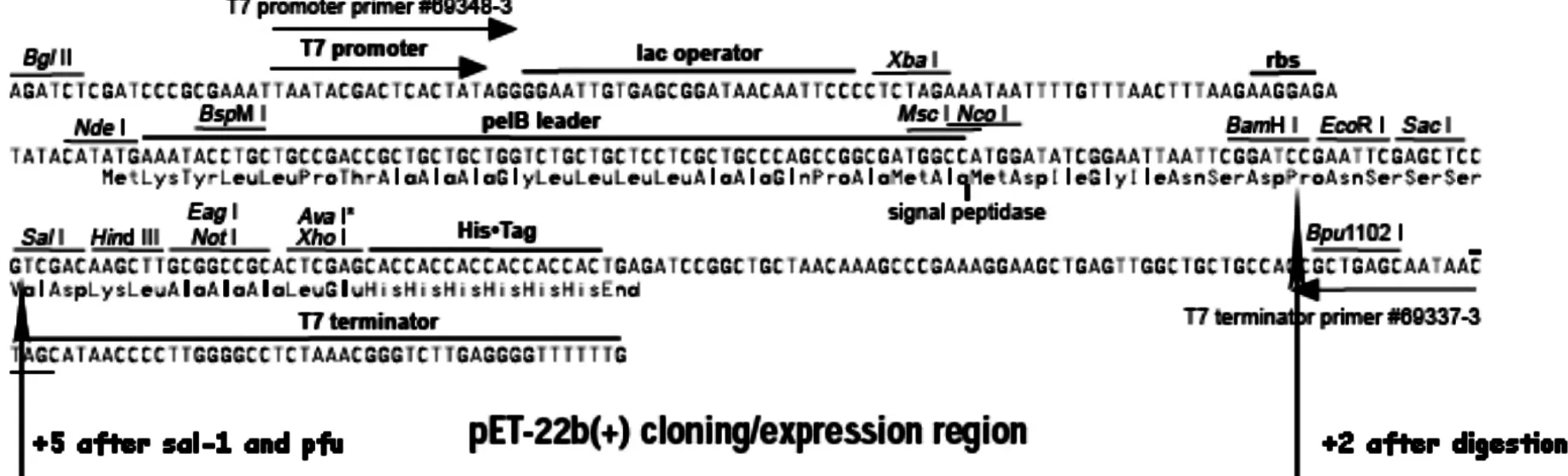
图2 目的片段插入方式示意图Fig 2The scheme of inserting style of interest ORF
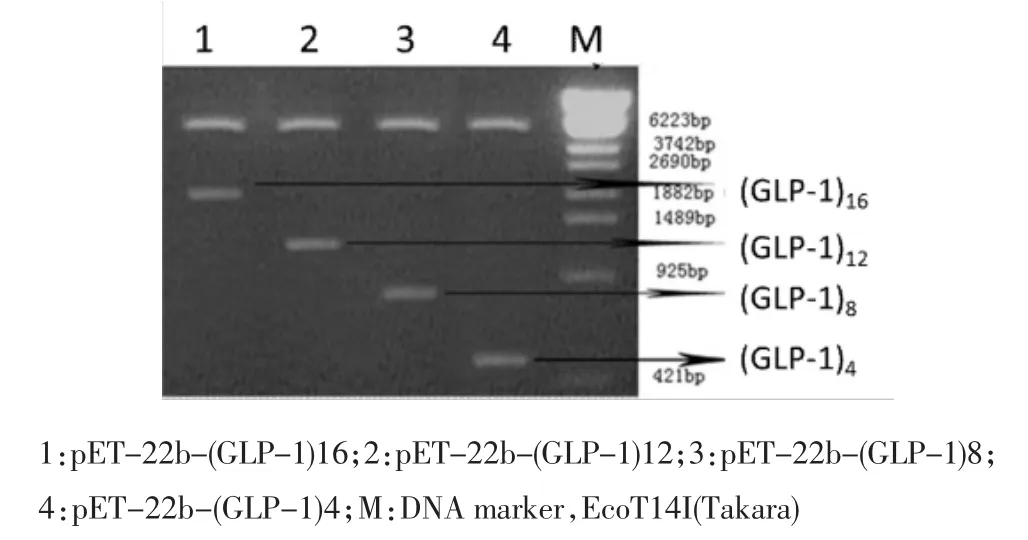
图3 表达载体BamH I&Hind III双酶切鉴定Fig 3Electrophoresis analysis of plasmid pET-22b-(GLP-1)n expression on BamH I&Hind III digestion
2.2 温度对GLP-1多拷贝蛋白表达的条件优化本实验首先在37℃和26℃对GLP-1多拷贝(16拷贝、12拷贝、8拷贝和4拷贝)原核表达菌株BL21进行蛋白诱导表达。电泳结果发现16拷贝和12拷贝GLP-1表达菌株未分泌表达出目的蛋白,考马斯亮蓝染色在预测大小处未发现目的大小蛋白条带。所以后续实验主要围绕(GLP-1)4和(GLP-1)8表达菌株蛋白表达量与培养温度之间的关系进行研究。37℃和26℃条件下IPTG诱导8 h菌液、上清液、细胞裂解液和包涵体沉淀分别上样并进行SDS-PAGE电泳。结果如图4所示两种温度(GLP-1)4和(GLP-1)8培养液电泳后,26℃条件下3种样品的目的蛋白量均高于37℃条件菌体蛋白的表达水平。所以今后的表达实验选择培养温度为26℃。图中箭头指示的是目的蛋白,(GLP-1)4蛋白条带出现在16 KDa,这与预测蛋白分子量大小一致。同样(GLP-1)8蛋白大小应为32 KDa,SDS-PAGE电泳结果与蛋白分子量预测值一致。26℃条件下对上清液、细胞裂解液以及包涵体各部分蛋白含量对比得知细胞裂解液中含量最多,所以我们的实验结果也验证了pET-22b系列表达载体对GLP-1多拷贝的表达多集中在大肠杆菌BL21的细胞周质中,并且蛋白以可溶形式存在。
2.3 诱导时间对GLP-1多拷贝蛋白表达的条件优化为确定IPTG诱导时间对蛋白表达量的影响,我们随后进行了不同诱导时间的条件优化实验。本实验同时选取表达(GLP-1)4和(GLP-1)8菌株各一株26℃条件下培养,诱导前的条件与2.2完全一致。待菌液培养至OD600=0.6加入终浓度为0.4 mmol/L 的IPTG诱导表达,每2 h取一次样。由于表达蛋白主要集中在细胞裂解液中,所以本实验直接处理细胞裂解液进行SDS-PAGE电泳检测。检测结果如图5所示,无论(GLP-1)4菌株还是(GLP-1)8菌株,随着诱导时间的增加目的蛋白的表达量逐渐升高。8 h时达到最大值,随后继续增加诱导时间,目的蛋白的表达量开始减少。为更加准确、直观表示出蛋白表达量与IPTG诱导时间的关系,我们通过灰度分析量化了两种目的蛋白的表达量,P<0.05,分析结果有统计学意义。综合上述,GLP-1多拷贝蛋白表达IPTG诱导最佳时间为8 h。

图4 培养温度对目的蛋白(GLP-1)4和(GLP-1)8表达量的影响Fig 4 The effect on target protein expression at different temperatures

图5 诱导时间对蛋白表达的影响Fig 5The effect target protein induction different times
3 讨论
GLP-1可以刺激胰岛素的分泌,抑制胰高血糖素,减缓胃排空,增强饱腹感,在治疗糖尿病方面有着巨大的潜力。但遗憾的是GLP-1活性肽在体内的生物半衰期很短,导致其在体内生理活性难以持久发挥,因此延长GLP-1在机体内有效的作用时间是开发该类药物的关键。先前的研究发现促使GLP-1快速降解的原因主要是体内二肽基肽酶能快速识别并降解单体GLP-1。目前最常用的防止GLP-1体内快速降解的方法是开发GLP-1长效类似物[11-12](如利那鲁肽、依克那肽)和DPP-Ⅳ抑制剂[13-14]。有证据表明多拷贝串联的方式可以增加蛋白的稳定性[15],如:单体蔗糖水解酶的多拷贝基因可在酿酒酵母中成功表达。而此篇研究则提供了一种以串联体蛋白高效表达小片段基因的操作方法,该方法很可能在GLP-1类似蛋白的工业生产方面有相当的可利用价值,并对此后抗糖尿病药物的研究做出贡献。那么用这种多拷贝串联的方法制备GLP-1类似物可能在抵抗体内二肽基肽酶的切割起到意想不到的效果,至少可以在延缓体内GLP-1降解时起到作用。事实上已有相关实验报道证明,GLP八聚体经胰蛋白酶消化后得到的GLP-1类似蛋白单体相比于天然GLP-1二者结构非常相似,在二级结构中,两者都具有从Ser8-Trp25的α螺旋结构,依然可以识别其受体。若多拷贝GLP-1用于工业生产,该表达方式将大大提升GLP-1蛋白的产率。同样浓度的GLP-1和(GLP-1)n比较,(GLP-1)n能够为GLP-1受体周围提供更高的局部浓度。因此,更低剂量的(GLP-1)n显然更为经济和高效。截至发稿时,我们已经成功构建出新一代的GLP-1八倍串联体的表达载体。新的表达载体将天然GLP-1(7-36AA)中的3个氨基酸残基进行了替换,分别为Ala8->Ser8/ Lys26->Gln26/Lys34->Aps34,并在串联体单体之间加入了‘PIR’氨基酸序列进行连接。经过氨基酸残基替换的GLP-1八倍串联体加入了胰蛋白酶识别位点,Lys26和Lys34位点的替换确保胰蛋白酶消化环节中GLP-1类似蛋白结构不受破坏。这种创新性的表达方式可能为GLP-1抵抗DPP-IV的水解以及生理功能的发挥提供一条新的途径。
本文通过对(GLP-1)4、8、12、16多拷贝蛋白进行表达,试图得到不同串联拷贝的多聚蛋白,为解决GLP-1易降解问题提供新的方法。尽管我们构建了4种多拷贝蛋白,但只有(GLP-1)4和(GLP-1)8拷贝在BL21中得到表达。那么为什么(GLP-1)12和(GLP-1)16没有得到表达?就大肠杆菌BL21而言,作为广泛应用的模式工程异源表达菌株,很多蛋白被成功表达。但一些限制因素,比如基因序列结构,mRNA的稳定性和转录的效率,肽或蛋白质折叠方式,密码子偏爱性等都可能导致异源蛋白表达失败[18]。推测可能原因之一为GLP-1多拷贝数目超过一定阈值,随着GLP拷贝数的上升,新转录的mRNA的长度变长,二级结构复杂化,从而破坏了mRNA原有的稳定性,最终导致蛋白无法表达或表达受到抑制。另一种可能是GLP-1多拷贝数目大于等于12后尽管少量蛋白被表达,但是多拷贝蛋白结构不稳定,被多个蛋白降解酶识别导致蛋白瞬时降解,检测时出现目的条带丢失现象。
聚丙烯酰胺电泳实验结果发现:大肠杆菌BL21培养液、细胞周质和不溶沉淀物中都含有目的蛋白。蛋白质在细胞质合成后,那些定位于细胞周质区或外膜区的蛋白可以通过信号肽被转运到各自目的地。裂解液得到的目的蛋白一种可溶,另一种不可溶。可溶性的蛋白天然构象不会被破坏,而不可溶性的蛋白由于构象改变离心会形成沉淀,形成包涵体(0.5~1 μm)[16]。包涵体只有在变性剂存在的条件下(如尿素、SDS)才会溶解,并且回收困难,回收效率也不高。为了避免形成包涵体,目的蛋白通常被设计表达为分泌蛋白和可溶性蛋白。在异源表达蛋白分泌过程中,目的蛋白会分泌到细胞周质区域,在那里很容易形成二硫键,或者分泌到容易被分离和纯化的培养基中[17]。本实验中GLP-1多拷贝蛋白集中在细胞周质区,可溶于水,说明其自然构象未改变。另外,沉淀中也检测到少量目的蛋白包涵体,推测形成这些包涵体的原因是IPTG诱导时GLP-1多拷贝蛋白表达效率过高造成部分目的蛋白未能及时正确折叠,从而使蛋白构象发生改变导致蛋白发生沉降形成包涵体。
[1]Ahrén B.GLP-1 for type 2 diabetes[J].Exp Cell Res,2011,317(9): 1239
[2]Donnelly D.The structure and function of the glucagon-like peptide-1 receptor and its ligands[J].Br J Pharmacol,2012,166(1):27
[3]王育璠,彭永德.胰高血糖素样肽-1--2型糖尿病治疗的新策略[J].世界临床药物,2004,25(12):718
[4]尹艳华.肠促胰岛素治疗糖尿病的研究进展[J].医学综述,2015,21(1):99
[5]Purves G I,Kamishima T,Davies L M,et al.Exchange protein activated by cAMP(Epac)mediates cAMP-dependent but protein kinase A-insensitive modulation of vascular ATP-sensitive Potassium channels[J].J Physiol,2009,587(Pt 14):3639
[6]Furman B,Ong W K,Pyne N J.Cyclic AMP signaling in pancreatic islets[J].Adv Exp Med Biol,2010,654:281
[7]Quoyer J,Longuet C,Broca C,et al.GLP-1 mediates antiapoptotic effect by phosphorylating Bad through a beta-arrestin 1-mediated ERK1/2 activation in pancreatic beta-cells[J].J Biol Chem,2010,285(3):1989
[8]Meier J J,Kemmeries G,Holst J J,et al.Erythromycin antagonizes the deceleration of gastric emptying by glucagon-like peptide 1 and unmasks its insulinotropic effect in healthy subjects[J].Diabetes,2005,54(7):2212
[9]姚迪,张红.GLP-1受体激动剂与糖尿病肾病[J].重庆医学,2015,44(7):981
[10]Fan Y,Dong L,Ma W Z,et al.GLP-1 biology and GLP-1 based antidiabetic therapy[J].J Chin Pharm Sci,2013,7(21):7
[11]宋智慧,王璐,纪立伟.等[J].中国新药杂志,2013,22(5):542
[12]韩蕊,石志平,王涛,等.胰高糖素样多肽-1及受其体激动剂对2型糖尿病心血管病变的影响[J].中国临床医生,2015,43(3):23
[13]蒋筠,彭永德.人GLP-1类似物治疗2型糖尿病的研究进展[J].世界临床药物,2010,31(2):74
[14]李清,李慧,周金培,等.二肽基肽酶Ⅳ抑制剂的研究进展[J].中国药物化学杂志,2012,22(5):382
[15]Ahrén B,Holst J J,Mårtensson H,et al.Improved glucose tolerance and insulin secretion by inhibition of dipeptidyl peptidase IV in mice[J].Eur J Pharmacol,2000,404(1/2):239
[16]Wang Y,Liang Z H,Zhang Y S,et al.Human insulin from a precursor overexpressed in the methylotrophic yeast Pichia pastoris and a simple procedure for purifying the expression product[J]. Biotechnol Bioeng,2001,73(1):74
[17]Villatte F,Hussein A S,Bachmann T T,et al.Expression level of heterologous proteins in Pichia pastoris is influenced by flask design [J].Appl Microbiol Biotechnol,2001,55(4):463
[18]江伟华,刘益丽,江明锋.大肠杆菌外源蛋白表达载体稳定性的研究进展[J].生物技术通报,2014,5(1):25
(2015-02-01收稿)
Optimization for the expression of multi-copy peptides GLP-1 in vitro
LIN Song-feng1,3,ZHANG Rui1,WANG Dan-dan2,GUO Gang1
(1.Institute of Endocrinology,Metabolic Diseases Hospital,Tianjin Medical University,Tianjin 300070,China;2.Xie He Stem Cell Gene Engineering Company,Tianjin 300384,China;3.Ever Union Biotechnology Company Limited,Tianjin 301925,China)
Objective:To investigate the relationship between production and copy number coding sequence of the glucagon-like peptide -1(GLP-1).Methods:Firstly,four repeated sequences for multi-copy GLP-1 peptides were linked as a motif and inserted into the vector pET-22b(+).The completed plasmid including different numbers of GLP-1 copy was subsequently transformed into E.coli BL21 cells,which can be induced to express the interesting peptides by the reagent IPTG(Isopropyl-beta-D-thiogalactopyranoside).The expression of multi-copy GLP-1 was employed to optimize the fermentation.The conditions such as temperature and inducing time for highest protein yield were analyzed.Finally,the effects of different GLP-1 motif were confirmed to improve the production.Results:Multi-copy GLP-1 was expressed and secreted by E.coli in different conditions,the result demonstrated that a climax yield for protein was obtained at 26℃and 8 hours.Moreover,the production was negatively correlated with copy number of GLP-1.With the multi-copy,the production of peptides marked a significant decline.Conclusion:The final optimized condition to express multi-copy GLP-1 peptides is E.coli BL21 containing 4 copy motif vector cultured at 26℃with inducing time of 8 hours.
optimization;GLP-1;expression
Q7
A
1006-8147(2015)05-0388-05
林松峰(1983-),男,技术员,硕士在读,研究方向:生物化学与分子生物学;通信作者:郭刚,E-mail:guogangtj@126.com。
