血红素氧化酶1在ADSCs增殖、凋亡和成骨分化的作用
2015-11-18陈晓鹏胡永成方成张丽娟张荣信黄文敬
陈晓鹏,胡永成,方成,张丽娟,张荣信,黄文敬
(1.天津医科大学研究生院,天津 300070;2.天津市天津医院骨与软组织肿瘤科,天津 300211)
血红素氧化酶1在ADSCs增殖、凋亡和成骨分化的作用
陈晓鹏1,胡永成2,方成1,张丽娟1,张荣信1,黄文敬1
(1.天津医科大学研究生院,天津 300070;2.天津市天津医院骨与软组织肿瘤科,天津 300211)
目的:探讨应用慢病毒介导血红素氧化酶1(HO-1)基因转染诱导脂肪来源基质干细胞(ADSCs)后对细胞增殖、凋亡和成骨分化的影响。方法:取健康10周龄SD大鼠双侧腹股沟脂肪,分离、培养ADSCs,观察第3代细胞形态并进行成骨和成脂分化研究,流式分析细胞表面标记物,确立分离细胞为ADSCs。利用基因重组技术构建HO-1基因重组慢病毒载体,并以Polybrene(8 μg/mL)介导慢病毒转染ADSCs,倒置显微镜下观察转染细胞荧光表达优化转染复数,Western blot检测HO-1蛋白表达。设HO-1转染组(A组)、空载体转染组(B组)和未转染组(C组);MTT,流式分析和茜素红钙结节染色分别检测各组增殖、凋亡和成骨分化情况。结果:分离获得的ADSCs具有多向分化潜能:CD29(+)、CD44(+)、CD90(+)、CD31(-)、CD45(-);经菌液PCR和Western blot鉴定HO-1基因重组慢病毒载体构建成功,与B、C组相比,A组具有较高的细胞活性(P<0.05),无血清培养基中较低的凋亡率(P<0.05),并增加细胞钙化基质形成的量(P<0.05)。结论:成功构建HO-1基因重组慢病毒表达载体并转染大鼠ADSCs,HO-1基因转染入ADSCs后表达HO-1蛋白成功,HO-1转染后可以发挥对ADSCs促增殖、抗凋亡和促成骨分化的作用。
脂肪基质干细胞;血红素氧化酶1;慢病毒载体;成骨分化
骨组织工程为骨缺损修复提供了一种有效的方法,其中脂肪基质干细胞(adipose-derived stromal cells,ADSCs)因取材方便、易获得,具有多种定向分化潜能的特点成为骨组织工程良好的种子细胞[1]。近年来国内外学者对ADSCs成骨分化及其促进骨缺损修复等功能进行了大量研究。但单纯的ADSCs植入体内后细胞大量凋亡,且ADSCs较骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)有脂肪分化的潜能[2]。血红素氧化酶-1(heme oxygenase-1,HO-1)是血红素代谢的限速酶,因其可以通过一种或几种代谢产物发挥抗凋亡、抗炎等作用而受到重视[3]。将HO-1基因修饰ADSCs有望克服以上不足,更好地发挥血管新生和成骨分化的促进作用。因此,我们构建了携带HO-1基因的慢病毒,将其感染ADSCs,长期传代,获得持续稳定表达,并对其生物学特性进行观察。
1 材料与方法
1.1 实验动物及主要试剂、仪器10周龄清洁雄性SD大鼠8只,体质量200~300 g,购自中国人民解放军军事科学研究院。
FBS(HyClone公司,美国);L-DMEM培养基(GIBCO公司,美国);双抗(青霉素-链霉素,GIBCO公司,美国);聚凝胺(polybrene),I型胶原酶,抗坏血酸,地塞米松,β-甘油磷酸钠,甲基黄嘌呤(IBMX),吲哚美辛(Sigma公司,美国);磷酸盐缓冲液(PBS),茜素红(生工,中国)。慢病毒载体pZsGGFP、包装质粒packA、packB、packC,293T细胞由天津医科大学免疫炎症实验室张荣信教授惠赠;质粒pUC57-HO-1由金唯智(苏州,中国)合成,Plasmid抽提试剂盒(Qiagen公司,德国),大鼠HO-1抗体(Santa Cruz生物公司,美国),CD29-PE,CD31-APC,CD44-PE,CD45-FITC,CD90-FITC(BD eBioscience,美国)。Plus-20离心超滤装置(Millipore公司,美国);倒置荧光显微镜(Olympus公司,日本);Accuri C6流式细胞仪(BD,加拿大)。
1.2 大鼠ADSCs分离、培养及鉴定
1.2.1 大鼠ADSCs分离、培养无菌条件下取脂肪组织置入无菌离心管中,PBS冲洗3遍,剔除血管、筋膜组织后剪碎,0.1%Ⅰ型胶原酶37℃震荡消化1 h,等体积DMEM/体积分数10%的FBS中和,采用密度梯度离心法分离培养大鼠ADSCs,1 000 r/min,离心5 min,0.22 μm筛网过滤,1 000 r/min,离心5 min,弃上清,DMEM培养基重悬细胞,将细胞接种于培养瓶中,用DMEM培养基含10%的FBS和1%双抗培养。48 h后换液,除去未贴壁的细胞。细胞生长至80%~90%融合状态时,0.05%胰蛋白酶-0.02% EDTA消化传代。取生长状态良好的第3~5代细胞用于后续实验。
1.2.2 大鼠ADSCs鉴定倒置显微镜下观察ADSCs形态及其生长变化;在成骨(DMEM,5%FBS,1%双抗,0.1 μmol/L地塞米松+50 μmol/L抗坏血酸+10 mmol/L β-甘油磷酸钠)和成脂(DMEM,5% FBS,1%双抗,10 mg/L胰岛素+1 μmol/L地塞米松、100 μmol/L吲哚美辛、500 μmol/L的甲基黄嘌呤)培养基上诱导21 d培养ADSCs,每3 d换液,观察其多分化潜能;流式细胞仪分析ADSCs表面CD29、 CD44、CD90、CD31、CD45分子的表达。
1.3 HO-1慢病毒表达载体构建及HO-1慢病毒获取
1.3.1 PCR法获得HO-1基因片段从Genebank中提取大鼠HO-1基因(NM_012580)编码区序列,根据慢病毒表达载体pZsG酶切位点要求,由金维智公司将HO-1基因合成在质粒pUC57-HO-1中。将pUC57-HO-1和pZsG分别进行NotⅠ和BamHⅠ双酶切,1%琼脂糖凝胶电泳检测,目的条带以胶回收试剂盒回收。
1.3.2 HO-1基因片段与慢病毒载体pZsG重组
切胶回收产物定向连接经大肠杆菌转化,对长出的克隆进行PCR鉴定,共挑选5个克隆。引物序列:上游引物5′-ATGGAGCGCCCACAGCTCG-3′,下游引物5′-ACTGCCACGGTCGCCAACAG-3′,其中PCR鉴定为阳性的克隆,证明HO-1已经定向连入pZsG,命名为pZsG-HO-1。
1.3.3 慢病毒载体大量抽提按照Plasmid抽提试剂盒操作手册步骤分别抽提慢病毒载体质粒:pZsG-GFP、pZsG-HO-1、packA、packB和packC。保证所提质粒DNA的吸光度(A260/A200)值为1.8~2.0,-20℃保存。
1.3.4 慢病毒包装取生长状态良好的293T细胞,包装前按细胞密度1×105/mL接种于含完全培养基的10 cm培养皿中,待细胞融合率约70%时,开始包装。包装前1 h更换无血清培养基,将上述表达质粒与包装质粒按1∶3∶1∶1的质量比混合,再添加3倍体积的PEI,混匀后37℃孵育20 min,分别加入满足包装要求的293T细胞中。48 h和72 h后收集病毒上清,-80℃保存备用。
1.4 HO-1重组慢病毒载体转染ADSCs取第3代大鼠ADSCs,待细胞生长达70%~80%融合后弃上清,加入10 mL的慢病毒液和8 μg/mL的聚凝胺(polybrene),置于37℃、5%CO2及饱和湿度孵育箱中孵育,6 h后全量换液,更换完全培养基,转染24、48、72 h后根据空载体表达绿色荧光的特点,采用倒置荧光显微镜观察不同感染复数(multiplicity of infection,MOI)10、15、20、30、50、100下慢病毒的感染效率,选择荧光表达效率最高、细胞生长状态最佳的MOI值作为最佳MOI值进行后续实验。Western blot验证HO-1重组慢病毒载体转染ADSCs后表达情况。
1.5 观测指标
1.5.1 MTT法检测转染后ADSCs生长情况根据处理方法不同分为3组:A组(HO-1基因重组慢病毒载体转染ADSCs)、B组(pZsG-GFP慢病毒载体转染ADSCs)、C组(未转染ADSCs),每组设3个复孔。取生长状态良好不同组的第3代ADSCs,经消化离心重悬细胞后计数,按细胞密度1×103个/孔接种于96孔板中,于37℃、5%CO2及饱和湿度孵育箱中培养,隔天换液1次。分别于转染后1、2、3、4、5、6、7 d进行MTT检测,在酶联免疫仪上490 nm下测定吸光度值(OD)。
随着我国生活水平和医疗水平的提高,老年人的平均寿命不断延长,相对的老年人的可劳动年龄也不断延长。老年人丰富的劳动经验和较于年轻人更敬业的劳动精神是其具有的最核心的竞争力。创造有利于老年人力资源开发的政策环境,充分开发老年人力资源,大力开展老年教育,不断更新老年人的知识,鼓励活到老学到老,使老年人适应新科技的不断创新,从而为其创造参与社会劳动的有利条件。并且在老龄人工作经验和技能指导优势的工作领域上,适当延长老龄人的退休年龄增加劳动力的供给,充分发挥利用老年劳动力资源,弥补我国劳动力数量的减少所带来的劣势。
1.5.2 流式细胞仪分析HO-1高表达对ADSCs抗凋亡的影响实验分组同1.5.1。按细胞密度1×105个/孔接种于6孔板中,当细胞贴壁后更换无血清培养基,培养3 d后收集各组细胞。根据凋亡试剂盒(三箭,天津)要求进行染色,C6流式分析仪分析各组细胞凋亡情况。
1.5.3 转染后ADSCs成骨分化观察实验分组同1.5.1。茜素红染色:将3组细胞按细胞密度5×104个/孔接种于6孔板中,成骨培养基中培养3周后,PBS冲洗3次,每次5 min,无水甲醇固定10 min后,双蒸水冲洗3次,每次5 min,加入pH 7.4的1%茜素红染液,于37℃恒温箱中孵育40 min,双蒸水冲洗3次,倒置相差显微镜下观察钙结节形成情况。
2 结果
2.1 大鼠ADSCs形态学观察及鉴定原代细胞培养48 h后,倒置显微镜下可见细胞呈长梭形贴壁生长;成骨诱导3周后茜素红染色可见多数细胞胞质中有红色颗粒或大片红色沉淀。成脂诱导3周后油红O染色可见细胞内有红色脂滴。流式细胞仪检测示细胞表面标志物CD29(+)、CD44(+)、CD90(+)、CD31(-)、CD45(-)(图1)。
2.2 含HO-1的慢病毒表达载体构建HO-1基因片段经限制性内切酶NotⅠ和BamHⅠ酶切后可获得长度为869 bp的片段产物(图2A)。随机挑选5个单克隆菌落行PCR鉴定,其中2、3、4为阳性,片段大小约为900 bp(图2B)。与Genbank中的参考序列一致,提示成功构建HO-1基因慢病毒载体。
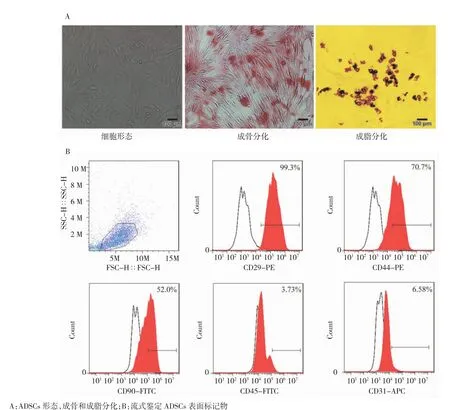
图1 ADSCs形态学、多向分化潜能及表面标记物鉴定Fig 1 Identification of ADSCs from morphology,multi-differentiation and surface marker

图2 慢病毒表达载体pZsG-HO-1的构建Fig2 Construction of lentiviral pZsG-HO-1 plasmid
2.3 重组慢病毒的感染效率及目的基因的表达
慢病毒感染ADSCs 96 h后,荧光倒置显微镜下观察绿色荧光,结果显示:当MOI值为10、15时可见不足50%荧光表达;当MOI值为20时,可见大部分(90%)ADSCs表达绿色荧光。当MOI值为30时并不能有效增加荧光表达,且随着MOI值的增加,细胞生长状态较差,出现漂浮细胞,提示对大鼠ADSCs而言,MOI为20时为慢病毒的最佳感染复数,慢病毒感染ADSCs细胞达到90%以上的感染效率,符合基因治疗对载体的要求(图3)。Western blot结果表明,实验组HO-1蛋白水平显著高于空载体组(P<0.05),差异有统计学意义(图4)。
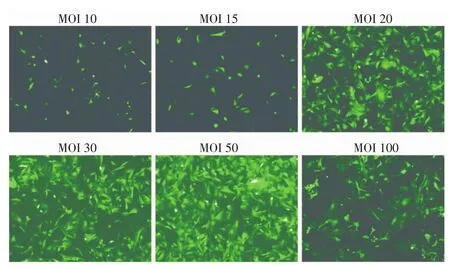
图3 不同梯度慢病毒MOI转染ADSCs后荧光表达Fig 3The fluorescence of ADSCs transfected with the gradient MOI of lentivirus

图4 Western blot检测慢病毒介导HO-1转染ADSCsFig 4HO-1 expression in ADSCs mediated by lentivirus and evidenced by Western blot
2.4 MTT法检测转染后ADSCs活性MTT法显示:转染后2 d开始,A组细胞生长良好,OD值比较有统计学意义(P<0.05);而空载体组和未转染组细胞生长无明显变化,OD比较差异无统计学意义。随着培养时间延长,各组细胞生长呈上升趋势,其中A 组OD值显著优于B组,差异有统计学意义(P<0.05)(图5)。
2.5 流式细胞技术分析转染后ADSCs凋亡流式细胞仪检测结果(表1)表明,A组细胞凋亡率较B组和C组明显减少,差异具有统计学意义(P<0.05);而B组与C组之间比较差异无统计学意义,表明HO-1重组基因高表达可以降低ADSCs在无血清条件下的凋亡率,对细胞发挥保护效应。
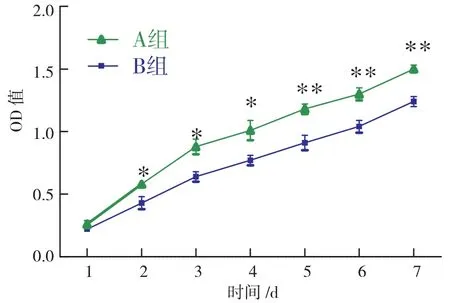
图5 MTT检测不同转染组ADSCs的细胞活性Fig 5ADSCs viability of ADSCs in different transfection groups measured by MTT

表1 不同转染组在无血清培养基下的凋亡率(%)Tab 1 The apoptosis rate of ADSCs in different groups in the medium without serum(%)
2.6 茜素红钙基质染色转染后3周,A组可见较多细胞出现大量片状融合褐色矿化结节(图6);Image J软件分析显示,A组矿化结节形成区域较B组和C组明显增多,差别有统计学意义(P<0.05);而B组及C组比较,差异均无统计学意义(P>0.05)。
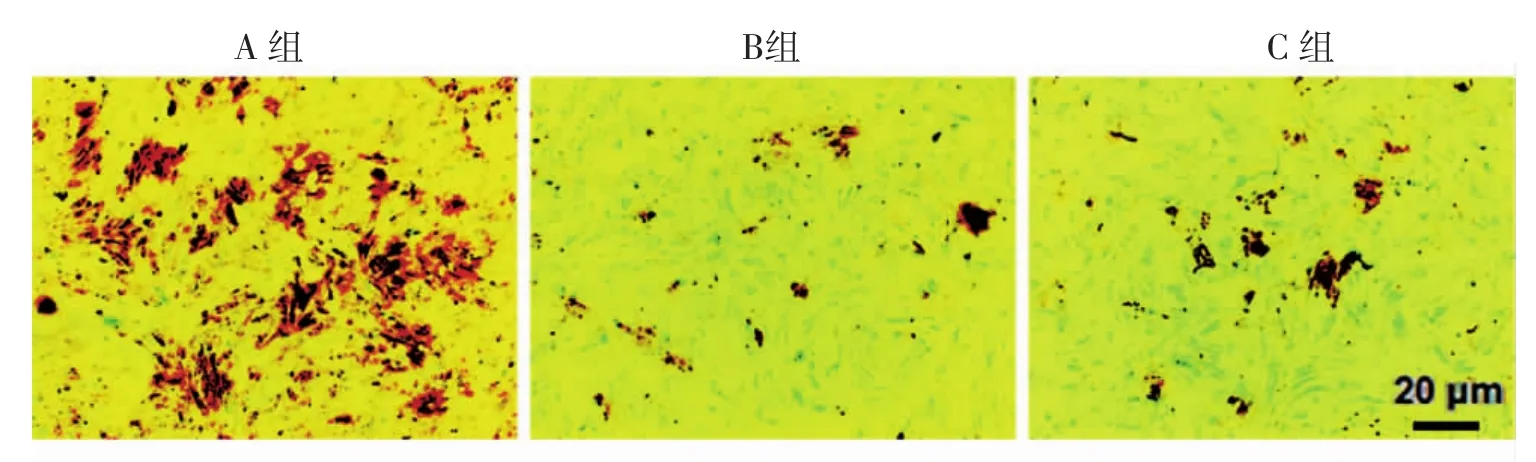
图6 茜素红染色分析不同转染组钙基质形成情况Fig 6Calcium deposition of different groups stained by alizarin red
3 讨论
ADSCs具有多向分化潜能,为组织工程骨构建增加了细胞成分,是目前骨组织工程的研究热点,本研究中成功分离提取了ADSCs[1]。骨缺损局部微环境常面临低氧、氧化应激的损伤,不利于细胞存活,使得植入体内的细胞早期凋亡率增加,1~2周内细胞在支架上逐渐消失,4周后全部消失[4]。ADSCs联合支架植入体内达不到骨修复的效果[5]。同时植入体内的种子细胞缺乏有效的刺激使其达到骨修复的目的。近年来,在心血管领域广泛应用的HO-1通过代谢血红素产生CO、胆绿素、二价铁离子,可以发挥抗炎、抗凋亡等细胞保护作用,将其引入骨组织工程可能利于骨修复[6]。
与蛋白为基础的治疗相比,携带基因成本低、效率高,1996年第一次尝试基因治疗应用于骨组织工程以来,基因治疗在骨组织工程中得到了广泛地研究[7]。为了更好地将目的基因与靶细胞整合,达到基因治疗的目的,基因载体的选择尤为关键。慢病毒载体能够携带目的基因与靶细胞基因组整合,使得目的基因能够长期稳定表达,且具有不易诱导宿主免疫反应等优点[8]。更重要的是,慢病毒载体可转染分裂细胞及非分裂细胞,携带基因片段容量较大[9]。因此,我们研究中选择慢病毒表达载体作为目的基因的携带工具。
本实验将通过NotⅠ和BamHⅠ酶切获得的大鼠HO-1基因片段与经相同酶切的慢病毒表达载体pZsG连接后转化入E.coli DH5α感受态细胞,并通过酶切电泳分析仪和设计特异性引物进行菌液PCR对重组DNA进行鉴定,结果与GenBank中序列大体一致,初步验证构建的重组质粒目的基因片段为大鼠HO-1基因。此外,Western blot证明HO-1基因已经成功转染ADSCs并出现蛋白水平表达,表明慢病毒介导HO-1成功导入ADSCs中,建立HO-1/ADSCs模型。
骨生成过程涉及细胞增殖、细胞趋化、基质合成和成骨分化[10]。细胞活性是细胞发挥功能的关键,该实验证实转染HO-1基因后可维持较高的细胞活性,与HO-1在内皮细胞发挥的作用一致[3],而血管平滑肌细胞中高水平的HO-1可以抑制细胞增殖[11],HO-1这种细胞选择性更有利于血管新生,但其作用机制仍不清楚,需要进一步研究。另外,HO-1在内皮细胞中还具有抗凋亡的特性,将其作为生长因子引入骨组织工程的种子细胞可能更有利。在四肢骨缺损常面临缺血微环境,造成植入体内的ADSCs处于营养物质不足、低氧等应激状态[12],该实验通过体外采用无血清条件来模拟体内环境,证实HO-1转染组具有相对较低的细胞凋亡率,与之前很多关于保护心肌免受缺血再灌注损伤的研究一致[13]。良好的细胞活性和无血清状态下的抗凋亡效应,二者相辅相成共同保证参与骨生成的细胞数量。同时,该研究中还证实转染HO-1组可以促进矿化基质的合成,提示HO-1具有直接的促成骨效应[3,14]。有趣的是,Zwerina等[15]研究发现HO-1可以调节破骨细胞生成和骨吸收,提示HO-1也可以参与骨重建过程,可能在骨修复的不同阶段发挥不同的效应。
综上,HO-1在ADSCs可以发挥促增殖、抗凋亡的特性,同时,在适当的诱导环境下可以促进成骨分化,慢病毒介导HO-1转染ADSCs有望作为种子细胞应用于骨组织工程。
[1]Zuk P.Adipose-derived stem cells in tissue regeneration:a review [J].ISRN Stem Cells,2013,DOI:10.1155/2013/713959
[2]Lotfy A,Salama M,Zahran F,et al.Characterization of mesenchymal stem cells derived from rat bone marrow and adipose tissue:a comparative study[J].Int J Stem Cells,2014,7(2):135
[3]Kim Y M,Pae H O,Park J E,et al.Heme oxygenase in the regulation of vascular biology:from molecular mechanisms to therapeutic opportunities[J].Antioxid Redox Signal,2011,14(1):137
[4]Gamblin A L,Brennan M A,Renaud A,et al.Bone tissue formation with human mesenchymal stem cells and biphasic Calcium phosphate ceramics:the local implication of osteoclasts and macrophages[J].Biomaterials,2014,35(36):9660
[5]Shi J J,Zhang X,Zhu J X,et al.Nanoparticle delivery of the bone morphogenetic protein 4 gene to adipose-derived stem cells promotes articular cartilage repair in vitro and in vivo[J]. Arthroscopy,2013,29(12):2001
[6]陈晓鹏,胡永成,方成,等.血红素氧化酶1在骨组织工程中的应用分析研究进展[J].中国修复重建外科杂志,2013,27(10):1256
[7]Kimelman Bleich N,Kallai I,Lieberman J R,et al.Gene therapy approaches to regenerating bone[J].Adv Drug Deliv Rev,2012,64 (12):1320
[8]Varma N,Janic B,Ali M,et al.Lentiviral based gene transduction and promoter studies in human hematopoietic stem cells(hHSCs)[J]. J Stem Cells Regen Med,2011,7(1):41
[9]Ngai S C,Rosli R,Nordin N,et al.Lentivirus vector driven by polybiquitin C promoter without woodchuck posttranscriptional regulatory element and central polypurine tract generates low level and short-lived reporter gene expression[J].Gene,2012,498(2): 231
[10]Gurkan U A,Gargac J,Akkus O.The sequential production profiles of growth factors and their relations to bone volume in ossifying bone marrow explants[J].Tissue Eng Part A,2010,16(7):2295
[11]Li Volti G,Wang J S,Traganos F,et al.Differential effect of heme oxygenase-1inendothelialandsmoothmusclecellcycle progression[J].Biochem Biophys Res Commun,2002,296(5):1077
[12]Wagers A J.The stem cell niche in regenerative medicine[J].Cell Stem Cell,2012,10(4):362
[13]Yang J J,Yang X,Liu Z Q,et al.Transplantation of adipose tissuederived stem cells overexpressing heme oxygenase-1 improves functions and remodeling of infarcted myocardium in rabbits[J]. Tohoku J Exp Med,2012,226(3):231
[14]Vanella L,Kim D H,Asprinio D,et al.HO-1 expression increases mesenchymal stem cell-derived osteoblasts but decreases adipocyte lineage[J].Bone,2010,46(1):236
[15]Zwerina J,Tzima S,Hayer S,et al.Heme oxygenase 1(HO-1)regulates osteoclastogenesis and bone resorption[J].FASEB J,2005,19(14):2011
(2015-03-03收稿)
Effect of proliferation,apoptosis and osteogenic differentiation of ADSCs transduced with heme oxygenase-1
CHEN Xiao-peng1,HU Yong-cheng2,FANG Cheng1,ZHANG Li-juan1,ZHANG Rong-xin1,HUANG Wen-jing1
(1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.Department of Bone and Soft Tissue Tumors,Tianjin Hospital,Tianjin 300211,China)
Objective:To investigate the proliferation,apoptosis and osteogenic differentiation effect of heme oxygenase-1(HO-1)overexpression mediated by lentivirus on adipose-derived stromal cells(ADSCs).Methods:Fat tissue was harvested from inguinal area of 10-week-old SD rats,after which ADSCs were isolated and cultured.The morphology of third passages were observed,the multidifferentiation effect and surface markers were investigated to identify ADSCs.The lentivirus vector containing HO-1 gene was constructed through genetic recombination.ADSCs were transfected by lenvirus with polybrene(8 μg/mL).The multiplicity of infection was optimized and HO-1 expression in ADSCs was tested by Western blot.Cells were divided into three groups:ADSCs transfected with Lenti-HO-1 (group A),ADSCs transfected with empty vector(group B)and ADSCs(C group).The proliferation,apoptosis and osteogenic differentiation effect were investigated by MTT assay,flow cytometry and alizarin red staining.Results:ADSCs had a multi-differentiation character,CD29(+),CD44(+),CD90(+),CD31(-),CD45(-).The lentivirus containing HO-1 was constructed successfully evidenced by bacteria PCR and Western blot.Compared with group B and C,cells of group A had a better viability(P<0.05),exhibited anti-apoptotic effect(P<0.05)and more osteogenic differentiation(P<0.05).Conclusion:The lenvirus vector containing HO-1 gene is successfully constructed,and HO-1 could express in ADSCs transfected with Lenti-HO-1.HO-1 expression could enhance pro-viability and anti-apoptotic effect,and it could stimulate osteogenic differentiation of ADSCs.
adipose-derived stromal cells;heme oxygenase-1;lentivirus;osteogenic differentiation
Q81
A
1006-8147(2015)05-0379-06
天津市自然科学基金资助项目(12JCYBJC16400),天津市卫生局科技基金资助项目(2011KY24)
陈晓鹏(1987-),男,硕士在读,研究方向:骨损伤修复;通信作者:胡永成,E-mail:yongcheng.hu@yahoo.com。
