体外构建合成成纤维细胞生长因子-1 mRNA及其表达的初步研究
2015-11-18吴志敏李光明白洁王金鑫贾欣雨杜晓玲朱泽
吴志敏,李光明,白洁,王金鑫,贾欣雨,杜晓玲,朱泽
(天津医科大学病原生物学教研室,天津 300070)
体外构建合成成纤维细胞生长因子-1 mRNA及其表达的初步研究
吴志敏,李光明,白洁,王金鑫,贾欣雨,杜晓玲,朱泽
(天津医科大学病原生物学教研室,天津 300070)
目的:参照mRNA稳定性理论,设计并体外转录合成具有一定稳定性的FGF1 mRNA,对其表达进行初步验证。方法:在pT7TS载体上加poly A、βglobin 3′、5′UTR,增加GC含量优化设计FGF1序列,并结合mRNA二级结构分析其稳定性,目的序列琼脂糖凝胶电泳及测序验证后,体外转录合成FGF1 mRNA,待浓度及片段大小验证后,行动物实验,通过ELISA法检测FGF1 mRNA表达。结果:二级结构分析显示,优化后FGF1序列稳定性更高;双酶切后琼脂糖凝胶电泳显示pT7TS-FGF1重组载体构建成功,测序验证正确;聚丙烯酰胺凝胶电泳显示合成mRNA大小正确。ELISA检测显示,实验组(92.48 pg/mL)小鼠血清中FGF1蛋白含量较对照组(13.59 pg/mL和15.54 pg/mL)明显升高,差异有统计学意义(P<0.01);对照组间FGF1蛋白含量接近,二者无统计学差别(P>0.05)。结论:成功构建并体外转录合成稳定的FGF1 mRNA,mRNA与鱼精蛋白结合后回输小鼠在体内成功表达。
体外转录;mRNA稳定性;成纤维细胞生长因子-1;体内表达
成纤维细胞生长因子-1(fibroblast growth factor-1,FGF1)是一种细胞因子,具有促有丝分裂作用[1],研究发现其有潜在的调节营养平衡作用[2]。2014年,美国科学家通过动物实验证实[3],糖尿病小鼠单次注射FGF1蛋白,可持续2 d以上将血糖水平恢复至正常范围。与普通胰岛素增敏药相比,FGF1蛋白不会引起小鼠体质量增加、心脏和肝脏危险性问题等副作用。但FGF1克隆蛋白是由拟核细菌表达的异源性蛋白,免疫原性和安全性问题限制了其广泛应用。而近来发展的mRNA体外合成技术,能够很好地解决这一问题。2012年Petsch等[4]体外转录合成稳定性mRNA的抗流感疫苗,并在小鼠体内成功表达出蛋白即抗体,抵抗流感病毒的感染。本研究通过优化设计并体外转录合成稳定的FGF1 mRNA,与鱼精蛋白结合成体外稳定结构,小鼠皮下注射,观察其在小鼠体内的表达蛋白,为体外合成mRNA技术构建的细胞因子预防和治疗疾病,进一步为FGF1细胞因子治疗糖尿病奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂质粒提取试剂盒、琼脂糖凝胶回收试剂盒购自天根生化科技有限公司,聚丙烯酰胺凝胶RNA回收试剂盒(Poly-Gel RNA Extraction Kit)购自Omega公司,体外转录试剂盒(mMESSAGE mMACHINE Kit)购自Ambion公司,Taq DNA聚合酶、限制性内切酶SpeⅠ、SalⅠ和EcoRⅠ、T4 DNA连接酶、RNA marker购自大连宝生物工程有限公司。Trans2K Plus II DNA Marker、DH5α感受态、PCR混合试剂购于北京全式金生物技术有限公司,引物合成及测序于苏州金唯智生物科技有限公司。鱼精蛋白购自Sigma公司,人酸性成纤维细胞生长因子(FGF1)ELISA试剂盒为美国Rapidbio产品。
1.1.2 仪器设备涡旋振荡器(Vortex-genie2)、高速冷冻离心机(Eppendorf 5415R centrifuge)、Nanodrop (ND-1000型)、PCR仪(Eppendorf 22331 Hamburg)、Real-time PCR仪(BIO-RAD iQ5)、电泳仪(北京六一仪器厂DYY-7C型)、凝胶成像系统(BIO-RAD ChemiDocTMXRS)、超低温冰箱(海尔DW-86L388)、电子天平(Sartorius CPA64)。
1.2 质粒和动物pT7TS购自Addgene官网,雄性ICR小鼠(18~20 g)30只,购自北京维通利华实验动物技术有限公司。
1.3 方法
1.3.1 pT7TS载体优化pT7TS送金唯智公司测序确定。载体T7启动子之后,设计加入序列,分别为globin 5′UTR、酶切位点、globin 3′UTR、poly A结构A60。由苏州金唯智公司合成并测序验证。
1.3.2 FGF1序列合成及目的载体构建FGF1目的序列参照GeneBank NM_001257210.1,结合软件二级结构预测,在不改变编码氨基酸的情况下进行种属偏好密码子优化,调整GC含量并做分析。选择其中GC含量高且稳定性及结构合理的序列,经序列碱基分析后两端分别设计酶切位点为SpeⅠ和SalⅠ,由苏州金唯智公司合成。前期优化的质粒pT7TS和目的序列FGF1在37℃水浴条件下同时进行SpeⅠ和SalⅠ双酶切2 h,1%琼脂糖凝胶电泳72 V 25 min后用DNA回收试剂盒回收,使用T4 DNA连接酶将目的片段与载体片段于PCR仪中16℃连接过夜。
1.3.3 克隆菌的转化及鉴定连接产物转化于大肠杆菌DH5α感受态细胞中,接种于氨苄抗性的LB平板上,37℃培养箱中过夜。16~18 h内从LB平板上挑选多个单克隆菌,依次接种于5 mL LB液体培养基(氨苄抗性)的试管中,放置于摇床,37℃,200 r/min摇菌1 h。后每管取1 μL菌液行菌落PCR,引物为Forward:GGCAGATCTGTCGACCTCGAGACTAGTATGGCTGAAGGGGAAATCACCACC,Reverse:AACCAGATCCTAGTCAGTCGATATCTTAATCAGAAGAGACTGG CAGGGGG。条件:95℃3 min;95℃30 s,50℃1 min,68℃1 min,35 REP;68℃4 min;HOLD 4℃。琼脂糖凝胶电泳鉴定PCR扩增产物,筛选阳性单克隆菌继续培养16~20 h,按说明书抽提质粒。提取的质粒以SpeⅠ和SalⅠ双酶切(37℃水浴,4 h),琼脂糖凝胶电泳鉴定。鉴定阳性的重组质粒用Nanodrop测定浓度,并送苏州金唯智生物科技有限公司测序,与理论序列比对。
1.3.4 FGF1 mRNA体外合成在无菌无RNA酶条件下,按照mMESSAGE mMACHINE体外转录操作步骤,将鉴定阳性的重组质粒用EcoRⅠ单酶切线性化(37℃、2 h),加入EDTA醋酸铵混合液和无水乙醇停止反应,-20℃放置15 min。微型离心机以最大转数(13.2×1 000 r/min)离心15 min,去上清,枪头小心地移去残余液体。按照重组质粒浓度计算,用无酶水重悬线性质粒浓度为0.5~1 μg/μL。室温下将转录反应组分混合,1 μL线性质粒于20 μL体系,37℃2 h。加入TURBO DNase 1 μL反应37℃15 min,降解模板DNA。后加入50 μL LiCl溶液沉淀RNA,充分混匀,-20℃冷却≥30 min,以最大转速(13.2×1 000 r/min)4℃15 min离心。小心吸除上清,用1 mL70%乙醇冲洗1次,再次以同样条件离心。小心吸除70%乙醇,无RNA酶水溶解后测定RNA浓度,-70℃保存。过程中所有溶液均为试剂盒自带或用无RNA酶水配制。
1.3.5 体外合成mRNA的鉴定获得mRNA通过聚丙烯酰胺凝胶电泳验证后,使用聚丙烯酰胺凝胶RNA回收试剂盒进一步纯化回收,获得更纯的FGF1 mRNA,并由Nanodrop测定浓度。后续实验用到的mRNA均由前面方法重复操作获得。
1.3.6 mRNA-鱼精蛋白复合物获得按照参考文献[5]的方法,换算mRNA浓度后,在无菌无RNA酶室温条件下,将0.5 μg鱼精蛋白:1 μg mRNA(1∶2)于100 μL的缓冲液(150 mmol/L NaCl,10 mmol/L Hepes,pH7.4)中混合孵育,摇匀5 min。不加mRNA的鱼精蛋白按同样步骤进行,用于下一步注射小鼠时的对照。所有用到的溶液均由无RNA酶水配制,操作迅速,摇匀后立即置于冰上。
1.3.7 FGF1 mRNA-鱼精蛋白在小鼠体内的表达
小鼠适应性饲养1周后,随机分为3组,每组10只,分别为1组:生理盐水对照组(0.1 mL/10 g);2组:空白鱼精蛋白对照组(0.1 mL/10 g);3组:FGF1 mRNA-鱼精蛋白组(0.1 mL/10 g)。每天定时注射1次,连续注射3 d,第4天通过尾静脉取血。用干净的1.5 mL离心管收集血液,室温放置2 h使血清析出,4℃3 000 r/min离心10 min,小心吸取上清。按照ELISA检测试剂盒说明步骤操作:设置标准品孔、样本孔和空白孔。标准品依次稀释为:1 000、500、250、125、62.5、0 pg/mL。标准品孔各加不同浓度的标准品50 μL;待测样本孔加待测样本10 μL和样本稀释液40 μL。随后标准品孔和样本孔加HRP标记的检测抗体50 μL,封板膜封住反应孔,37℃水浴锅温育60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min后甩去洗涤液,吸水纸上拍干,重复洗板5次。所有孔加入底物A、B各50 μL,37℃避光孵育15 min,再加入终止液50 μL,15 min内酶标仪测定各孔450 nm处OD值。建立标准曲线,计算各孔FGF1蛋白含量。
2 结果
2.1 优化后载体pT7TS序列根据mRNA稳定性理论及参考文献(讨论部分),优化设计后由公司合成并测序验证,得到了目的pT7TS序列,如图1。得到的质粒由T7作为启动子,能够在序列末端单酶切线性化,满足后续的实验要求。

图1 优化pT7TS结构图Fig 1The optimized structure of pT7TS
2.2 FGF1序列的设计在保证编码氨基酸不变的前提下,进行种属密码子偏好优化,并适当调整增加目的序列中GC含量,由公司结合二级结构预测软件进行分析。如图2,序列A为优化之后,GC含量为58.97%,序列B为原始野生型序列,GC含量为51.50%。分析二级结构后初步认为,序列A的折叠和环相对较少,会比较稳定一些。
2.3 pT7TS-FGF1重组载体构建合成FGF1与优化pT7TS连接,经氨苄青霉素选择和菌落PCR鉴定阳性的菌液所提重组载体,经SpeⅠ和SalⅠ双酶切验证,如图3。10个单克隆菌液PCR,其中有8个得到的主条带均在500 bp附近,与FGF1 PCR条带大小相符。选取其中1个扩增抽提得到的重组质粒,未酶切的显示有4条条带,符合质粒电泳结果,其中较大的1条在3 000~4 000 bp之间。双酶切后得到的2条条带分别约3 000 bp和500 bp,与优化pT7TS和FGF1的大小一致,初步说明重组载体构建成功。送公司测序,结果正确。

图2 调整碱基后编码FGF1蛋白的mRNA结构Fig 2 The secondary structure of optimized mRNA coding FGF1
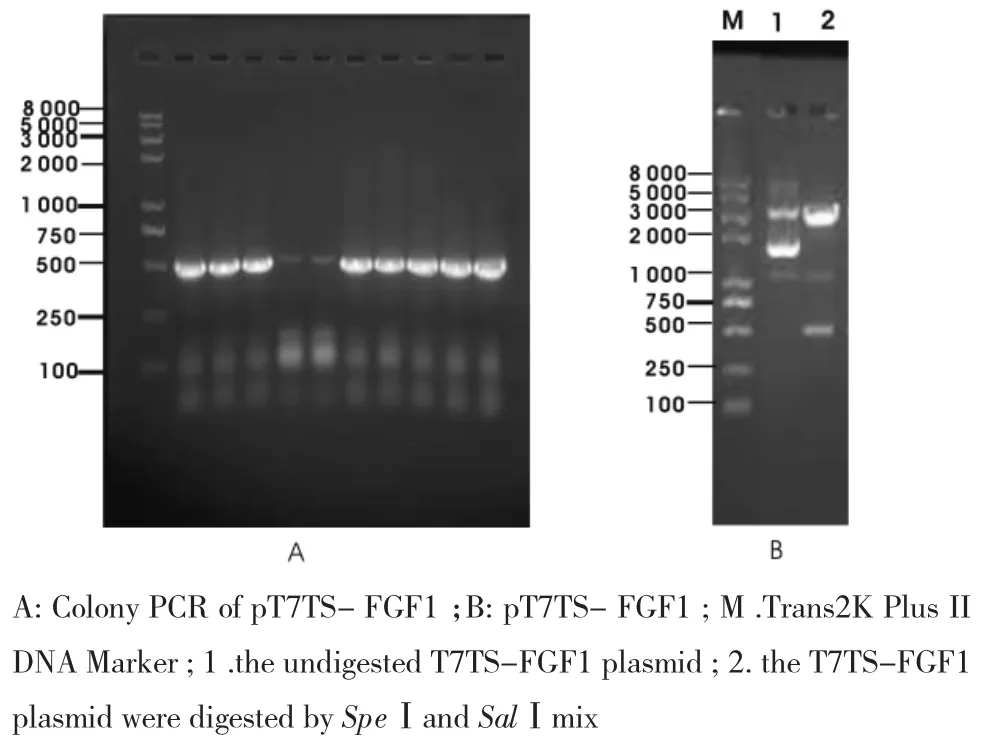
图3 pT7TS-FGF1琼脂糖凝胶电泳Fig 3Agarose gel electrophoresis of pT7TS-FGF1
2.4 体外合成mRNA的检测图4结果显示,转录产物条带大小在700 nt附近,且条带单一。真核mRNA的结构中包括5′cap、5′UTR、编码区、3′UTR 和poly A尾(图5),合成产物的条带位置符合理论合成FGF1 mRNA的大小。Narnodrop测得20 μL转录体系中,得到mRNA的量约为15 μg,OD260/280约1.9~2.0。每次体外转录合成产物略有差别。

图4 mRNA聚丙烯凝胶电泳检测结果Fig 4PAGE result of synthetic mRNA

图5 真核mRNA结构Fig 5The structure of eukaryotic mRNA
2.5 ELISA检测mRNA在小鼠体内的表达ELISA法检测3组小鼠血清中的FGF1含量,结果如图6。实验组(92.48 pg/mL)血清中FGF1的含量显著高于空白对照组(13.59 pg/mL)和鱼精蛋白对照组(15.54 pg/mL),说明mRNA进入体内并成功表达出FGF1蛋白,空白与鱼精蛋白对照组FGF1蛋白含量的差异无统计学意义(P>0.05)。

图6 ELISA检测血清中重组人FGF1蛋白的含量Fig 6Human FGF1 content was identified by ELISA
3 讨论
基因治疗作为一种新的治疗手段受到广泛认可,mRNA因其自身优势而逐渐受到重视。体外转录mRNA后导入体内表达,可翻译成具有功能的蛋白质[6],得到的蛋白是真核表达的,且具有自体同源性[7],与体外表达得到的蛋白相比,减少了MHC限制等排斥反应及其他潜在的不安全因素。同时mRNA稳定性的问题也随着研究的逐步深入而破解,Petsch等[4]体外合成特异性mRNA并开发出新型抗流感疫苗,实现了设计并体外转录mRNA在体内表达的成功应用。
真核mRNA结构包括5′cap、5′UTR、开放阅读框、3′UTR和polyA尾等部分,各部分均与稳定性密切相关。研究显示,使用帽子类似物ARCA或者牛痘病毒加帽系统代替常规的帽子结构,可显著提高mRNA的翻译率,而翻译常常被作为稳定性的一个标准。常规帽子类似物添加方向具有不确定性,反向添加的帽子结构其甲基化会受到影响,故而翻译效率大大下降[8];而且ARCA本身在细胞中就具有较长的半衰期[9]。PolyA中碱基数对mRNA稳定性也起到重要作用,该结构能够增加mRNA的稳定性和蛋白的表达[10],polyA的减少意味着mRNA的衰退。当腺苷酸残基A少于约20 nt时,mRNA便不能结合多聚A结合蛋白(PABP)进行翻译,mRNA就会进入降解程序[11]。mRNA的降解与UTR,尤其是3′UTR的末端有密切关系,对UTR的优化常通过使用globin的UTR。非洲爪蟾蜍β globin的5′和3′UTR对体外转录的稳定性有重要的意义[12],已有研究表明,globin 5′UTR提高了翻译效率而3′UTR增加了mRNA的稳定性[13]。另有研究发现,编码globin、胶原蛋白及免疫球蛋白等常见蛋白的mRNA相对来说会更稳定[14]。本研究序列设计中也引入globin UTR来稳定体外转录合成的mRNA。开放阅读区GC含量高的mRNA会更加稳定,CUREVAC GMBH[15]通过在原野生型基础上增加GC含量,构建GC稳定型序列。不同种属密码子具有选择偏好,个体内同一种氨基酸的不同tRNA可能有差别,当相应tRNA较少时,可能会大大减缓翻译的进行[16]。鱼精蛋白结合mRNA后能够抵抗血清对mRNA的降解而起到稳定作用[5]。一些研究发现,鱼精蛋白与mRNA结合的复合体通过TLRs受体作用,对人和小鼠的免疫细胞有很强的活化作用[17]。
本研究参照RNA稳定性理论及前期研究基础,通过对载体pT7TS进行加5′UTR、3′UTR、polyA等结构优化,以及适当调整酶切位点,获得了优化的体外转录载体。选用pT7TS是由于该质粒含有能被噬菌体RNA聚合酶特异性识别的T7启动子,T7较其他如SP6启动子等有更好的转录速率。pT7TS通过其酶切位点能够保证3′、5′UTR、polyA序列的加入,也能确保后期单酶切使质粒线性化,满足转录的要求。在此基础上插入GC含量增加、密码子优化并二级结构初步分析后的FGF1序列,聚合酶转录合成的同时加入了5′cap结构,在序列设计上保证了目的mRNA在细胞内外的相对稳定性,5′cap结构保证识别核糖体和启动合成蛋白。纯化后的mRNA与鱼精蛋白结合后,抵抗RNA酶的消化[5],进一步增加了mRNA体内稳定。通过电泳及ELISA结果看到,研究中成功合成了目的mRNA并在体内实现了表达。
在合成稳定mRNA自身安全性的基础上,通过氯化锂沉淀法可以去除寡核苷酸、无机盐和大部分蛋白。而用HPLC方法[18]对产物进一步纯化,可以适应更高纯度mRNA使用的需求。
本研究成功完成了FGF1稳定性mRNA的体外合成并在体内表达出目的蛋白。获得的FGF1蛋白是机体自身翻译产物,与异体甚至原核表达的蛋白相比,避免了MHC限制等排斥反应以及其他不安全因素。尽管FGF1作用机制尚未完全明确,且本研究表达的FGF1蛋白是否具有功能尚待进一步深入论证,但该方法的表达成功以及mRNA自身所具有的特质,为FGF1治疗糖尿病以及其他疾病的基因治疗提供了一种新的途径,为找到FGF1调节血糖作用的信号路径和受体提供了一定的实验基础。
[1]Itoh N,Ornitz D M.Fibroblast growth factors:from molecular evolution to roles in development,metabolism and disease[J].J Biochem,2011,149(2):121
[2]Jonker J W,Suh J M,Atkins A R,et al.A PPARγ-FGF1 axis is required for adaptive adipose remodelling and metabolic homeostasis [J].Nature,2012,485(7398):391
[3]Suh J M,Jonker J W,Ahmadian M,et al.Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer[J].Nature,2014,513(7518):436
[4]Petsch B,Schnee M,Vogel A B,et al.Protective efficacy of in vitro synthesized,specific mRNA vaccines against influenza A virus infection[J].Nat Biotechnol,2012,30(12):1210
[5]Hoerr I,Obst R,Rammensee H G,et al.In vivo application of RNA leads to induction of specific cytotoxic T lymphocytes and antibodies [J].Eur J Immunol,2000,30(1):1
[6]Rabinovich P M,Komarovskaya M E,Ye Z J,et al.Synthetic messenger RNA as a tool for gene therapy[J].Hum Gene Ther,2006,17 (10):1027
[7]Kramps T,Probst J.Messenger RNA-based vaccines:progress,challenges,applications[J].Wiley Interdiscip Rev RNA,2013,4(6):737
[8]Pasquinelli A E,Dahlberg J E,Lund E.Reverse 5'caps in RNAs made in vitro by phage RNA polymerases[J].RNA,1995,1(9):957
[9]Grudzien E,Kalek M,Jemielity J,et al.Differential inhibition of mRNA degradation pathways by novel cap analogs[J].J Biol Chem,2006,281(4):1857
[10]Wiederhold K,Passmore L A.Cytoplasmic deadenylation:regulation of mRNA fate[J].Biochem Soc Trans,2010,38(6):1531
[11]Amrani N,Ghosh S,Mangus D A,et al.Translation factors promote the formation of two states of the closed-loop mRNP[J].Nature,2008,453(7199):1276
[12]Malone R W,Felgner P L,Verma I M.Cationic liposome-mediated RNA transfection[J].Proc Natl Acad Sci U S A,1989,86(16):6077
[13]Wang Z,Day N,Trifillis P,et al.An mRNA stability complex functions with poly(A)-binding protein to stabilize mRNA in vitro[J]. Mol Cell Biol,1999,19(7):4552
[14]Peixeiro I,Silva A L,Romão L.Control of human beta-globin mRNA stability and its impact on beta-thalassemia phenotype[J]. Haematologica,2011,96(6):905
[15]Kallen K J,Thess A.A development that May evolve into a revolution in medicine:mRNA as the basis for novel,nucleotide-based vaccines and drugs[J].Ther adv vaccines,2014,2(1):10
[16]Pascolo S.Vaccination with messenger RNA(mRNA)[J].Handb Exp Pharmacol,2008(183):221
[17]Rettig L,Haen S P,Bittermann A G,et al.Particle size and activation threshold:a new dimension of danger signaling[J].Blood,2010,115(22):4533
[18]Karikó K,Muramatsu H,Ludwig J,et al.Generating the optimal mRNA for therapy:HPLC purification eliminates immune activation and improves translation of nucleoside-modified,protein-encoding mRNA[J].Nucleic Acids Res,2011,39(21):e142
(2015-03-17)
Preliminary study on the construction,the synthesis of FGF-1 mRNA in vitro and its expression in vivo
WU Zhi-min,LI Guang-ming,BAI Jie,WANG Jin-xin,JIA Xin-yu,DU Xiao-ling,ZHU Ze
(Department of Microbiology,Tianjin Medical University,Tianjin 300070,China)
Objective:To optimize and synthesize FGF-1 mRNA by in vitro transcription and investigate its stability and expression both in vitro and in vivo.Methods:Poly A and β globin 3′and 5′UTR on pT7TS were added.FGF1 sequence were optimized by increasing GC content and analyzing its stability with the secondary structure of mRNA.Constructed pT7TS-FGF1 then verified it correction by agarose gel electrophoresis(AGE)and sequencing.After the in vitro transcription FGF1 mRNA,its concentration was measured by Narnodrop and its size was analysed by polyacrylamide gel electrophoresis(PAGE).The expression of mRNA in vivo was detected by ELISA in mice assay. Results:The optimized FGF1 was more stable after being predicted and analyzed by secondary structure.Double digestion verification of agarose gel electrophoresis and the sequencing showed that pT7TS-FGF1 had been constructed successfully.The band on PAGE verified that the mRNA size was correct.ELISA assay result showed the expression of the FGF1 protein in serum in the test group(92.48 pg/mL)was higher than that of the control group(13.59 pg/mL and 15.54 pg/mL)(P<0.01).No significant difference was found in the expression of the FGF1 protein in serum between the control groups(P>0.05).Conclusion:FGF1 mRNA can be successfully constructed and synthesized by in vitro transcription.mRNA bounding with protamine can be expressed in the injected mice.
in vitro transcription;mRNA stability;FGF1;in vivo expression
Q7
A
1006-8147(2015)05-0375-04
国家自然科学基金资助项目(81402215);天津医科大学基金资助项目(2013KYQ13)
吴志敏(1990-),男,硕士在读,研究方向:转录机制及疾病的生物治疗;通信作者:朱泽,E-mail:zhuze@tmu.edu.cn。
