嗜水气单胞菌LAMP的快速检测方法研究
2015-11-12喻蔚周颖周有祥等
喻蔚 周颖 周有祥 等

摘要:利用环介导等温扩增技术(LAMP)建立了一种对嗜水气单胞菌(Aeromonas hydrophila)进行快速检测的方法。基于嗜水气单胞菌tbpA基因,设计了一套引物,并优化了反应体系的温度、时间和Mg2+浓度,分析了该方法的特异性与灵敏度。结果表明,在59 ℃条件下,LAMP的最适扩增时间为40 min,能有效检测到1 pg/?滋L核酸浓度,且检测出嗜水气单胞菌为阳性,其他菌株为阴性,该方法耗时短,灵敏度高,特异性好,适合嗜水气单胞菌的快速检测。
关键词:嗜水气单胞菌(Aeromonas hydrophila);环介导等温扩增技术(LAMP);tbpA基因;快速检测
中图分类号:S917.1 文献标识码:A 文章编号:0439-8114(2015)20-5125-04
DOI:10.14088/j.cnki.issn0439-8114.2015.20.051
Study on the Rapid Detection of Aeromonas hydrophila by
Loop-mediated Isothermal Amplification
YU Wei1a,ZHOU Ying1b,ZHOU You-xiang2,LIN Li1a,ZHOU Yang1a
(1a.College of Fisheries;1b.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070, China;2.Institute of Agricultural Quality Standards and Testing Technology Research, Hubei Academy of Agricultural Sciences,Wuhan 430064, China)
Abstract: LAMP (Loop-mediated isothermal amplification) as a kind of rapid detection method for Aeromonas hydrophila was established. A set of primers were designed based on the sequences of the tbpA gene of A. hydrophila. Temperature, time, Mg2+ concentration of reaction system were optimized, and detected the specificity and sensitivity of this method. The results showed that under 59 ℃, the LAMP amplification optimum time for 40 min, this method could effectively detect the nucleic acid concentration with 1 pg/μL, and the LAMP of A. hydrophila reactions was positive, others were negative. In a conclusion, the LAMP detective method was short time-consuming, sensitivity and specificity; and it was suitable for rapid detection of A. hydrophila.
Key words: Aeromonas hydrophila; LAMP; tbpA gene; rapid detection
嗜水气单胞菌广泛存在于自然界中,能在水体及土壤中生长繁殖[1],是一种典型的人-畜-鱼共患病病原菌[2]。嗜水气单胞菌已被证实为腹泻病原菌[3],可引起人类急性胃肠道感染和食物中毒,出现腹痛、腹泻、发热、急性胃肠炎等[4,5],给人类的健康带来了威胁。而国外早已将嗜水气单胞菌纳入腹泻病原菌的检测范围,是食品卫生检验的对象[6]。嗜水气单胞菌可感染草鱼、鲫鱼、鲢鱼、团头鲂、黄颡鱼等多种淡水鱼,并引起水产养殖中的鳗红鳍病、鳖赤斑病、罗非鱼腐皮病[7,8]。从20世纪90年代起,全国各地爆发性鱼病案例中分离出的致病菌中,嗜水气单胞菌所占比例越来越大。2006年,全国水产养殖业因病害造成的损失约为115亿元[9],而嗜水气单胞菌是各种病原菌中危害最大的,其使得养殖鱼类在短短几天中大量死亡,造成了巨大的经济损失。故嗜水气单胞菌对水产养殖行业有着极大的威胁。
因此,建立嗜水气单胞菌的快速检测方法对食品安全和水产养殖具有重要意义。目前,嗜水气单胞菌的传统检测方法包括细菌分离、培养、生理生化试验和血清鉴定等步骤,至少需要3~5 d时间[10],不仅耗时长、步骤多,还容易出现漏检等问题。此外,酶联免疫吸附检测法、免疫荧光抗体和聚合酶链式反应(PCR)法等检测方法[11,12],也都存在操作复杂、敏感性和特异性差等缺点。环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是日本学者Notomi[13]于2000年发明的一种核酸恒温扩增技术,具有操作简单、特异性强、灵敏度高、操作简便等特点。该技术通过针对靶基因的6个区域而设计4种特异引物,在具有链置换活性的Bst DNA聚合酶作用下进行的一种自动链置换DNA 合成反应,Nagamine[14]发现通过添加环引物,可大大加快反应速度。该技术在恒温下就可进行核酸扩增[15],通常反应在1 h内完成。本试验通过生物信息学方法,发现tbpA基因在嗜水气单胞菌中高度保守,不存在于其他菌种中。故建立基于嗜水气单胞菌tbpA基因的LAMP技术,实现快速检测嗜水气单胞菌,同时也可为相关研究提供参考。
1 材料与方法
1.1 材料
嗜水气单胞菌J1为南京农业大学刘永杰教授馈赠,乳链球菌、枯草芽孢杆菌、噬热脂肪芽孢杆菌、噬热液化芽孢杆菌购于北京北纳创联生物技术研究院。
细菌基因组提取试剂盒为北京康为世纪生物科技有限公司产品,Bst DNA聚合酶大片段及ThermoPolTm Reaction Buffer为New England Biolabs公司产品,SYBR Green I为北京索莱宝科技有限公司产品,dNTPs为大连宝生物工程有限公司产品,MgCl2为Thermo Scientific公司产品。
1.2 仪器
DYY-6C型电泳仪(北京市六一仪器厂),PCR仪(ProFlexTM公司),Gel Doc XR+型凝胶成像系统(Bio-Rad 公司)。
1.3 方法
1.3.1 LAMP引物设计与合成 根据嗜水气单胞菌ML09-119的tbpA基因选取保守性较高的一段序列,利用专门设计LAMP 引物的在线设计软件[Primer Explorer Version 3(http://primerexplorer.jp/lamp3.0.0/index.html)]设计LAMP反应引物。所得引物序列,由北京擎科新业生物技术有限公司合成,引物序列见表1。
1.3.2 基因组的提取 应用细菌基因组提取试剂盒(康为世纪公司)提取细菌基因组,提取的基因组保存于-20 ℃,待用。
1.3.3 LAMP方法的优化 Mg2+浓度、反应温度和反应时间对于反应的灵敏性和特异性均有影响,因此采用控制变量法优化Mg2+浓度、反应温度和反应时间。LAMP 反应体系包括:1 ?滋L 0.8 μmol/L FIP,1 ?滋L 0.8 μmol/L BIP,0.25 ?滋L 0.1 ?滋mol/L F3,0.25 ?滋L 0.1 ?滋mol/L B3,1 ?滋L 0.4 μmol/L LB,1 ?滋L 0.4 μmol/L LF,1.5 ?滋L 0.6 mmol/L dNTPs,2 ?滋L 4 mmol/L MgCl2(除优化Mg2+浓度时),10 mmol/L KCl,20 mmol/L Tris-HCl(pH7.5),10 mmol/L(NH4)2SO4,0.5 ?滋L DNA模板,0.2 ?滋L Bst DNA链置换聚合酶,最后用灭菌去离子水补足至25 ?滋L。
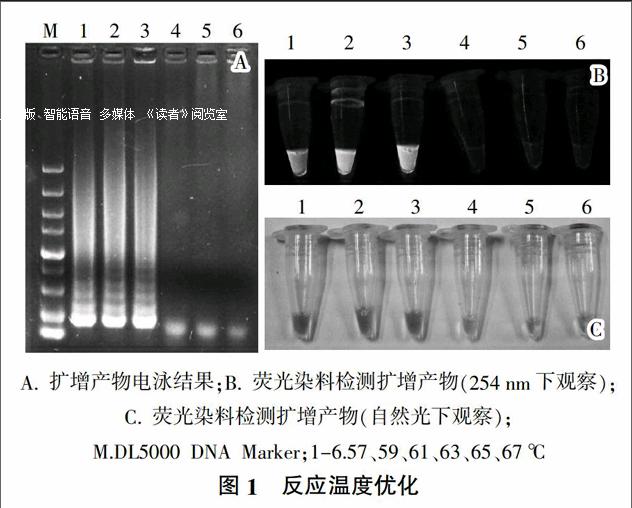
1)反应温度的优化。保持反应体系内各组分浓度不变,反应时间为40 min。选择57、59、61、63、65和67 ℃ 6个不同的反应温度,在同样的反应条件下,将扩增产物在1%琼脂糖凝胶上110 V电泳分离30 min,观测结果。并向扩增产物中加入1 ?滋L稀释10倍的SYBR Green I荧光染料,在254 nm处紫外光照射下观察其荧光强度。
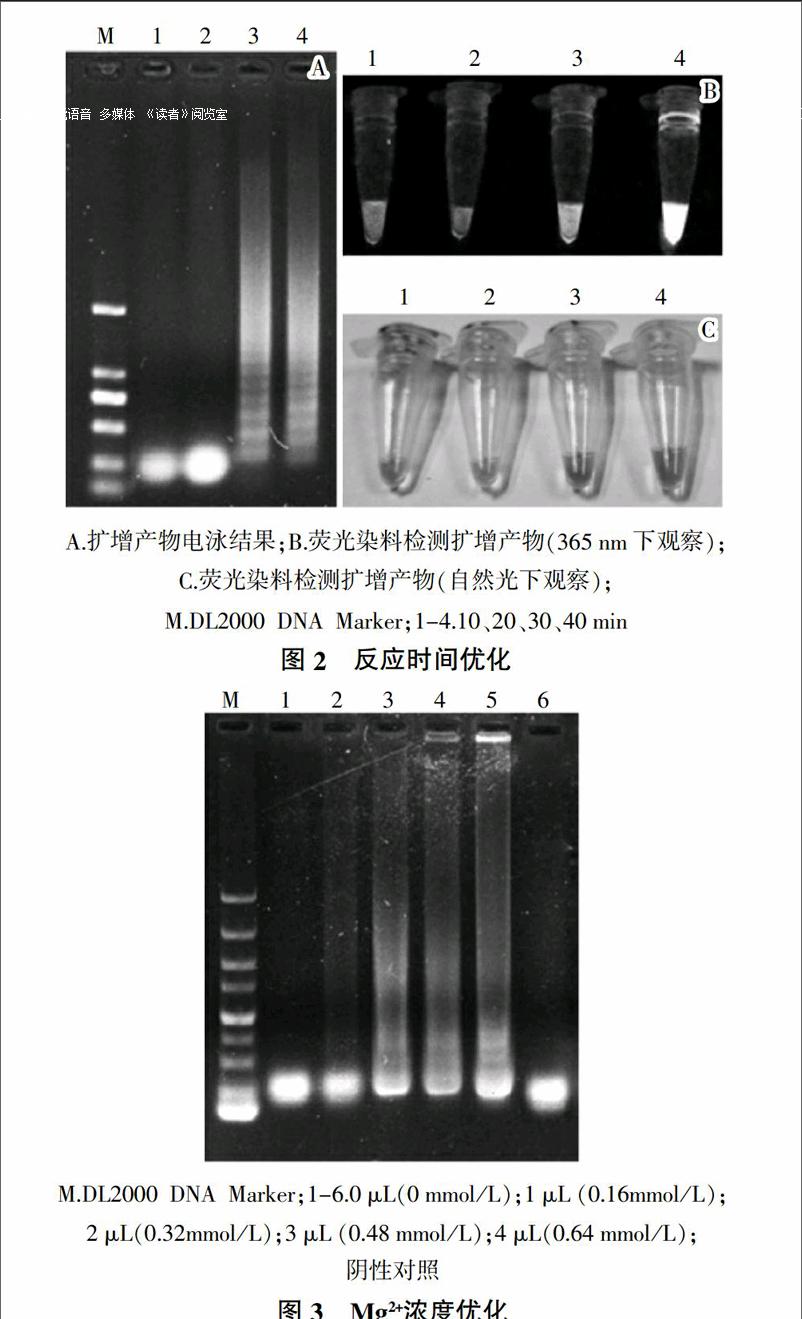
2)反应时间的优化 保持反应体系内各组分浓度不变,反应温度为59 ℃。选择10、20、30和40 min不同的反应时间,在同样的反应体系下,将扩增产物在1%琼脂糖凝胶上110 V电泳分离30 min,观测结果。并向产物中加入1 ?滋L稀释10倍的SYBR Green I荧光染料,在365 nm处紫外光照射下观察其荧光强度。
3)Mg2+浓度的优化。保持反应体系内除Mg2+浓度外各组分浓度不变,反应温度为59 ℃,反应时间为40 min。选择反应体系内Mg2+终浓度分别为0、0.16、0.32、0.48和0.64 mmol/L。在同样反应条件下,将扩增产物在1%琼脂糖凝胶上110 V电泳分离30 min,并观测结果。
1.3.4 LAMP特异性试验 应用已优化的LAMP反应体系,在同样的反应条件下,同时对乳链球菌、枯草芽孢杆菌、噬热脂肪芽孢杆菌、噬热液化芽孢杆菌和嗜水气单胞菌进行扩增,将扩增产物在1%琼脂糖凝胶上110 V电泳分离30 min,并观测结果。
1.3.5 LAMP灵敏度试验 将嗜水气单胞菌基因组模板依次稀释为1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL。应用于已优化的LAMP反应体系,同反应条件下对不同浓度的嗜水气单胞菌基因组进行扩增,将扩增产物在1%琼脂糖凝胶上110 V电泳分离30 min。向产物中加入1 μL稀释10倍的SYBR Green I荧光染料,在365 nm处紫外光照射下观察其荧光强度。
2 结果与分析
2.1 反应温度的优化
试验发现当反应温度为57、59、61 ℃时,均能扩增tbpA基因,得到条带。向扩增产物中加入SYBR Green I荧光染料后,59 ℃条件下扩增产物的荧光强度明显高于57、61 ℃反应下的扩增产物。故说明最适反应温度为59 ℃(结果见图1)。
2.2 反应时间的优化
结果如图2所示,在10、20 min条件下无扩增条带,而在30、40 min条件下均可得到梯型条带。向扩增产物中加入SYBR Green I荧光染料后,40 min条件下扩增产物的荧光强度明显高于 30 min的扩增产物。故说明最适反应时间为40 min。
2.3 Mg2+浓度的优化
电泳结果如图3所示。加入2、3、4 μL Mg2+时均可得到梯型条带,且条带亮度差异不大,考虑到试验成本,加入2 μL即LAMP体系内Mg2+终浓度为0.32 mmol/L为最优条件。
2.4 LAMP特异性试验
对乳链球菌、枯草芽孢杆菌、噬热脂肪芽孢杆菌、噬热液化芽孢杆菌和嗜水气单胞菌的扩增结果如图4所示。只有嗜水气单胞菌出现梯型条带,呈阳性反应,其他非嗜水气单胞菌菌株检测结果均为阴性。
2.5 LAMP灵敏度试验
将嗜水气单胞菌基因组模板稀释后进行扩增,产物经荧光染料染色后,可观察到各个浓度下的扩增产物均有明显的荧光,结果如图5所示。经电泳检测,在1 pg/μL时依然可以得到梯型条带,说明LAMP检测方法灵敏度高。
3 讨论
嗜水气单胞菌是一类广泛存在于自然界的人-畜-鱼共患病病原菌,不仅在食品安全上对人类健康造成威胁,对水产养殖行业也带来了严重的经济损失。因此,对嗜水气单胞菌的检测在动物疾病和食品卫生研究上都具有重要意义。
通过生物信息学的方法,发现tbpA基因在嗜水气单胞菌中高度保守,在其他菌种中却没有发现。故本试验基于tbpA基因建立一种LAMP方法以达到快速检测嗜水气单胞菌的目的。
本试验通过优化LAMP反应体系中的Mg2+浓度、反应时间和反应温度,发现当LAMP体系内Mg2+终浓度为0.32 mmol/L,59 ℃反应40 min为该方法的最优化条件。通过特异性试验和灵敏性试验,发现该方法特异性强,灵敏度高。只有嗜水气单胞菌在该方法下扩增出现梯型条带,呈阳性反应,而其他非嗜水气单胞菌菌株检测结果均为阴性,可检测到核酸浓度为 1 pg/μL,说明该方法具有较高的灵敏度。
本试验利用LAMP技术建立的快速检测方法,在保证灵敏性和特异性的前提下,简化了操作步骤,大大节省了时间和成本,通过琼脂糖凝胶电泳法和荧光染色法均可判断结果,该方法为开发适用于基层的快速水产品中的嗜水气单胞菌检测方法提供参考。
参考文献:
[1] YUCEL N,ERDOGAN S. Virulence properties and characterization of aeromonads isolated from foods of animal origin and environmental sources[J]. J Food Prot,2010,73(5):855-860.
[2] 付乔芳,邱军强,胡 鲲,等.嗜水气单胞菌毒力基因在传代过程中的稳定性研究[J].生物技术通报,2011(9):130-135.
[3] 黄 艳,韦小瑜,王定明,等.一起嗜水气单胞菌引起的食物中毒调查[J].中国食品卫生杂志,2012,24(4):391-393.
[4] 王琳娜.嗜水气单胞菌感染导致群体性腹泻的病原学分析[J]. 中国卫生检验杂志,2007,5(17):922-923.
[5] 赵晓艳,苏领彦,王明良.北京市某敬老院一起食源性嗜水气单胞菌急性胃肠炎暴发调查[J].职业与健康,2014,30(4):521-523.
[6] 杨守明.嗜水气单胞菌及其对人的致病性[J].疾病控制杂志,2006,10(5):511-514.
[7] 陈怀青,陆承平.嗜水气单胞菌:黄鳝出血性败血症的病原[J].中国人兽共患病杂志,1991,7(4):21-23.
[8] 陈爱平,朱泽闻,王立新,等.2006年中国水产病害检测报告[J].科学养鱼,2007(7):48-49.
[9] 肖克宇,江为民,彭顺平,等.中华鳖暴发性死亡症的病原及防治研究[J].湖南农业大学学报,1998,24(1):67-71.
[10] 夏 凡,杨丽君,王 静,等.病原性海洋弧菌致病机理及其快速检测方法研究进展[J].食品工业科技,2011,32(1):366-376.
[11] SUBASHKUMAR R, THAVUMANAVAN T, VIVEKANANDHAN G, et al . Occurrence of Aeromonas hydrophila in acute gasteroenteritis among children [J]. Indian J Med Res, 2006, 123(1): 61-66.
[12] 肖婧凡,王 玥,张元兴,等.海水养殖细菌性病害检测方法研究进展[J].中国工程科学,2014,16(9):10-15.
[13] NOTOMI T. Loop-mediated isothermal amplification[J]. Nip-pon Rinsho,2007,65(5):957-961.
[14] NAGAMINE K,HASE T, NOTOMI T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probe,2002,16(3):223-229.
[15] 黄火清,郁 昂.环介导等温扩增技术的研究进展[J].生物技术,2012,22(3):90-94.
