丁硫克百威残留对土壤酶活及微生物的影响
2015-11-12赵静汪凤娟赵思峰等
赵静+汪凤娟+赵思峰+等


摘要:采用室内培养法研究了丁硫克百威2、8、20、50 mg/kg 4个浓度处理对土壤微生物数量、酶活性以及微生物群落功能多样性的影响。结果表明,丁硫克百威对土壤放线菌种群有明显抑制作用,对细菌和真菌影响较小。2、8、20 mg/kg浓度处理对土壤蔗糖酶有促进作用,50 mg/kg浓度处理抑制蔗糖酶活性;各浓度处理对脲酶和碱性磷酸酶均表现抑制作用;2 mg/kg浓度处理对过氧化氢酶表现为“抑制-促进-抑制”的变化趋势,而8、20、50 mg/kg浓度处理对过氧化氢酶有很强抑制作用;处理7 d后低浓度丁硫克百威的AWCD值低于对照水平,而高浓度的AWCD值高于对照水平,14 d后基本恢复对照水平;各处理组的Shannon指数在7 d后与对照有差异,14 d后基本恢复至对照水平;Simpson指数在7 d和14 d后与对照基本一致;50 mg/kg浓度处理的McIntosh指数高于对照。
关键词:丁硫克百威;土壤微生物;土壤酶;群落功能多样性
中图分类号:X53;S482.3 文献标识码:A 文章编号:0439-8114(2015)20-5035-05
DOI:10.14088/j.cnki.issn0439-8114.2015.20.028
The Influence of Carbosulfan Residue on Soil Enzymes Activity and Microbial
ZHAO Jing,WANG Feng-juan,ZHAO Si-feng,DU Juan
(Key Laboratory at Universities of Xinjiang Uygur Autonomous Region for Oasis Agricultural Pest Management and Plant Protection Resource Utilization/College of Agriculture,Shihezi University, Shihezi 832003,Xinjiang, China)
Abstract: The effect of 4 different concentrations (2,8,20 and mg/kg) of Carbosulfan on soil microbial quantity,activity and functional diversity of communities were studied by incubation experiments. The results showed that actinomycetes in soil was significantly inhibited, bacteria and fungi in soil was slightly inhibited by carbosulfan residue. The activity of sucrose was promoted by 2,8 and 20 mg/kg concentration of carbosulfan residue, but it was restrained by 50 mg/kg concentration.The activities of urease and alkaline phosphatase were inhibited by all the concentration of carbosulfan residue. The tendency of catalase activity was “suppression-promotion-suppression”, which was treated by 2 mg/kg concentration of carbosulfan residue, however,it was greatly suppressed by 8,20,50 mg/kg concentration. After 7 d treatment,the AWCD value of low carbosulfan residual concentrations was lower than CK,but the AWCD value of high concentrations was higher than CK.After 14 d it returned to CK level. The Shannon indexes for each treatment group were different from CK at 7 d, and they went back to CK level at 14 d. The Simpson indexes were always same as CK at 7 d and 14 d. McIntosh value of 50 mg/kg concentration was higher than CK.
Key words: carbosulfan; soil microbe; soil enzyme; community functional diversity
丁硫克百威是一种内吸性、高脂溶性和在土壤及植物中易于降解的氨基甲酸酯类杀虫剂,其本身毒性较低。但其施用后可在昆虫体内转化为克百威、3-羟基克百威、3-酮基克百威等高毒性成分,这既保持了克百威的优异杀虫活性又显著降低了其施用毒性[1],因此已广泛应用于土壤处理和叶面喷雾以防治各种作物上的土居昆虫和叶面害虫[2-5]。新疆是中国最大的植棉区,产量占全国50%以上。叶螨、蚜虫、蓟马等害虫常在棉花生长早期造成严重危害,采用甲拌磷拌种是最有效的防治措施[6]。然而长期使用甲拌磷对土壤中的微动物、微生物等造成严重影响[6,7],间接影响了土壤中的微生态安全。因此,许多地区开始采用丁硫克百威拌种用于棉花及其他作物苗期害虫的防治[2,8],且对其使用安全性进行了评价[2,9,10]。目前丁硫克百威作为棉花种衣剂的主要成分已在新疆很多植棉区进行了大面积推广应用,然而其对新疆棉田土壤微生态有何影响尚未进行过系统研究。本研究设置了5个丁硫克百威浓度,在室内模拟条件下,对其土壤微生物生态毒理效应进行研究,为客观评价丁硫克百威在新疆棉田土壤的微生态风险提供科学依据。endprint
1 材料与方法
1.1 材料
供试农药为20%丁硫克百威乳油,由江苏省无锡市稼宝药业有限公司生产。
供试土壤取自石河子大学农学院试验站荒地5~20 cm处的匀质土壤,取样地块未施用过任何化学农药,去除植物根系及其他杂物后过4 mm筛备用。取样土壤的有机质26.10 g/kg,全氮1.75 g/kg,速效磷31.48 mg/kg,速效钾196.77 mg/kg,pH 8.59。
1.2 方法
1.2.1 试验设计及土壤处理 称取相当于3.0 kg风干土壤的新鲜土壤置于直径26 cm、深11.5 cm的盆钵中,每盆加入3.15 kg新鲜土壤。向土壤中添加以去离子水稀释的丁硫克百威溶液均匀搅拌,使其浓度分别达到0、2、8、20、50 mg/kg,每个处理设3组重复。调节土壤含水量至田间最大持水量的60%,培养过程中为了保持土壤湿度不变,每天采用称重法补充蒸发损失的水分。将盆钵放置于培养箱中25 ℃黑暗培养,分别在处理后1、3、7 、14、30 d取土样。将取得的土壤样品分成2份,一份新鲜土壤压碎过2 mm筛,供土壤微生物计数及功能多样性分析;另一份室内自然风干、压碎过筛,供土壤酶活性分析。
1.2.2 真菌、细菌和放线菌数量测定 分别采用牛肉膏蛋白胨、马丁氏孟加拉红和改良的高氏1号培养基对土样中的细菌、真菌和放线菌进行分离培养。牛肉膏蛋白胨培养基[11]:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,去离子水1 000 mL,pH 7.2~7.4。马丁氏孟加拉红培养基[11]:KH2PO4 1 g,MgSO4·7H2O 0.5 g,蛋白胨5 g,葡萄糖10 g,孟加拉红0.033 g,氯霉素0.1 g,琼脂18.5 g,去离子水1 000 mL。改良的高氏1号培养基[11]:KNO3 1.0 g,KH2PO4 0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,NaCl 0.5 g,可溶性淀粉20 g,琼脂15 g,pH 7.2~7.4。
菌数/g干土=计数皿平均菌落数×10×计数皿稀释倍数/干土重[11]。
1.2.3 土壤酶活性测定 土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法(1)[12],蔗糖酶活性以24 h后1 g土壤葡萄糖的毫克数表示;脲酶活性采用比色法[12],以24 h后1 g土壤中NH3-N的毫克数表示;碱性磷酸酶活性采用磷酸苯二钠比色法(2)[12],以2 h后100 g干土中P2O5的毫克数表示;过氧化氢酶活性采用高锰酸钾滴定法[12],以20 min后1 g土壤的0.1 N高锰酸钾的毫升数表示。
1.2.4 微生物群落功能多样性分析 为了探究丁硫克百威对土壤微生物碳源利用的情况,选取了7 d和14 d 2个培养时间段的3个丁硫克百威残留浓度(2、20、50 mg/kg)的土壤样品来进行测定,同时设置对照。采用有31种碳源的Biolog-ECO板分析各处理的微生物群落功能多样性。测定方法如下,将4 ℃保存的Biolog-ECO从冰箱取出,预热至25 ℃备用。将采集的土样根据土壤含水量称取相当于5.0 g烘干土重的新鲜土样(7 d取样的称取5.9 g左右,14 d取样的称取5.8 g左右),加入经灭菌的装有45.0 mL 0.85 mol/L NaC1溶液的三角瓶中,200 r/min振荡30 min,静置3~5 min后按梯度稀释法将土壤悬浮液用0.85 mol/L NaC1溶液稀释至10-3浓度,用移液器将稀释液150.0 μL分别接种于生态测试板的96孔中,每份土样的稀释液按同样方法设置3组平行[13]。将接种好的微孔板放置于铺有3层纱布的保鲜盒中,为防止微平板鉴定孔中的菌悬液蒸发,纱布需保持一定的湿度。再将保鲜盒放入25 ℃的恒温培养箱中暗培养。每隔12 h用BIOLOG读数仪(BIOLOG,Hayward,USA)在590 nm下读数,连续测定7 d[14,15]。
计算方法如下[15]:AWCD=∑(C-R)/31,其中,C为每个碳源孔的吸光值;R为对照孔的吸光值;Shannon指数H′=-∑[Pi·ln(Pi)]其中,Pi为第i孔的相对吸光值,(C-R)与整个平板相对吸光值总和的比率;Simpson指数D=1-∑(Pi)2;McIntosh指数U=■;其中,ni为第i孔的相对吸光值(C-R)。
1.2.5 数据统计分析 采用Excel 2003和SPSS 11.0软件对数据进行统计分析。
2 结果与分析
2.1 丁硫克百威对土壤微生物的影响
不同浓度丁硫克百威残留对土壤细菌、放线菌和真菌的影响如图1所示。2 mg/kg和8 mg/kg两个处理浓度的丁硫克百威对细菌生长有抑制作用,其中以1 d和3 d的抑制效果较为明显,7 d后抑制作用减弱,差异不显著;20 mg/kg处理浓度在1 d和3 d能抑制细菌生长,7 d之后有促进细菌生长的作用;50 mg/kg处理浓度在1 d后对细菌表现出明显的抑制作用,3 d后表现出明显促进细菌生长的作用(图1-A)。各处理浓度在1 d和3 d时有抑制真菌数量的作用,7 d和14 d时又表现为促进真菌增长的作用,30 d时恢复至对照水平,差异不显著(图1-B)。除20 mg/kg处理浓度在3 d和7 d时对放线菌有明显的促进作用外,其余处理浓度均对放线菌有显著的抑制作用,且随处理浓度增加抑制作用增大(图1-C)。
2.2 丁硫克百威对土壤酶活性的影响
不同处理浓度丁硫克百威对土壤蔗糖酶、脲酶、碱性磷酸酶和过氧化氢酶的影响如表1所示。2、8、20 mg/kg处理浓度在整个处理期间均表现出激活蔗糖酶的作用,蔗糖酶活性均高于对照;50 mg/kg处理浓度则表现出明显的抑制作用。4个处理浓度的丁硫克百威在1 d后对土壤脲酶活性有激活作用,3 d后均表现出明显的抑制作用,与对照相比差异性显著。在碱性磷酸酶方面,除2 mg/kg和8 mg/kg处理浓度在1 d后表现出明显激活作用外,其余时间均表现出显著的抑制作用,且抑制程度随丁硫克百威处理浓度的增加而增大,各处理浓度之间差异显著。丁硫克百威不同处理浓度对过氧化氢酶活性的影响,其中2 mg/kg浓度在1 d和3 d时抑制过氧化氢酶活性,在7 d和14 d时激活,30 d活性又低于对照水平,整体变化趋势为“抑制-促进-抑制”;8 mg/kg残留浓度在1 d后表现出激活过氧化氢酶活性,之后与20 mg/kg和50 mg/kg处理浓度一样,均表现为很强的抑制作用,且抑制作用随着处理浓度的增大而增强。endprint
2.3 丁硫克百威对微生物的影响
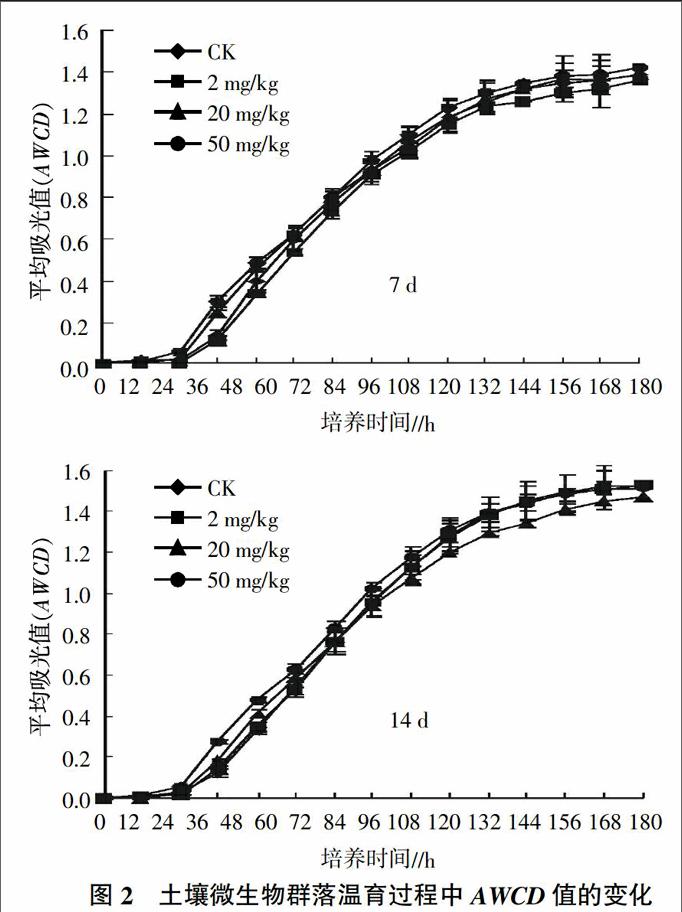
2.3.1 丁硫克百威对土壤微生物碳源利用的影响 丁硫克百威不同处理浓度对土壤不同培养时间下AWCD值的影响情况如图2所示。从图2可知,7 d后2 mg/kg处理浓度的土壤微生物AWCD值在整个培养时间(168 h)内均低于对照水平,表明该浓度处理会抑制土壤微生物对碳源的利用能力;20 mg/kg处理浓度的AWCD值与对照相比表现为先增高后降低最后持平的变化趋势,表明该处理浓度对土壤微生物整体活性表现为“促进-抑制-恢复”的变化趋势;50 mg/kg处理浓度AWCD值高于对照,表明该处理浓度可刺激土壤微生物的碳源利用强度。施药14 d后,2 mg/kg处理浓度的土壤微生物AWCD值恢复对照水平,说明随时间的延长该处理浓度对土壤微生物的抑制作用逐渐减弱,微生物功能多样性开始恢复;20 mg/kg处理浓度的土壤微生物AWCD值在培养60 h之前略高于对照水平,后期低于对照;50 mg/kg处理浓度的土壤微生物AWCD值在培养108 h之前高于对照,随后恢复至对照水平,说明随着处理时间的延长,高浓度丁硫克百威对微生物代谢活性的影响逐渐消退。
2.3.2 土壤微生物多样性指数分析 不同处理浓度丁硫克百威对土壤微生物Shannon、Simpson和McIntosh指数的影响见表2。由表2可知,在7 d后2 mg/kg和50 mg/kg 的Shannon指数值低于对照,土壤微生物群落的丰富度指数降低,14 d后Shannon指数恢复至对照水平;20 mg/kg处理的土壤微生物群落的丰富度指数在第7 d后增加,而在14 d后恢复至对照水平。各处理浓度对土壤微生物种群的Simpson指数影响较小,在7 d后和14 d后的各处理浓度组的Simpson指数基本与对照一致。各处理浓度对土壤微生物种群McIntosh指数有不同的影响,7 d 2 mg/kg处理的McIntosh指数低于对照,20 mg/kg的McIntosh指数高于对照;14 d 2 mg/kg和20 mg/kg处理浓度的McIntosh指数恢复至对照水平,无显著差异;50 mg/kg处理浓度在7 d和14 d的McIntosh指数均高于对照。
3 小结与讨论
不同浓度丁硫克百威处理土壤后,对土壤放线菌种群数量有明显的抑制作用;50 mg/kg处理浓度对细菌有强烈的刺激作用,促进其生长;对真菌表现为“抑制—促进—恢复”的变化趋势。由此可见,丁硫克百威对土壤中放线菌的影响较大,而对细菌和真菌的影响是暂时性的,对土壤肥力及健康造成的影响较小。不同浓度丁硫克百威处理土壤后,除50 mg/kg处理浓度对土壤蔗糖酶有很强的抑制作用外,其他浓度处理对蔗糖酶有一定的激活作用。各处理浓度对土壤脲酶、碱性磷酸酶和过氧化氢酶有一定的抑制作用。Biolog测定结果表明,不同处理浓度的丁硫克百威施入土壤后,导致土壤微生物群落多样性发生变化,变化趋势随培养时间而异,随着处理时间的延长,丁硫克百威对微生物代谢活性的影响逐渐消退。高浓度处理促进了微生物的活性,可能是刺激了土壤微生物将丁硫克百威作为碳源和能源利用,使得土壤微生物大量生长繁殖。
综上所述,不同浓度丁硫克百威施入土壤后,会对土壤微生物产生一定的影响,但是这种影响是暂时性的。采用丁硫克百威替代甲拌磷用于棉花及其他作物的拌种对土壤微生态较为安全。
参考文献:
[1] 侯宪文,李勤奋,邓 晓,等.高效液相色谱法分析丁硫克百威及其降解产物[J].农药,2009,48(9):654-655,657.
[2] 苏前富,李 红,张 伟,等.种衣剂中不同浓度杀虫剂成分对玉米苗期生长的安全性评价[J].植物保护,2011,37(1):161-163.
[3] 崔 勇,周惠中,杜 微,等.7%丁硫克百威·戊唑醇悬浮种衣剂配方[J].农药,2012,51(7):501-503,508.
[4] 王 娜,郎志飞,贺 康,等.河北邢台和江苏南京地区棉蚜对丁硫克百威和吡虫啉的抗性[J].中国农业科学,2013,46(16):3377-3383.
[5] 张小兵,王 凯,王 猛,等.山东省绿盲蝽田间种群对六种杀虫剂的敏感性监测[J]. 植物保护学报,2013,40(6):564-568.
[6] 彭振宝,赵思峰,危常州,等.残留甲拌磷对土壤微生物活性的影响[J].农药学学报,2010,12(2):207-213.
[7] TRIPATHI G,KACHHWAHA N,DABI I. Impact of phorate on malate dehydrogenases, lactate dehydrogenase and proteins of epigeic,anecic and endogeic earthworms[J]. Pesticide Biochemistry and Physiology,2009,95(2):100-105.
[8] 彭 达,张建萍,易正炳.50%丁硫克百威乳油等替代55%甲拌磷在棉花种衣剂防治苗期虫害效果初探[J].农业开发与装备,2014(7):83.
[9] 潘 波,方 佳,林 勇,等.丁硫克百威原药和制剂对蚯蚓的毒性及其降解产物克百威的动态变化[J].热带作物学报,2013, 34(11):2272-2277.
[10] 赵志强,侯宪文,李勤奋,等.毒死蜱和丁硫克百威对香蕉根际土壤酶活性的影响[J].农业环境科学学报2010,29(增刊):98-103.
[11] 李阜棣,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996.
[12] 关松荫,张德生,张志明.土壤酶及其研究法[M].北京:中国农业出版社,1986.
[13] 罗 倩,黄宝灵,唐治喜,等.新疆盐渍土3种植被类型土壤微生物碳源利用[J].应用与环境生物学报,2013,19(1):96-104.
[14] SCHUTTER M,DICK R. Shift in substrate utilization potential and strueture of soil microbial communities in response to carbon substrates[J]. Soil Biology and Biochemistry,2001,33(11):1481-1491.
[15] 张雯雯,徐 军,董丰收,等.苄嘧磺隆对水稻田土壤微生物群落功能多样性的影响[J].农业环境科学学报,2014,33(9):1749-1754.endprint
