棘托竹荪提取液对单增李斯特菌的抑菌机理初步研究
2015-11-07蓝蔚青潘迎捷孙晓红
蓝蔚青,曹 奕,陈 燕,潘迎捷,孙晓红
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
棘托竹荪提取液对单增李斯特菌的抑菌机理初步研究
蓝蔚青,曹奕,陈燕,潘迎捷,孙晓红*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
在细胞超微结构观察的基础上,采用实时荧光定量PCR技术初步分析棘托竹荪提取液对单增李斯特菌的抑菌机理。使用最小抑菌浓度(15.0mg/mL)的棘托竹荪提取液分别对单增李斯特菌菌液进行0.5、1.0、1.5h处理,提取对照组与处理组菌株的总RNA,通过反转录获得各自cDNA,并选择相关基因合成引物作Real-time PCR分析。以本菌的16S rRNA作为内参基因,以prfA、ActA、Iap为转录过程与表达蛋白基因,分析提取液对单增李斯特菌相关基因表达量的影响。由细胞超微结构观察可知,单增李斯特菌经提取液处理后,菌体细胞的细胞壁变薄,细胞膜的完整性发生改变,内容物从胞内释放出来。由荧光定量PCR法对不同处理时间下的相关基因相对表达量变化情况分析得出:处理组的prfA基因在0.5h时表达量有所上调,后期表达量上调速度减慢。1h后表达量基本停止上调,1.5h后,表达量转为下调,说明提取液能在转录阶段对单增李斯特菌的生命活动构成影响。ActA和Iap基因在处理0.5h后基因表达量上调,处理1h后上调量最大,ActA基因在1.5h后表达量上调量有所降低,Iap基因表达量出现下调,说明提取液能在转录水平上调控单增李斯特菌的生命活动,特别是多种毒力因子的表达过程。由此可知,棘托竹荪提取液能对单增李斯特菌细胞的转录过程和抗性产生显著影响,使菌体的细胞膜受损,细胞质溶出,从而导致菌体细胞死亡。
棘托竹荪提取液,单增李斯特菌,抑菌机理
棘托竹荪(Dictyophora echinovlvata)为鬼笔菌目鬼笔科竹荪属真菌,主要分布于云南、贵州、湖南、四川等地[1]。其子实体较小,菌盖近钟形,菌裙白色,菌柄较长,菌托白色或浅灰色,以7~8月为生长高峰期。棘托竹荪因其营养丰富、香味浓郁、滋味鲜美等特点,长期以来作为我国珍贵特产之一,其价等黄金。近年来,国内外少数学者先后围绕竹荪的抗氧化[2]、免疫调节[3]、降压降脂[4]、凝集保肝[5-6]、抑制癌细胞[7-8]等方面开展了部分研究工作,也对其抑菌活性进行了初步研究。其中檀东飞等[9-11]通过不同溶剂的竹荪子实体浸提实验,并采用水蒸气蒸馏法提取其挥发油,用牛津杯法测定了其抑菌活性。卢惠妮等[12]通过琼脂平板打孔法进行抑菌活性的测定,结果得出棘托竹荪提取液能在中性乃至偏碱性条件下保持其抑菌活性,但关于棘托竹荪抑菌机理方面的研究尚未开展。
单增生李斯特菌(Listeria monocytogenes)为食源性致病菌之一,在自然界和各类食品中经常被发现,具有高致病率的特点,且对外界环境具有很强的适应性[13],被WHO列为20世纪90年代主要食品致病菌,是21世纪对中国人卫生健康具有重大影响的12种病原微生物之一[14]。因此,采用合适的处理方式控制海产品中的致病菌,尤其是单增李斯特菌对于保证水产品的安全性具有重要的研究意义。目前,国内外已有相关学者对抑菌物质作用于菌体细胞的方式开展了相关方面的研究工作,在抑菌机理方面的表现主要有损伤细胞壁、改变细胞的透性、改变蛋白质和核酸分子、抑制酶的作用、作为抗代谢物与抑制核酸的合成等几种方式[15]。本文在扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察提取液对细菌形态和结构作用效果的基础上,通过实时荧光定量PCR法研究棘托竹荪提取液对单增李斯特菌生命活动相关基因表达变化的影响,初步评价棘托竹荪提取液对食源性致病菌的抑菌机理,以期为棘托竹荪的后期开发利用提供理论依据。
1 材料与方法
1.1材料与仪器
棘托竹荪子实体购自四川绵阳食用菌所,保存于干燥避光处;单增李斯特菌菌株编号:ATCC19115,购自中科院微生物研究所;胰蛋白胨大豆肉汤(TSB) 北京陆桥有限责任公司;TRIzol美国Invitrogen公司;酚:氯仿:异戊醇生工生物工程(上海)有限公司;异丙醇国药化学试剂有限公司;DRR047A反转录试剂盒日本TaKaRa株式会社;Super Real Pre-mix荧光定量试剂盒天根生化科技有限公司。
E-1010离子溅射装置、S3400N扫描电子显微镜、JEM2010型透射电子显微镜Hitachi日本株式会社;PCR仪、电泳仪美国Bio-Rad有限公司;5424离心机美国eppendorf公司;7500型Fast Real-Time PCR System美国Applied Biosystems公司;236HK高速冷冻离心机上海湘仪离心机仪器有限公司;超声波细胞粉碎机宁波新芝生物科技股份有限公司。
1.2实验方法
1.2.1棘托竹荪提取液采用超临界CO2萃取法(萃取压力20MPa,萃取温度35℃,萃取时间120min)获得棘托竹荪提取液,将其稀释至15.0mg/mL(采用微量肉汤稀释法结合平板涂布法确定其MIC,菌数保持在106CFU/mL,细菌生长受到明显抑制的提取液最低浓度为MIC,微量肉汤稀释法的MIC值为肉眼发现无明显浊度变化的提取液最低浓度[16]),保存于-20℃冰箱备用。
1.2.2单增李斯特菌的活化取甘油管保藏的单增李斯特菌菌株,TSB活化两次后用相应培养液进行稀释,使菌液浓度达106CFU/mL。
1.2.3细胞超微结构观察
1.2.3.1扫描电子显微镜(SEM)观察取活化好的菌液,加入15.0mg/mL竹荪提取液处理6h,以未作任何处理的菌液为对照组,两组样品同时进行处理。随后,分别转移至1.5mL离心管,4℃、7000r/min离心5min,弃上清,反复如上操作,多次离心获得菌体,菌体沉淀用磷酸缓冲液洗涤3次后,用戊二醛固定、清洗、锇酸固定12h,使用30%、50%、70%、90%的乙醇梯度脱水,将样品涂至金属箔片上,采用CO2临界点干燥法置换乙酸乙酯作临界点干燥固定、喷金,并置于扫描电镜观察。
1.2.3.2透射电子显微镜(TEM)观察样品前处理同上操作至戊二醛固定,取4℃预冷固定液1.5mL加入到每个离心管中,4℃固定10h以上,后续清洗、包埋、切片与制样工作由华东师范大学电镜中心协助完成。
1.2.4细菌相关基因表达量变化分析
1.2.4.1细菌总RNA提取参考邹晓蕾等[17]采用Trizol法进行细菌总RNA的提取。收集菌液,以未做任何处理的菌液为对照组,采用15.0mg/mL棘托竹荪提取液分别处理菌株0.5、1.0、1.5h。将处理组与对照组分别在4℃、12000r/min离心5min(沉淀加入3.0mg/mL的溶菌酶TE缓冲液100μL孵育10min),弃上清,加1.0mL Trizol,漩涡振荡器振荡15min,室温静置20min,加入0.2mL酚∶氯仿∶异戊醇(25∶24∶1),剧烈振荡15s,静置2min;4℃、12000r/min离心15min,获取上清液;加入等体积预冷的异丙醇,4℃、12000r/min离心10min,弃上清。液体混匀,-20℃静置20min;加入1.0mL、-20℃预冷的75%乙醇,洗涤沉淀。4℃,10000r/min离心5min,弃上清;晾干后加入30μL的焦磷酸二乙酯(DEPC)H2O溶解,分装8.0μL用于后续操作,放置于-20℃,其余RNA放置在-80℃冰箱,测定其RNA浓度与纯度。
1.2.4.2反转录将RNA浓度调至200ng/μL进行DNA去除及反转录,基因组DNA除去反应的配制体系为5×gDNA Eraser Buffer 2.0μL,gDNA Eraser 2.0μL,Total RNA 1.0μL,RNase Free dH2O 5.0μL,于PCR仪上进行DNA去除,随后进行反转录。向10.0μL反应液中依次加入RNase Free dH2O 5.0μL和5×PrimeScript Buffer 2(for Real Time)3.0μL,混匀后再添加RT Primer Mix 1.0μL、PrimeScript RT Enzyme Mix I 1.0μL,并于PCR仪上进行反转录反应(反应条件:37℃、15min,85℃、5s,之后温度维持在4℃),得到cDNA保存在-20℃冰箱中[17]。
1.2.4.3Real-Time PCR参照孙文烁等[18]选取20μL的反应体系进行Real-time PCR分析。其中,荧光染料10.0μL、正向引物(10μmol/L)1.5μL、反向引物(10μmol/L)1.5μL、cDNA模板2.0μL与RNase-free ddH2O 5.0μL,轻柔混匀并短暂离心。将反应体系置于荧光定量PCR仪中进行Real-Time PCR两步法反应,PCR反应条件为,第一阶段:95℃、15min;第二阶段:95℃、10s与60℃、32s,进行40个循环,所需引物序列如表1所示。
荧光定量PCR反应结果以2-△△Ct值作为衡量表达量变化情况的指标,其代表实验组目的基因的表达相对于对照组的变化倍数,使用这一方法便可直接得到目的基因相对于内参基因的量。若该值大于1,则说明特征基因表达量上调;若该值小于1,则说明特征基因表达量下调[22]。
1.2.4.4数据处理实验数据均采用3次平行实验的平均值,数据用软件origin(Pro)7.5绘图,数据间的差异通过统计软件SPSS 13.0中的Duncan新复极差法进行方差分析与多重比较,结果以平均值±标准偏差表示。
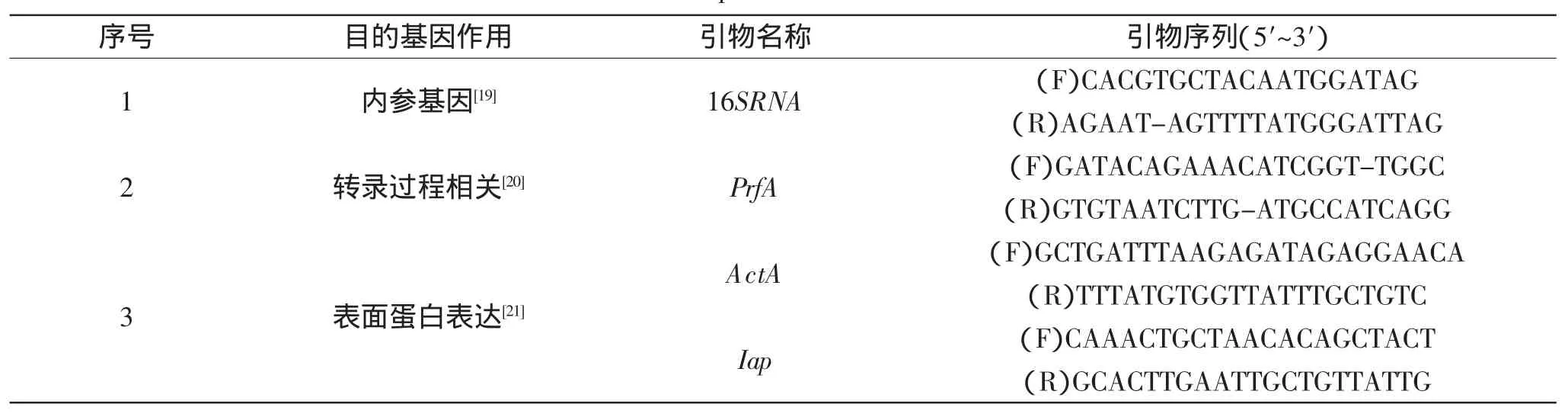
表1 Real-time PCR所需引物序列Table 1 Primers sequences used for Real-time PCR
2 结果与分析
2.1细胞超微结构观察结果
2.1.1扫描电子显微镜(SEM)观察结果从图1(a)中可以看到单增李斯特菌对照组的细菌细胞形态正常饱满,细胞膜结构完整;图1(b)中对照组的细胞正在进行分裂繁殖,轮廓清晰可见。由图1(c)可看出:经棘托竹荪提取液处理后,视野内残留的菌体细胞变少且不能维持细胞的原有形态;从图1(d)可见,处理后的菌体细胞形状变得松散,胞内物质发生泄漏。说明在该菌经MIC竹荪提取液处理后,已对其正常生长产生明显的抑制作用。
2.1.2透射电子显微镜(TEM)观察结果从图2(a)发现,同扫描电子显微镜对照组的情况一致,透射电镜视野下对照组的菌体细胞较多,形态完整,内容物充实,可明显看出细胞正进行分裂而形成的缢痕。从图2(b)中可以看到,经提取液处理后,细胞的细胞壁变薄,几乎观察不到完整的细胞膜,且有内容物从胞内渗透出来。

图1 单增李斯特菌扫描电子显微镜观察结果Fig.1 Scanning electron microscopy micrographs of Listeria monocytogenes
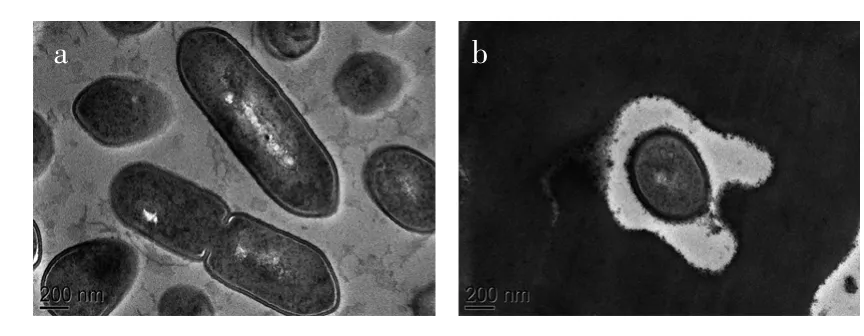
图2 单增李斯特菌透射电子显微镜观察结果Fig.2 Transmission electron microscopy micrographs of Listeria monocytogenes
2.2荧光定量PCR反应结果分析
prfA是单增李斯特菌中的重要基因之一,其所表达的转录激活因子能够激活细胞内多类毒力因子的表达[23],如ActA蛋白和Iap基因编码的p60蛋白,其表达量的上调表示单增李斯特菌细胞生命活动旺盛。单增李斯特菌的特征基因相对表达量变化结果如图3所示。
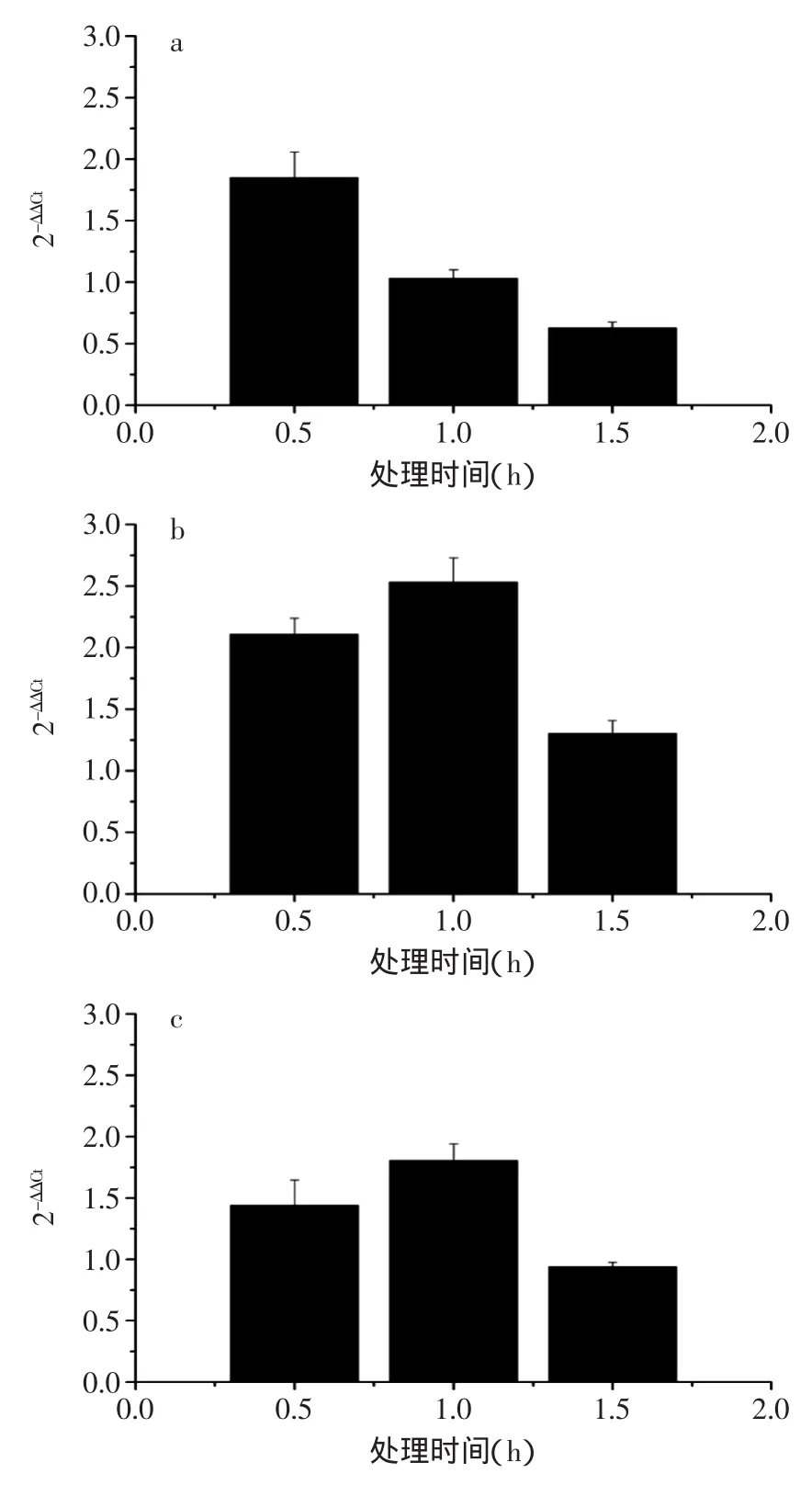
图3 单增李斯特菌相关基因相对表达量变化Fig.3 Relative expression levels of several related genes resistance of Listeria monocytogenes
从图3中可以看出,prfA基因在0.5h时表达量有所上调,随着处理时间延长,其表达量上调速度减慢。处理1h后表达量基本停止上调,处理1.5h后,其表达量转为下调。ActA基因在处理0.5h后较处理前基因表达量上调,处理1h后上调量达到最大,处理1.5h后表达量上调量有所降低。Iap基因在0.5h与1h的基因表达量变化与ActA基因基本相似,但在1.5h后表达量呈下调趋势。可见,单增李斯特菌经棘托竹荪提取液处理后,已对菌体的基因表达产生影响,对其生长产生抑制。而表达量的下调则说明竹荪提取液能通过在转录水平上调控单增李斯特菌的生命活动,抑制菌体的活性。但竹荪提取液的作用发挥仍需一段时间,因此才会出现prfA表达量在0.5h时仍处于上调的现象。
3 结论
通过进行细胞超微结构观察结果显示,提取液处理后,视野内残留的菌体细胞已经很少,不能维持细胞的原有形态,菌体细胞形状变得松散,细胞的细胞壁变薄,几乎观察不到完整的细胞膜,胞内物质泄漏。说明在该菌经MIC竹荪提取液处理后,已对其正常生长产生明显的抑制作用。单增李斯特菌经棘托竹荪提取液处理后,prfA基因表达量的上调速度逐渐减慢,在1h后由上调转为下调,说明提取液对其基因表达产生影响,对其正常生长产生抑制作用。而在其表达量转为下调后,ActA和Iap基因表达量的上调速度也迅速下降,说明竹荪提取液能够通过在转录水平上调控单增李斯特菌的生命活动,特别是多种毒力因子的表达过程。然而,竹荪提取液从处理到开始发挥作用,需要一段时间,细胞可能会对其产生一定抗性,从而使prfA表达量在0.5h时处于上调阶段。
由实验可知,棘托竹荪提取液对单增李斯特菌细菌转录水平和能量代谢的影响尤为明显,对细胞膜的破坏能力也较强。其特性与同为植物源天然产物的乌梅提取液[24]、蓝莓提取物[25]较为类似,这也可在一定程度上说明了植物源天然产物的抑菌作用机制基本相同。课题组还将在后期进一步开展研究工作,以深入探究棘托竹荪提取液对食源性致病菌的抑菌机理。
[1]刘振祥,张胜.食用菌栽培技术[M].北京:化学工业出版社,2007:122-127.
[2]江玉姬,王宏雨,谢宝贵,等.食用菌的抗氧化活性及竹荪抗氧化物质提取工艺的优化[J].热带作物学报,2011,32(1):76-78.
[3]MalaguarneraL,FerlitoL,LmbesiRM, etal. Immunosenescence:a review[J].Archives of Gerontology and Geriatrics,2001,32(1):1-14.
[4]林海红,林浪.长裙竹荪对大鼠血脂的影响[J].福建农业大学学报,2000,29(2):238-241.
[5]林玉满,苏爱华.棘托竹荪凝集素的纯化及其生化特性[J].植物资源与环境学报,2004,13(3):1-6.
[6]蔡美珠,唐礡.竹荪托盖液对小鼠肝、肾功能的影响[J].医学理论与实践,2004,17(5):497-498.
[7]杜昱光,白雪芳,卜宗式,等.竹荪深层发酵菌丝体对小鼠免疫功能的影响及其抗肿瘤活性的影响[J].中国食用菌,1998,17(5):25-26.
[8]N Kodama,K Komuta,H Nanba.Effects of maitake(Grifola frondosa)D-fraction on the activation of NK cells in cancer patients[J].Journal of Medicinal Food,2003,6(4):371-377.
[9]檀东飞,黄儒珠,卢真,等.棘托竹荪菌托的化学成分及抑菌活性研究(I)[J].菌物学报,2006,25(4):603-610.
[10]檀东飞,黄儒珠,卢真,等.棘托竹荪菌盖的化学成分及抑菌作用研究(II)[J].微生物学杂志,2007,27(6):8-12.
[11]檀东飞,黄儒珠,卢真,等.棘托竹荪子实体鲜品的化学成分及抑菌活性研究[J].福建师范大学学报:自然科学版,2010,26(2):100-105.
[12]卢惠妮,潘迎捷,孙晓红,等.棘托竹荪子实体抑菌活性的研究[J].食品科学,2009,30(15):120-123.
[13]Vazquez-Boland JA,Kuhn M,Berche P,et al.Listeriapathogenesis and molecular virulence determinants[J].Clinical Microbiology Reviews,2001,14(3):584-640.
[14]孙会芳.单核细胞增生性李斯特杆菌单克隆抗体的制备[D].兰州:西北民族大学,2007.
[15]小佩尔扎MJ,里德RD,詹ECS.微生物学[M].武汉大学生物系微生物教研室译.北京:科学出版社,1987:359-361.
[16]曹奕,孙晓红,陈燕,等.微量肉汤稀释法测定长裙竹荪多种提取液对食品中常见细菌的抑制效果[J].食品工业科技,2013(1):16-20.
[17]邹晓蕾,刘礼崔,罗立新.细菌总RNA提取方法的比较[J].现代食品科技,2013,30(7):1948-1954.
[18]孙文烁,靳梦曈,王敬敬,等.运用Real time PCR建立即食虾中副溶血性弧菌分子预测模型[J].现代食品科技,2014,30(7):142-148.
[19]Maria A O,Eliana G R,Alzira M B,et al.Quantification of Listeria monocytogenes in minimally processed leafy vegetables using a combined method based on enrichment and 16SrRNA real-time PCR[J].Food Microbiology,2010(27):19-23.
[20]Peter R,Martina K,Martin W,et al.Detection of Listeria monocytogenes in food using a combined enrichment/real-time PCR method targeting the prfA gene[J].Research in Microbiology,2006(157):763-771.
[21]Xiaohui Z,Xinan J.Polymerase chain reaction detection of Listeria monocytogenes using oligonucleotide primers targeting actA gene[J].Food Control,2005(16):125-130.
[22]Kim B R,Nam H Y,Kim S U,et al.Normalization of reverse transcription quantitative-PCR with housekeeping genes in rice[J].Biotechnology Letters,2003,25(21):1869-1872.
[23]王海艳,刘中学,石新华,等.单增李斯特菌及其表面蛋白的研究进展[J].检验检疫科学,2006,16(2):76-80.
[24]耿飞,王伟,周涛.乌梅提取液对李斯特菌的抑菌机理[J].食品科学,2012,32(15):88-93.
[25]谢庆超.蓝莓提取物的抑菌效果及其抑制副溶血性弧菌机理的研究[D].上海:上海海洋大学,2012.
Preliminary research on the antimicrobial mechanism of Dictyophora echinovolvata extracts against Listeria monocytogenes
LAN Wei-qing,CAO Yi,CHEN Yan,PAN Ying-jie,SUN Xiao-hong*
(College of Food Science and Technology Shanghai Ocean University,Shanghai Engineering Research Center of Aquatic Product Processing and Preservation,Shanghai 201306,China)
Based on the observation of cell ultrastructure,the method of real-time fluorescent quantitative PCR was used to evaluate the antimicrobial mechanism of Dictyophora echinovolvata extracts against Listeria monocytogenes.The strain was treated with 15.0mg/mL(minimum inhibitory concentration,MIC)of Dictyophora echinovolvata extracts under 0.5,1.0 and 1.5h.Total RNA of the control and treated group strains were extracted,cDNA were obtained by reverse transcription and the relevant gene primers were selected for Real-time PCR method respectively.The strains of 16S rRNA as reference gene,prfA,ActA and Iap as feature genes.It was showed that the cell wall become thinner,the integrity of cell membrane was changed and the contents released from intracellular when treated with Dictyophora echinovolvata extracts by the ultrastructure of cell observations.Compared with the control group,the level of gene expression in prfA was up-regulated at 0.5h,the speed of up-regulated became slower at 1h,the trend of up-regulation stopped at 1.5h with the prolong of treatment time,which proved that extracts could affect the activities of Listeria monocytogenes in transcription. While the level of gene expression in ActA and Iap were up-regulated in 0.5h,the amount of up-regulated expression was increased fast at 1h.The level of gene expression in ActA was decreased at 1.5h and that in Iap was down-regulated,which showed that extracts could regulate the level of transcription in Listeria monocytogenes,especially on the expression of virulence factors.Dictyophora echinovolvata extracts had a significant impact on Listeria monocytogenes for the process of transcription and the resistant of bacteria,which could make the damage of cell membrane and the dissolution of cytoplasm leading to the death of cell.
Dictyophora echinovolvata extracts;Listeria monocytogenes;antibacterial mechanism
TS201.1
A
1002-0306(2015)14-0152-05
10.13386/j.issn1002-0306.2015.14.023
2014-12-01
蓝蔚青(1977-),男,博士,高级工程师,研究方向:水产品低温保鲜技术研究。
孙晓红(1978-),女,博士,副教授,研究方向:天然产物研究与开发。
上海市教育委员会科研创新项目(11YZ159);上海市科技兴农重点攻关项目(沪农科攻字(2015)第4-12号);上海海洋大学科技发展专项基金(A2-0209-15-200061)。
