HPLC-RI法测定食用酵母的海藻糖含量
2015-11-07邬晓勇刘坤平彭灵犀苟小军
何 钢,刘 嵬,邬晓勇,刘坤平,梁 立,彭灵犀,戴 欣,颜 军,苟小军
(成都大学药食同源植物资源开发高校重点实验室,四川成都610106)
HPLC-RI法测定食用酵母的海藻糖含量
何钢,刘嵬,邬晓勇,刘坤平,梁立,彭灵犀,戴欣,颜军,苟小军*
(成都大学药食同源植物资源开发高校重点实验室,四川成都610106)
目的:建立酵母海藻糖的提取方法,并比较啤酒酵母、葡萄酒酵母、高活性酵母、酿酒高活性酵母的海藻糖含量。方法:酵母菌体经液氮研磨后以乙醇-水溶液为溶媒,通过超声波辅助的方法提取海藻糖,采用HPLC法分析海藻糖含量。以酿酒高活性酵母为例,在单因素实验基础上通过正交实验优化酵母菌海藻糖的提取工艺,并比较4株食用酵母菌海藻糖的含量。结果:酵母菌细胞海藻糖提取的最优工艺条件为:在80℃的条件下,乙醇浓度为50%,料液比1∶15(g∶mL),提取时间70min,海藻糖得率达(68.10±0.7)mg/g,四株食用酵母菌海藻糖含量大小次序为:酿酒高活性酵母>高活性酵母>葡萄酒酵母>啤酒酵母。结论:优化的酵母海藻糖提取的工艺简单,得率高;方法学分析显示HPLCRI分析海藻糖含量方法准确,重现性好,方便快捷;不同生产用途的酵母菌株海藻糖含量存在差异。
高效液相色谱,食用酵母,海藻糖,含量
海藻糖(Trehalose)由2个葡萄糖单元通过α,α-1,1糖苷键链接而成的非还原性双糖,广泛存在于藻类、细菌、真菌、低等植物、昆虫和其他无脊椎动物中。海藻糖化学性质稳定,易溶于水和热醇,具有非特异性保护、抗辐射、保湿、防腐等特性[1]。海藻糖主要存在于酵母细胞的子囊孢子和细胞质中,因此提取时需要进行细胞破碎让海藻糖溶出。酵母海藻糖的抽提溶剂包括三氯乙酸、乙醇、水等。酵母菌提取液的组分复杂,溶液中的海藻糖含量分析方法主要有纸层析、薄层层析[2]、离子色谱法[3]、气相色谱[4]、高效液相色谱[5-6]、蒽酮比色[7]、酶分析[8]等方法。其中纸层析、薄层层析、蒽酮-硫酸法分析灵敏度较低,操作繁琐,杂质干扰较大,准确度和重现性较差以至于不能准确定量。气相色谱法需要衍生化后进行分析,操作繁琐。酶分析法成本较高,操作复杂。高效液相色谱示差折光法(HPLC-RI)可以通过优化色谱条件将海藻糖和杂质分开,具有快速、准确定性和定量分析的特点。酵母菌在不同的胁迫条件下其海藻糖的积累量会迅速上升,如高压处理、外加乙醇处理、热休克处理、短时饥饿处理。文献[1,7]报道酵母菌体的海藻糖含量存在差异,这与分析方法,酵母培养方法以及是否受到环境胁迫等原因相关。然而酵母正常生长条件下的海藻糖含量以及酵母菌种间海藻糖含量差异报道较少。本文将四株食用酵母菌进行液体培养,收集菌体、优化抽提海藻糖工艺并分析其含量,实验结果为采用HPLC-RI检测筛选海藻糖高产菌株提供参考,也有助于解释酵母菌种间差异和生产用途差异。
1 材料与方法
1.1材料与仪器
酿酒高活性酵母菌、高活性酵母菌、葡萄酒酵母菌购买于安琪酵母公司,经划线分离保藏于成都大学药食同源植物资源重点实验室;啤酒酵母菌由万萍副教授提供的金威啤酒原麦汁中分离纯化得到,经鉴定后,保藏于成都大学药食同源植物资源重点实验室;海藻糖Sigma公司购买;乙腈色谱纯;无水乙醇成都市科龙化工试剂厂;其他试剂均为分析纯。
L-2000型高效液相色谱仪、L-2490型示差折光检测器日本Hitachi公司;RE-2000型旋转蒸发仪上海亚荣生化仪器厂;CT15RT型冷冻离心机上海天美仪器公司;BS110S型分析天平上海赛多利斯公司;LDZX-75KBS型立式压力蒸汽灭菌锅上海申安医疗器械厂;SHZ-82型水浴恒温振荡器江苏金坛实验仪器厂;KQ-400KDE型超声清洗器昆山市超声仪器有限公司。
1.2实验方法
1.2.1色谱条件根据文献[9-10]中的方法选择Sugar-D色谱柱(4.6mm×250mm i.d.,5μm),流动相为乙腈-纯水混合体系(乙腈∶纯水为80∶20、78∶22、76∶24、74∶26),流速1mL/min,进样量20μL,柱温35℃,示差折光检测器(RI)检测。
1.2.2标准曲线的绘制精密称取烘干至恒重的海藻糖标准品50.0mg,于10.0mL的容量瓶中,用超纯水溶解并定容至10.0mL,配制成5mg/mL的储备液,按浓度减半逐级稀释成5个浓度梯度,并进行色谱分析,以峰面积为纵坐标,海藻糖的浓度为横坐标绘制标准曲线。
1.2.3酵母细胞样品制备四株酵母菌采用YPD液体培养基培养3d,发酵液6000r/min离心10min获得酵母菌体,菌体经蒸馏水反复洗涤,吸水纸吸干菌体水分后液氮充分研磨酵母细胞备用。
1.2.4单因素筛选酵母海藻糖提取条件预实验结果表明酿酒高活性酵母海藻糖含量较高,以其为材料对提取温度、乙醇浓度、提取时间、料液比进行优化,确定海藻糖提取的最佳条件,得率(mg/g)=提取的海藻糖总质量/鲜酵母样品质量,各组数据以±sD表示。
1.2.4.1提取温度称取15份1.0g鲜酵母样品,乙醇浓度为50%,提取时间40min,料液比1∶10,提取温度分别为40、50、60、70、80℃条件下超声(200W)提取海藻糖,将提取液以12000r/min的速度离心10min,收集上清液,各取2mL上清液经0.45μm微孔滤膜过滤,滤液按照“1.2.1”的色谱条件分析海藻糖的得率,每个温度梯度重复3次。
1.2.4.2乙醇浓度称取15份1.0g鲜酵母样品,在选择的最佳温度条件下,乙醇浓度为30%、40%、50%、60%、70%,提取时间40min,料液比1∶10,超声(200W)提取海藻糖,后续处理及分析同上。每个乙醇浓度梯度重复3次。
1.2.4.3提取时间称取15份1.0g鲜酵母样品,料液比1∶10,提取时间40、50、60、70、80min,在最佳提取温度和乙醇浓度条件下分别超声(200W)提取海藻糖,后续处理及分析同上,每个时间梯度重复3次。
1.2.4.4提取料液比称取15份1.0g鲜酵母样品,料液比1∶5、1∶10、1∶15、1∶20、1∶25,在选择的最佳温度、乙醇浓度、提取时间条件下超声(200W)提取海藻糖,后续处理及分析同上,每个料液比梯度重复3次。
1.2.5正交实验在单因素实验的基础上设计L9(34)正交实验对提取工艺进行优化,因素水平表见表1。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experimental design
1.2.6四株酵母海藻糖含量分析分别称取制备的鲜酵母细胞样品各3份,每份10.0g,按照“1.2.5”优化的提取工艺条件制备海藻糖供试样品溶液,样品溶液经0.45μm微孔滤膜过滤,滤液进行色谱分析。将供试样品对应海藻糖的峰面积代入回归方程计算样品中海藻糖含量。
2 结果及分析
2.1色谱条件的选择

图1 海藻糖标准品色谱图Fig.1 HPLC chromatogram of trehalose standard
海藻糖样品溶液分析时考察了流动相组成(乙腈∶纯水)的比例,结果表明乙腈∶纯水为78∶22时,分离效果最好。分别取标准品溶液和四株酵母菌海藻糖供试品溶液进样分析结果如图1、图2所示。从图1~图2中可见,海藻糖和其他峰能完全分离(分离度>1.5)。

图2 食用酵母菌提取液中海藻糖色谱图Fig.2 HPLC chromatogram of trehalose from extraction of edible yeast
2.2标准曲线的建立
按“1.2.2”精密量取海藻糖标准品储备溶液,用纯水稀释成质量浓度分别为5、2.5、1.25、0.625、0.3125mg/mL的工作液进行色谱分析。以峰面积(Y)对质量浓度(X,mg/mL)进行线性回归。结果表明:海藻糖在所测定的浓度范围内线性关系良好,其回归方程为Y=1064458.74X+9866.00(R2=0.9997)。

图3 海藻糖标准曲线Fig.3 Standard curve of trehalose
2.3海藻糖提取条件优化
2.3.1提取温度对海藻糖提取的影响温度是一个重要因素,升高温度有助于溶胀的细胞壁的崩解,内容物的溢出。由图4可以看出随着提取温度的升高,海藻糖的得率也随之增加,温度从40~70℃时,海藻糖的得率呈增加趋势,得率达到(31.11±1.28)mg/g,80℃提取时,乙醇挥发量增加,海藻糖得率略有降低,因此选取70℃进行后续条件筛选。

图4 提取温度对海藻糖得率的影响Fig.4 Effect of temperature on yield of trehalose
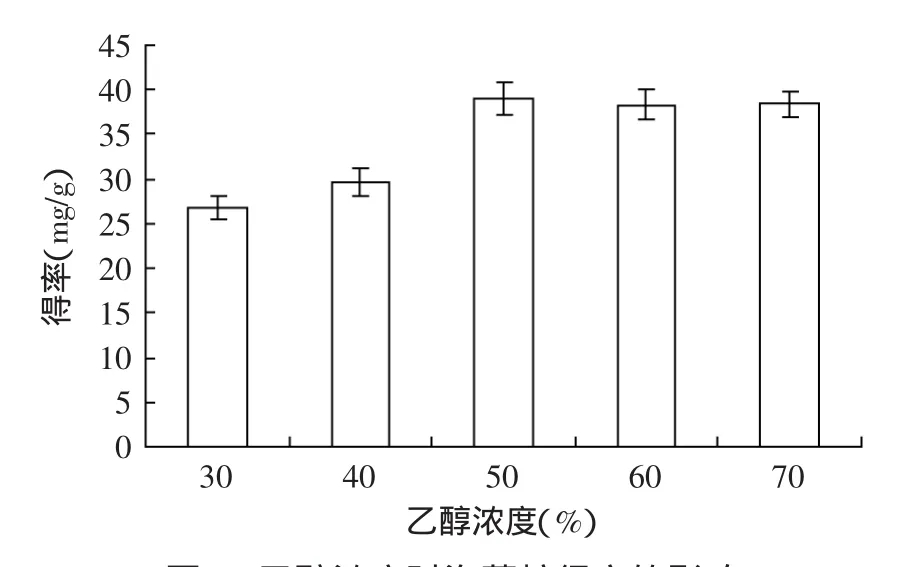
图5 乙醇浓度对海藻糖得率的影响Fig.5 Effect of concentration of ethanol on yield of trehalose
2.3.2乙醇浓度对海藻糖得率的影响海藻糖能够溶于水和热乙醇溶液中,乙醇能够沉淀酵母细胞溶出的蛋白、核酸和多糖,有利于后续的分析。图5结果表明随着乙醇浓度增加得率随之增高,当浓度为50%时得率达到(39.05±1.8)mg/g,乙醇浓度进一步增加时,得率没有明显增加,选择50%乙醇浓度进行后续实验。
2.3.3提取时间对海藻糖提取的影响图6表明提取时间为40~70min时,海藻糖得率呈增加的趋势,提取时间为70min时,海藻糖的得率达到(44.08±1.28)mg/g,提取时间为80min时得率为(43.88±2.6)mg/g未呈现明显增加趋势,随着提取时间的延长乙醇挥发量增加,从经济成本和时间考虑,提取最佳时间为70min。

图6 提取时间对海藻糖得率的影响Fig.6 Effect of extraction time on yield of trehalose
2.3.4料液比对海藻糖提取的影响料液比的选择要考虑提取物的得率,同时也要考虑提取液的后续处理成本。由图7可以看出随着料液比的增加,海藻糖的得率也随之增加,当料液比为1∶15时得率达到(37.47±1.33)mg/g,而料液比为1∶20时得率为(36.09± 2.08)mg/g,得率呈降低趋势,考虑提取液的后续处理方便,最佳料液比选取1∶15进行海藻糖的提取。

图7 料液比对海藻糖得率的影响Fig.7 Effect of rate of material to water on yield of trehalose
2.3.5正交实验优化提取工艺分别取各单因素中最优的3水平,采用L9(34)进行正交实验优化提取工艺,实验结果见表2。
由方差分析结果可知影响海藻糖得率影响的大小顺序为:料液比>乙醇浓度>提取时间>提取温度,即D>B>C>A。综合各因素,最优的提取工艺为:A3B2C2D3,即提取温度为80℃,乙醇浓度为50%,提取时间70min,料液比1∶15,在该最佳条件下对工艺进行验证,重复3组,海藻糖的得率为(68.10±0.7)mg/g。
2.4方法学考察
2.4.1精密度实验取同一海藻糖标准品溶液,连续进样6次,测定海藻糖峰面积。峰面积的RSD值为2.67%,表明精密度良好。

表2 正交实验结果Table 2 Results of orthogonal experimental design
2.4.2重复性实验准确称取6份酵母样品,按“2.3.5”筛选的条件制备6份供试样品溶液,进行色谱分析,记录峰面积,峰面积的RSD值为3.4%,表明重复性良好。
2.4.3稳定性实验取同一海藻糖提取样品溶液,每隔2h进样1次,0~10h内测定6次并记录峰面积。结果峰面积的RSD值为4.16%,表明海藻糖提取样品溶液在10h内稳定性良好。
2.4.4加样回收率精密称取1.0g酿酒酵母样品9份,分别加入海藻糖标准品储备液12、15、18mL,按最佳提取方法制备供试样品溶液各3份,分析海藻糖含量并计算加样回收率。不同加样量的平均回收率分别为104.1%、103.5%、99.3%,RSD值分别为2.3%、2.6%、2.7%,表明该方法的准确度较高,可以作为酵母菌海藻糖含量检测。
2.5四株食用酵母中海藻糖的含量分析结果
各酵母样品按“2.3.5”筛选的条件制备海藻糖供试样品溶液进行色谱分析,将峰面积A代入回归方程计算供试样品溶液中海藻糖浓度。经计算啤酒酵母海藻糖含量(22.33±1.21)mg/g,葡萄酒酵母海藻糖含量(36.79±1.54)mg/g,高活性酵母海藻糖含量(41.90±1.32)mg/g,酿酒高活性酵母海藻糖含量(69.11±1.27)mg/g。则四种食用酵母通过液体培养获得的菌体中海藻糖含量高低次序是酿酒高活性酵母>高活性酵母>葡萄酒酵母>啤酒酵母。
3 结论
在单因素实验的基础上利用正交实验优化酵母海藻糖的提取工艺,该工艺简单,得率高;并借助高效液相色谱-示差折光检测(HPLC-RI)技术,建立了酵母海藻糖的定量方法,同其他的检测方法相比,该方法准确,重现性好,方便快捷,为海藻糖高产菌株的筛选提供参考。同时本研究比较了相同培养条件下的四种酵母菌海藻糖的含量,研究结果表明海藻糖含量存在明显的差异,进一步佐证了酵母菌种间差异,种间生境差异以及生产用途差异。
[1]韩少卿,彭奇均.HPLC法测定酵母中海藻糖[J].中国食品添加剂,2005(2):107-109.
[2]缪静.海藻糖分析方法的研究[J].微生物学通报,2004,31(5):96-100.
[3]许丽,周光明,余娜,等.离子色谱法测定化妆品中的海藻糖[J].日用化学工业,2012,42(1):76-78.
[4]赵华,何聪芬,秦允荣,等.气相色谱检测芦荟中海藻糖方法的建立[J].吉首大学学报,2009,30(1):79-83.
[5]魏泱,丁明玉.液相色谱/蒸发光散射测定转基因烟草提取液中的海藻糖[J].色谱,2001,19(3):226-229.
[6]荣绍丰,张海平,段作营,等.HPLC/RI与HPLC/ESI-MS方法研究细菌D-97酶合成海藻糖的过程[J].色谱,2002,20(3):197-201.
[7]朴春红,刘仁杰,王丹,等.酵母体内海藻糖定量方法研究[J].食品科技,2010,35(6):284-286.
[8]王子辉,楚杰,王君高,等.酶电极法测定海藻糖含量[J].食品工业科技,2010(11):366-368.
[9]唐远谋,何钢,刘嵬,等.高效液相色谱法测定卷柏中海藻糖[J].食品科技,2014,39(4):264-266.
[10]王成君,林建平,岑沛霖.高效液相色谱法快速检测海藻糖[J].江南大学学报,2005,4(5):522-525.
Determination of trehalose content of edible yeast by HPLC-RI
HE Gang,LIU Wei,WU Xiao-yong,LIU Kun-ping,LIANG Li,PENG Ling-xi,DAI Xin,YAN Jun,GOU Xiao-jun*
(Key Laboratory of Medicinal and Edible Plants Resources Development of Sichuan Education Department,Chengdu University,Chengdu 610106,China)
Objective:To establish a method of trehalose extraction from yeast,and compare trehalose content from beer yeast(Saccharomyces cerevisiae),Saccharomyces ellipsoideus,high-activity dry yeast(Saccharomyces cerevisiae),high-activity Saccharomyces cerevisiae.Methods:Yeast was grinded firstly in liquid nitrogen,and then of extracted trehalose with ethanol-water solution by ultrasonic assisted,trehalose content was analysed by high performance liquid chromatography(HPLC-RI).Saccharomyces cerevisiae as a material,extraction conditions of trehalose was optimized by orthogonal experiment based on single factor experiment.The content of trehalose from four edible yeast strains was compared.Results:The results showed that the optimal method for extraction of trehalose were as follows:extraction temperature 80℃,ethanol concentration 50%,ratio of material to water 1∶15(g∶mL),extraction time 70min,then the yield of trehalose was(68.10±0.7)mg/g.The order of trehalose content of four edible strains was Saccharomyces cerevisiae>high-activity dry yeast(Saccharomyces cerevisiae)>Saccharomyces ellipsoideus>beer yeast(Saccharomyces cerevisiae).Conclusion:Optimization of yeast trehalose extraction process was simple,high extraction efficiency.Methodology investigation results showed that analysis the content of trehalose by HPLC-RI was accurate,repeatability,convenient and quick. The content of trehalose from the yeast strains different production uses was different.
HPLC;edible yeast;trehalose;content
TS207.3
A
1002-0306(2015)14-0049-05
10.13386/j.issn1002-0306.2015.14.001
2014-09-26
何钢(1982-),男,博士,讲师,研究方向:糖生物化学。
苟小军(1974-),男,博士,教授,研究方向:糖生物化学。
四川省杰出青年学术技术带头人培育计划(2012JQ0044);四川省教育厅项目(14ZB0374);成都大学大学生创新性实验计划项目(CDU_CX_201101034)。
