响应面法优化腺苷脱氨酶法快速检测发酵液中的腺苷含量
2015-11-07董会娜张大伟孙玉梅
祖 昕,董会娜,李 宁,3,张大伟,*,孙玉梅
(1.大连工业大学生物工程学院,辽宁大连116034;2.中国科学院天津工业生物技术研究所,天津300308;3.兰州大学基础医学院,甘肃兰州730000)
响应面法优化腺苷脱氨酶法快速检测发酵液中的腺苷含量
祖昕1,2,董会娜2,李宁2,3,张大伟2,*,孙玉梅1,*
(1.大连工业大学生物工程学院,辽宁大连116034;2.中国科学院天津工业生物技术研究所,天津300308;3.兰州大学基础医学院,甘肃兰州730000)
通过腺苷脱氨酶(ADA)与靛酚蓝方法结合建立一种高通量快速检测腺苷的新方法。通过单因素、响应面方法优化氢氧化钠、水杨酸、亚硝基铁氰化钠和次氯酸钠的用量,并进行了验证,以最优试剂用量建立腺苷的标准曲线。确定了检测腺苷的最优试剂用量氢氧化钠25.85g/L、水杨酸68.05g/L、亚硝基铁氰化钠2.19g/L和次氯酸钠40.9mL/L,该方法线性范围为0.01~10mmol/L,加标回收率在95.5%~103.8%之间,RSD精准度在0.9%~3.3%之间。本方法与HPLC法检测发酵液中的腺苷含量结果一致。本方法可以用来快速、高通量的检测发酵液中的腺苷含量。
腺苷,腺苷脱氨酶,高通量筛选,响应面
腺苷又称腺嘌呤核苷,是酶反应和细胞修复所需辅助因子的重要组成部分,在神经传递中起着重要的作用[1-2]。由于腺苷具有减慢心律、增强心肌对缺血的耐受力等保护心脏的功能,现已被广泛的应用在医疗和保健食品领域[3-5]。同时,腺苷还是合成多种药用核苷类物质的医药中间体,目前已成功的合成腺苷酸、三磷酸腺苷等药用物质以及嘌呤霉素、s-腺苷蛋氨酸等核苷类抗菌素[6]。微生物发酵法生产核苷类物质始于1968年,小西八真[7]第一次成功的以枯草芽孢杆菌异亮氨酸缺陷型发酵法生产鸟苷。发酵法主要是以枯草芽孢杆菌为出发菌株,经诱变筛选出黄嘌呤缺陷、抗嘌呤结构类似物等表型,从而得到腺苷的高产菌株[8-9]。
在微生物代谢过程中,腺苷作为产物会被释放到培养基中,为了验证微生物生产腺苷的能力,需要测定培养基中腺苷的含量。目前腺苷测定的常用方法主要包括纸层析法和高效液相色谱法(HPLC)。纸层析法检测腺苷精度不高,而且所用的有机溶剂如丙酮等,具有一定的挥发性和毒性。HPLC法虽然检测结果精准可靠,可用于检测微量腺苷,但是仪器成本过高,检测时间较长,不适用于快速、高通量的检测。另外,还有基于腺苷与其适体特异性识别和腺苷适体偶联金纳米粒子自组装导致共振光散射信号放大建立的腺苷检测新方法,但仍处于实验室研究阶段。本研究将腺苷脱氨酶(ADA)和靛酚蓝方法结合建立一种新的、快速检测腺苷的方法。ADA水解腺苷生成铵,在亚硝基铁氰化钠的作用下铵可以与水杨酸、次氯酸离子在碱性条件下反应生成水溶性蓝色化合物,通过该化合物颜色的变化可以对腺苷浓度进行检测[10-11]。本方法操作简便、快速,可节省大量的人力物力,同时可用于快速检测发酵液中的腺苷产量及进行腺苷高产菌株的高通量筛选。
1 材料与方法
1.1材料与仪器
枯草芽孢杆菌(Bacillus subtilis)ZX05中国科学院天津工业生物技术研究所保藏;LB固体培养基自制;M9培养基(不含硫酸铵,含2g/L尿素) 自制;0.01mol/L PBS缓冲液自制;试剂A25.85g/L氢氧化钠,68.05g/L水杨酸,2.19g/L亚硝基铁氰化钠;试剂B40.9mL/L次氯酸钠;腺苷(Adenosine)标准品Sigma公司;腺苷脱氨酶(ADA) 上海金穗生物科技有限公司;氢氧化钠、水杨酸、亚硝基铁氰化钠、次氯酸钠(含5%活性氯)、氯化铵均为分析纯;乙腈HPLC级。
Spectramax M5连续多波长多功能读板机Molecular Devices公司;1260 series高效液相色谱仪Agilent公司。
1.2实验方法
1.2.1菌种活化取-80℃保藏的菌种划线接种于LB固体培养基,37℃培养箱恒温静置培养14~16h。
1.2.2种子培养挑取LB固体培养基上的一个单菌落接于装有50mL LB培养基的250mL锥形瓶中,37℃,200r/min,培养12h。
1.2.3摇瓶发酵取0.5mL的种子液接于装有50mL M9培养基的250mL锥形瓶中,37℃,200r/min,培养48h。
1.2.4腺苷检测试剂的单因素优化
1.2.4.1氢氧化钠对显色反应的影响取25μL 10mmol/L的氯化铵溶液,加入50μL终浓度为17.5、20、22.5、25、30g/L氢氧化钠溶液、50μL 62g/L水杨酸溶液、50μL 2g/L亚硝基铁氰化钠溶液和50μL 60mL/L次氯酸钠溶液,37℃恒温箱温浴30min。以超纯水为参比,测定OD696的变化情况,每个浓度重复3次。
1.2.4.2水杨酸对显色反应的影响取25μL 10mmol/L的氯化铵溶液,加入50μL 25g/L氢氧化钠溶液、50μL终浓度为5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85g/L水杨酸溶液、50μL 2g/L亚硝基铁氰化钠溶液和50μL 60mL/L次氯酸钠溶液,37℃恒温箱温浴30min。以超纯水为参比,测定OD696的变化情况,每个浓度重复3次。
1.2.4.3亚硝基铁氰化钠对显色反应的影响取25μL 10mmol/L的氯化铵溶液,加入50μL 25g/L氢氧化钠溶液、50μL 65g/L水杨酸溶液、50μL终浓度为0.05、0.1、0.25、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3、3.5、4g/L亚硝基铁氰化钠溶液和50μL 60mL/L次氯酸钠溶液,37℃恒温箱温浴30min。以超纯水为参比,测定OD696的变化情况,每个浓度重复3次。
1.2.4.4次氯酸钠对显色反应的影响取25μL 10mmol/L的氯化铵溶液,加入50μL 25g/L氢氧化钠溶液、50μL 65g/L水杨酸溶液、50μL 1.5g/L亚硝基铁氰化钠溶液和50μL终浓度为10、20、30、40、50、60、70、80、90、100mL/L次氯酸钠溶液,37℃恒温箱温浴30min。以超纯水为参比,测定OD696的变化情况,每个浓度重复3次。
1.2.5响应面分析法优化腺苷检测试剂在单因素实验的基础上,着重考查氢氧化钠浓度(A)、水杨酸浓度(B)、亚硝基铁氰化钠浓度(C)和次氯酸钠浓度(D)对腺苷检测的影响。运用Design Expert 8.0软件程序,根据CCD[12]中心组合实验设计原理,采用四因素五水平响应面(RSM)[13-14]分析方法,以吸光度值为响应值Y做响应面,对各试剂浓度进行优化,因素水平如表1所示。实验结果用Design Expert 8.0软件进行处理。
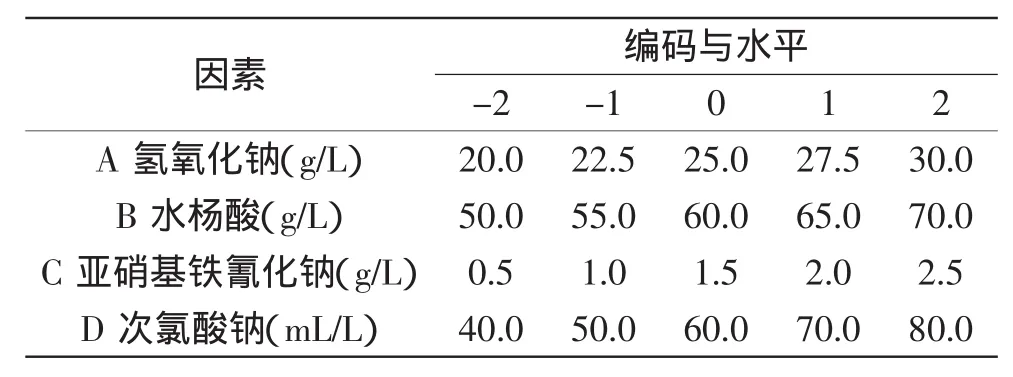
表1 CCD因素水平及编码Table 1 Variables and levels used for CCD
1.2.6腺苷标准曲线的绘制准确称取腺苷标准品适量,加M9培养基溶解制成10mmol/L的溶液。分别吸取不同体积的标准品溶液进行稀释,使腺苷终浓度为0.01、0.025、0.05、0.075、0.1、0.25、0.5、0.75、1、2、3、4、5、6、7、8、9、10mmol/L。取25μL腺苷溶液,加入100μL 0.01mol/L的PBS缓冲液,再加入1μL ADA,37℃恒温箱温浴40min后,加入50μL试剂A、50μL试剂B,再放入37℃恒温箱温浴30min。以不加ADA的反应体系作为空白参比,在696nm处测其吸光度值。以吸光度值(y)对腺苷浓度(x)作图绘制标准曲线。
1.2.7发酵液中的腺苷含量检测将产腺苷枯草芽孢杆菌ZX05发酵24h的发酵液12000r/min离心3min,取25μL上清液,按照1.2.6的方法,以相应的发酵液作为空白参比,测定OD696的值。同时取上清液1mL过滤进行HPLC分析,根据保留时间定性,峰面积定量。HPLC条件:色谱柱为Agilent C18柱(250mm×416mm,5μm),流动相为水(pH=3.0)∶乙腈=94∶6,流速0.8mL/min,检测波长280nm,柱温35℃,进样量10μL。
1.2.8加标回收实验取1.2.7中离心过的上清液与适量的腺苷标准溶液混合,使腺苷溶液终浓度为0.2、0.4、0.6、0.8、1、2mmol/L。以相应的发酵液作为空白参比,按1.2.6的方法检测加标样本。
2 结果与分析
2.1最大吸收波长的测定
取25μL 10mmol/L的氯化铵溶液,加入50μL 25g/L氢氧化钠溶液、50μL 62g/L水杨酸溶液、50μL 2g/L亚硝基铁氰化钠溶液和50μL 60mL/L次氯酸钠溶液,37℃恒温箱温浴30min。在波长450~750nm之间进行扫描,随后又进一步缩小扫描范围,吸光度值曲线见图1和图2。由图2可知,在696nm处有一强吸收峰,选定此波长作为测定波长。

图1 波长扫描图Fig.1 Scanning of wavelength

图2 波长扫描图Fig.2 Scanning of wavelength
2.2单因素优化实验结果
2.2.1氢氧化钠对显色反应的影响由图3可知,在氢氧化钠浓度为25g/L时,吸光度值最大。因此,实验选取氢氧化钠溶液浓度为25g/L。
2.2.2水杨酸对显色反应的影响由图4可知,在水杨酸溶液浓度为65g/L时,吸光度值最大。因此,实验选取水杨酸溶液浓度为65g/L。
2.2.3亚硝基铁氰化钠对显色反应的影响由图5可知,在亚硝基铁氰化钠溶液浓度为1.5g/L时,吸光度值最大。因此,实验选取亚硝基铁氰化钠溶液浓度为1.5g/L。
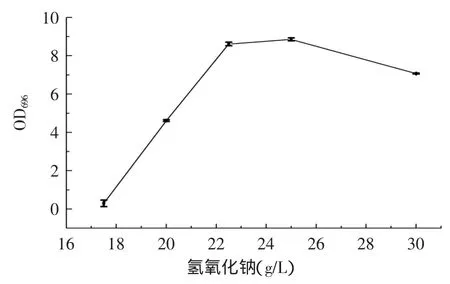
图3 氢氧化钠对显色反应的影响Fig.3 The effects of sodium hydroxide on the absorbance
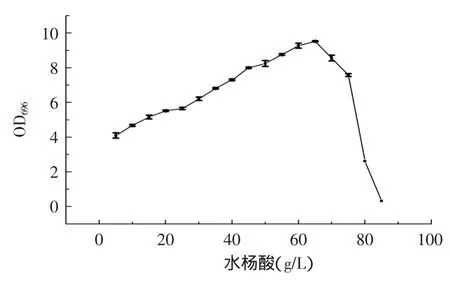
图4 水杨酸对显色反应的影响Fig.4 The effects of salicylic acid on the absorbance

图5 亚硝基铁氰化钠对显色反应的影响Fig.5 The effects of sodium nitroferricyanide on the absorbance

图6 次氯酸钠对显色反应的影响Fig.6 The effects of sodium hypochlorite on the absorbance
2.2.4次氯酸钠对显色反应的影响由图6可知,在次氯酸钠溶液浓度为60mL/L时,吸光度值最大。因此,实验选取次氯酸钠溶液浓度为60mL/L。
2.3响应面法优化实验结果
2.3.1响应面实验设计及结果根据CCD实验设计原理,在单因素实验的基础上,选取氢氧化钠、水杨酸、亚硝基铁氰化钠和次氯酸钠浓度4个因素,进行四因素五水平的响应面实验设计,共30个实验点,实验结果见表2。
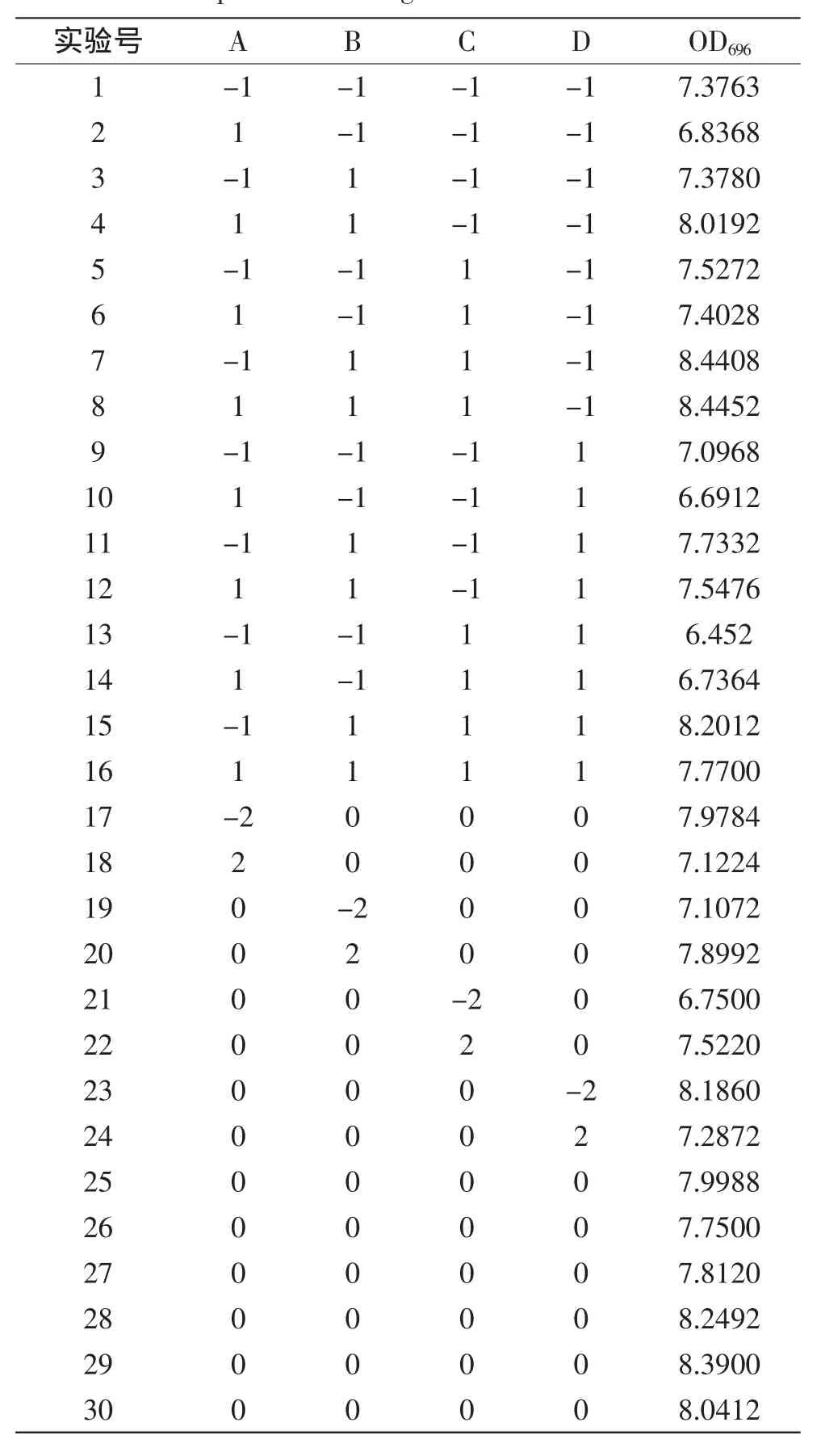
表2 中心组合实验设计及实验结果Table 2 Experimental design and results based on CCD
2.3.2数学模型的建立及统计学分析对表2进行方差分析及多元回归分析。方差分析(ANOVA)及回归系数的显著性分析采用F检验,p值用来评估各个变量对吸光度值的影响,以p值(Prob>F)<0.05判定某模拟项为显著项[15]。方差分析结果见表3,得到的回归模型为:
Y=8.04-0.10A+0.37B+0.16C-0.21D+0.05AB+ 0.01AC-0.04AD+0.13BC+0.07BD-0.13CD-0.12A2-0.13B2-0.23C2-0.08D2
由表3可知,回归模型的显著性水平p=0.0005<0.05,说明此模型显著。失拟项p=0.2895>0.05,影响不显著,且回归方程的R2=0.8545,说明该模型的拟合效果较好,可以用该回归方程代替真实实验点对实验结果进行分析。

表3 二次方模型ANOVA分析Table 3 ANOVA for quadratic model

表4 响应面模型中变量的回归系数和重要水平Table 4 Regression coefficients and their significance for response surface model
回归模型显著性检验结果见表4。检验结果表明,水杨酸、亚硝基铁氰化钠溶液浓度的一次项和二次项、次氯酸钠溶液浓度的一次项、氢氧化钠溶液浓度的二次项为显著项,交互项影响不显著。
图7 氢氧化钠和水杨酸对吸光度值产生的交互影响Fig.7 Effect of the interaction between sodium hydroxide and salicylic acid on OD696
等高线的形状可以反映因素间交互作用的强弱大小,圆形表示交互作用不显著,椭圆形表示交互作用显著。图7表示氢氧化钠和水杨酸之间的相互影响。等高线呈圆形说明氢氧化钠和水杨酸之间的交互作用不显著。此结果与显著性分析表所反映出的结果一致。根据回归方程得到最优试剂用量:氢氧化钠25.85g/L,水杨酸68.05g/L,亚硝基铁氰化钠2.19g/L,次氯酸钠40.9mL/L。对应于此最优值,预测的最优吸光度值为8.6336。
2.3.3模型的验证为了考察模型的实用性和准确性,对该模型进行验证实验。按照此最终试剂参数进行六次重复实验,可得吸光度值为8.7210±0.094,实验值与预测值(8.6336)的偏差<5%。表明此模型是可行的,并具有一定的实践参考价值。
2.4标准曲线的绘制
按照1.2.6的方法制标的准曲线见图8。回归方程为y=0.8207x+0.4028,R2=0.9940,线性范围为0.01~10mmol/L,呈良好的线性关系。
图8 M9培养基中腺苷标准曲线Fig.8 Adenosine standard curves using ADA assay in M9 medium
2.5 ADA法和HPLC法检测发酵液中腺苷含量结果比较
按照1.2.7的方法测定发酵液中的腺苷含量,ADA法做3个平行,实验结果见图9。
图9 ADA法和HPLC法检测发酵液中的腺苷含量Fig.9 Concentration of adenosine detected by ADA assay and HPLC
由图9可知,ADA法检测发酵液所含腺苷的含量为(1.091±0.005)mmol/L,HPLC检测的结果为(1.087± 0.001)mmol/L,两种检测方法检测到的腺苷含量一致,说明可以利用本方法来检测腺苷含量。
2.6加标回收实验结果
按照1.2.8的方法,以2.4中的标准曲线计算加标回收实验中腺苷的测定值,结果见表5。
表5 标准加标回收实验结果Table 5 The results of standard addition recovery experiments
由表5知,该方法回收率在95.5%~103.8%之间,RSD精准度在0.9%~3.3%之间。检测结果显示本方法的准确性和重现性良好,可以用来检测发酵液中的腺苷含量。
3 结论与讨论
本研究建立了一种快速、高通量检测发酵液中腺苷含量的方法。该方法只需要用到腺苷脱氨酶和氢氧化钠、水杨酸等几种简单的化学试剂,且检测能够在1.5h内完成。通过单因素、响应面方法优化得到最优试剂用量为氢氧化钠25.85g/L、水杨酸68.05g/L、亚硝基铁氰化钠2.19g/L和次氯酸钠40.9mL/L,以最优试剂用量建立腺苷的标准曲线,其线性范围为0.01~10mmol/L。该方法回收率在95.5%~103.8%之间,RSD精准度在0.9%~3.3%之间。
本方法与HPLC法检测结果一致,且加标回收实验亦验证了本方法的准确性。值得注意的是,腺苷脱氨酶要充分水解腺苷产生铵,且该检测方法的反应条件是在碱性条件下进行,试剂A、试剂B加入的时间要尽可能的短,否则会导致实验结果检测不准确。本研究方法与传统的HPLC检测方法相比,大大节省了检测时间、样品处理时间,尤其是高通量筛选检测的时间。同时,本方法省去了昂贵的设备使用费、维修费,且操作简单,无需对操作人员再进行额外的培训。
研究发现本方法能够对发酵液样本进行快速且高通量检测,为高通量筛选腺苷高产菌株奠定了基础。本方法用到的检测铵的方法只是常用的检测方法之一[16]。铵的其他检测方法[17-21],亦可以与腺苷脱氨酶结合来对腺苷进行检查。同时,此方法也为其他能够通过脱氨反应产生氨的检测提供了一种可选方法。
[1]Linden J.Adenosine in tissue protection and tissue regeneration[J].Mol Pharmacol,2005,67(5):1385-1387.
[2]Lu Q,Newton J,Harrington E O,et al.Adenosine enhances endothelial barrier function via alteration of small gtpases[J].Am J Respir Crit Care Med,2011,183(1):A1949.[3]Marzilli M,Orsini E,Marraccini P,et al.Beneficial effects of intracoronary adenosine as an adjunct to primary angioplasty in acute myocardial infarction[J].Circulation,2000,101(18):2154-2159.
[4]Lawson C S,Coltart D J,Hearse D J.Dose-dependency and temporal characteristics of protection by ischaemic preconditioning against ischaemia-induced arrhythmias in rat hearts[J].J Mol Cell Cardiol,1993,25(12):1391-1402.
[5]Pelleg A,Porter R S.The pharmacology of adenosine[J]. Pharmacotherapy,1990,10(3):157-174.
[6]苏哈道尼克R J.核苷类抗菌素[M].北京:科学出版社,1982:1-153.
[7]Konishi S,Kubota K,Aoki R,et al.Studies on the production of purine nucleotides[J].Amino Acid and Nucleic Acid,1968,18(15):22-24.
[8]Haneda K,Hirano A,Kodaira R,et al.Accumulation of nucleic acid-related substances by microorganisms:part II. Production of adenosine by mutants derived from Bacillus sp[J]. Agr Biol Chem,1971,35(12):1906-1912.
[9]Nishiyama T,Nakamatsu T,Shirota T.Adenosine production by a mutant of Bacillus subtilis resistant to adenine analogs[J]. Nippon Nogeikagaku Kaishi,1994,68(4):809-814.
[10]胡小玲,吴鹏.水杨酸次氯酸盐测定水中氨氮方法的改进[J].干旱环境监测,2005,19(3):184-185.
[11]蒋岳文,陈淑梅,马英.靛酚蓝分光光度法测定海水中氨氮最佳条件的选择[J].海洋环境科学,1997,16(4):43-47.
[12]顾英,韩凤丽,王洪洋.响应面法优化红薯叶类黄酮提取工艺的研究[J].食品工业科技,2012,33(3):286-333.
[13]Yatsyshyn V Y,Fedorovych D V,Sibirny A A.Medium optimization for production of flavin mononucleotide by the recombinant strain of the yeast Candida famata using statistical designs[J].Biochem Eng J,2010,49(1):52-60.
[14]Vaheed H,Shojaosadati S,Galip H.Evaluation and optimization of ethanol production from carob pod extract by Zymomonas mobilis using response surface methodology[J].J Ind Microbiol Biotechnol,2011,38(1):101-111.
[15]Dong H N,Zhao X M,Ma Y Y,et al.Optimization of a synthetic medium for ethanol production by xylose-fermenting Zymomonas mobilis using response surface methodology[J]. Chinese Sci Bull,2012,57(28-29):3782-3789.
[16]Okumura M,Fujinaga K,Seike Y,et al.A simple and rapid visual method for the determination of ammonia nitrogen in environmental waters using thymol[J].Anal Bioanal Chem,1999,365(5):467-469.
[17]SG,D.An ion exchange method for plasma ammonia concentration[J].J Lab Clin Med,1961,58:149-155.
[18]Thomas D H,Rey M,Jackson P E.Determination of inorganic cations and ammonium in environmental waters by ion chromatography with a high-capacity cation-exchange column[J].J Chromatogr A,2002,956(1-2):181-186.
[19]Diaz J,Tornel P L,Martinez P.Reference intervals for blood ammonia in healthy subjects,determined by microdiffusion[J]. Clin Chem,1995,41(7):1048.
[20]Da Fonseca-Wollheim F,Heinze K G.Which is the appropriate coenzyme for the measurement of ammonia with glutamate dehydrogenase?[J].Eur J Clin Chem Clin Biochem,1992,30(9):537-540.
[21]Yamaguchi F,Etoh T,Takahashi M,et al.A new enzymatic cycling method for ammonia assay using NAD synthetase[J].Clin Chim Acta,2005,352(1-2):165-173.
Optimization of a rapid enzymatic assay for adenosine in fermentation broth based on adenosine deaminase by response surface methodology
ZU Xin1,2,DONG Hui-na2,LI Ning2,3,ZHANG Da-wei2,*,SUN Yu-mei1,*
(1.School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China;2.Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China;3.School of Basic Medical Sciences,Lanzhou University,Lanzhou 730000,China)
This study attempted to establish a new rapid assay for adenosine combined adenosine deaminase(ADA)with indophenol method.Based on the single factor tests,the optimal reaction conditions were explored by response surface methodology with four variables of sodium hydroxide,salicylic acid,sodium nitroferricyanide and sodium hypochlorite.And a verification experiment using the optimum composition(sodium hydroxide 25.85g/L,salicylic acid 68.05g/L,sodium nitroferricyanide 2.19g/L,sodium hypochlorite 40.9mL/L)was performed. A adenosine standard curve was established under the optimum reaction conditions in range of 0.01~10mmol/L. The recovery of adenosine by ADA assay were between 95.5%~103.8%and RSD were between 0.9%~3.3%. This assay showed high consistency with HPLC method when determine the concentration of adanosine in fermentaton broth.Then the reliability of the ADA assay was further supported by spike and recovery test.The results showed that the method could rapidly and high-throughput determine the adenosine concentration in fermentation broth.
adenosine;adenosine deaminase;high-throughput screening;response surface methodology
TS207.3
A
1002-0306(2015)14-0081-06
10.13386/j.issn1002-0306.2015.14.007
2014-10-20
祖昕(1990-),女,在读硕士研究生,研究方向:微生物代谢。
张大伟(1978-)男,博士,研究员,研究方向:微生物代谢控制,蛋白组学分析。孙玉梅(1962-),女,博士,教授,研究方向:微生物发酵工程,生物降解。
国家自然基金(31200036,31370089)。
