基因组定向编辑技术的专利概述及其对高校创新创业教育的启示
2015-10-29樊祥宇林燕萍廖国建谢建平
樊祥宇,林燕萍,廖国建,谢建平
基因组定向编辑技术的专利概述及其对高校创新创业教育的启示
樊祥宇1, 2,林燕萍1,廖国建3,谢建平1
1. 西南大学生命科学学院,三峡库区生态环境与生物资源省部共建国家重点实验室培育基地,三峡库区生态环境教育部重点实验室,现代生物医药研究所,重庆北碚400715;2. 济南大学生物科学与技术学院,济南 25002;3. 西南大学药学院,现代生物医药研究所,重庆北碚 400715
锌指核酸酶(Zinc finger nucleases,ZFN)、转录激活子样效应因子核酸酶(Transcription activator-like effector nucleases,TALEN)和成簇规律间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)/Cas9核酸酶是三个主要的基因组定向编辑技术。它们在基因功能研究、物种改造和疾病预防与基因治疗等各个领域都有重大科学研究及应用价值。每个技术背后都有过和有着激烈的知识产权归属之争。本文归纳总结这三大基因组定向编辑技术的知识产权,以期为研发具有自主知识产权的基因组编辑工具提供一些借鉴,也为现阶段高校创新创业教育提供启示。
ZFN;TALEN;CRISPR/Cas;知识产权
2008年我国国务院印发的《国家知识产权战略纲要》指出“知识产权日益成为国家发展的战略性资源和国际竞争力的核心要素,成为建设创新型国家的重要支撑和掌握发展主动权的关键”。对知识产权的了解及学习可以激发人们特别是青年学生及科研工作者的创造性,规范市场经济秩序和增强国家的自主创新能力意识。相反,知识产权知识匮乏,人们的创造性就难以被充分激发,创新型国家的建设也就难以实现。
基因组编辑技术作为新兴的遗传操作技术,在基因功能研究、动植物改造和疾病预防与基因治疗等各个领域都具有重大科研及应用价值。本文概述了它们的知识产权之争,期望以此激发国内的广大遗传学工作者的创造力和知识产权保护意识,以期为研发具有自主知识产权的基因组编辑工具提供一些借鉴,为高校现行的创新创业教育提供启示。
1 基因组编辑技术简介
1.1 锌指核酸酶(Zinc finger nucleases, ZFN)
ZFN可以被称作第一代基因组编辑技术,它由美国约翰霍普金斯大学的Srinivasan Chandrasegaran课题组于1996年发明[1]。随着众多科学家对其的改造及应用,逐渐成为最为成熟的基因组编辑技术[2, 3]。ZFN由锌指蛋白(能够特异性的识别并结合DNA序列)及非特异性核酸内切酶Ⅰ融合而成,其工作原理是通过锌指蛋白识别特定DNA序列后,Ⅰ将在此位点切割一个DNA双链切口,之后细胞固有的同源重组或非同源末端连接修复机制将进行切口修复,从而实现对基因的定点编辑。
1.2 转录激活子样效应因子核酸酶(Transcription activator-like effector nucleases, TALEN)
TALEN可以被称作第二代基因组编辑技术,在其被发现的短短几年时间便得到了众多科学家的关注及应用开发[4]。德国马丁-卢瑟大学Ulla Bonas研究组首次发现由植物致病菌Xanthomonas所分泌的转录激活子样效应因子(Transcription activator-like effector,TALE)可以特异性识别、结合并激活植物宿主特定基因[5]。美国明尼苏达大学的Dan Voytas和爱荷华州立大学的Adam Bogdanove研究组将TALE上进行特异性识别并结合DNA的结构域与核酸内切酶(Ⅰ)融合改造,得到TALEN[6, 7]。它的工作原理和ZFN类似,不过由于TALE结构域可识别单个碱基(锌指模块识别三联体碱基),意味着TALEN比ZFN更容易设计、特异性更高。
1.3 成簇规律间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats, CRISPR)/Cas9核酸酶
CRISPR/Cas是细菌及古细菌的免疫系统,其中CRISPR/Cas9被成功改造为第三代基因组编辑工具,可用于动物、植物以及细菌的基因组编辑。2012年Jennifer Doudna 和Emmanuelle Charpentier课题组首次提出该系统可作为基因编辑工具[8]。在接下来的短短几年里众多科学家对其产生了极大的兴趣,该技术得到了迅速的推广应用[9]。CRISPR/Cas9核酸酶的作用原理和ZFN及TALEN(DNA序列特异性结合蛋白导向的基因编辑)不同,它主要依赖一段序列特异性的向导RNA分子(Single guide RNA,sgRNA)指导Cas9核酸酶的定向切割,Cas9蛋白在与 sgRNA 配对的序列靶位点剪切宿主的双链 DNA,起到基因编辑的作用。这一系统相对于ZFN及TALEN技术拥有操作制备容易、特异DNA靶点寻找简单和作用高效等优点(表1)。

表1 三个基因组编辑技术的优缺点
2 三大技术的知识产权问题
2.1 ZFN的知识产权问题
锌指核酸酶技术是最成熟的基因组编辑技术。科学家对其进行了近20年的开发研究,已经从序列特异性、细胞毒性和免疫原性等方面对其有了较深的认识。许多科学家已经将这一技术用于人类疾病的基因治疗以及植物动物的基因改良[2, 3],并取得了一定的成果。但由于受到锌指蛋白(Zinc finger protein,ZFP)专利保护的制约,这一技术的大规模商业应用甚至使进一步的实验室研究开发的前景都受到了很大的限制。
锌指核酸酶的发明者Srinivasan Chandrasegaran教授在2009年时曾调查了ZFN的专利情况,发现美国Sangamo公司持有了有关锌指核酸酶的大部分专利[10]。专利类别分析结果显示,在Sangamo公司所持有的或得到专有授权的专利中,近一半的专利涉及到ZFP工程设计、筛选及优化技术。众所周知,锌指模块需要大量优化才能实现特异性基因打靶,ZFP工程设计、筛选及优化技术是锌指核酸酶技术的核心。设计与锌指结构结合的核酸酶是繁琐复杂的任务,一位分子生物学研究生需要花费1~2个月时间才能设计出完美的锌指核酸酶。依托这些专利,美国生物化学公司Sigma-Aldrich(Sangamo生物技术公司把ZFN技术独占性许可给Sigma-Aldrich公司)可为客户提供专门定制或商品化的锌指核酸酶。不过价格相当昂贵(定制价格为25000美元/一种锌指蛋白;商品化价格为12000美元/一种锌指蛋白)。
这种情况于2008年发生改变,J. Keith Joung教授牵头组织的锌指协会公开了一种被称作寡聚体库工程(Oligomerized Pool Engineering,OPEN)的设计锌指核酸酶的新方法[11]。并且锌指协会还将储存并为研究者提供已被证明的具有高效率的锌指结构蛋白(200美元/一种锌指蛋白)。这意味着,学术研究者无需通过Sigma-Aldrich便可直接获得高效率的锌指蛋白。尽管到目前为止Sangamo公司并没有对OPEN的锌指核酸酶设计方法提出异议,也没有对学术研究者发出禁止使用锌指的禁令,但值得注意的是作为大部分锌指核酸酶专利的持有者,Sangamo公司应该会对所有涉及到ZFN下游应用的商业发展都宣称其知识产权。
2.2 TALEN的知识产权问题
TALEN技术晚于ZFN技术出现,但却表现出更强的可塑性。相比锌指模块识别三联体碱基,TALE结构域可以识别单个碱基,这意味着原则上TALEN能靶向所有的核苷酸序列。面对如此巨大的应用潜力,各大医药公司针对TALEN技术的专利战早已打响。
笔者调查美国专利商标局中有关TALEN技术的专利情况,发现主要有4大机构持有TALEN技术的专利(附表1):德国马丁-卢瑟大学Ulla Bonas研究组(发明TALEN技术的两个小组之一)、美国明尼苏达大学的Dan Voytas和爱荷华州立大学的Adam Bogdanove研究组(发明TALEN技术的两个小组之一)、Sangamo生物技术公司以及麻省理工学院-哈佛大学的Broad研究所。
德国马丁-卢瑟大学Ulla Bonas研究组拥有的有关TALEN技术的专利具有宽泛的保护范围,内容涵盖TALE设计和使用的方方面面,包括融合蛋白。2011年他们将这些专利许可给美国Life Technologies公司。Life Technologies公司依托这些专利可开展除植物(TALEN技术在植物中的商业应用被保留)以外所有方面的商业应用。美国明尼苏达大学/爱荷华州立大学研究组所持有的有关TALEN专利的关注点是获得可在DNA上进行位点特异性切割的TALEN的材料和方法。这些专利已被许可给法国Cellectis公司。Sangamo公司所拥有的有关TALEN技术的专利是利用TALE转录因子调控哺乳动物内源基因的表达,并对人内源性基因进行序列编辑。麻省理工学院-哈佛大学Broad研究所持有的有关TALEN的专利主要利用此技术来改变动物细胞中特定的基因位点。值得关注的是中国斯丹赛生物技术有限公司(SIDANSAI Biotechnology Co.)的“TALEN构建一步法”技术于2014年获得专利授权(美国专利号:8748134)。这一技术将繁琐的TALEN构建方法简化,提高了基因操作的效率。
现在,商业化定制的基因特异性的TALEN可以由多家公司提供,成套的TALEN试剂盒也已经商业化。相比ZFN技术,其价格更易被科研工作者接受。
2.3 CRISPR/Cas9的知识产权问题
CRISPR/Cas9技术作为第三代基因组编辑技术,是现阶段基因组编辑领域的热点,被认为是自20世纪70年代以来发明的重要性不亚于PCR技术的基因工程技术。随着CRISPR/Cas9技术的开发及广泛应用,与其有关的专利大战也拉开帷幕。
基于CRISPR/Cas9系统的基因组编辑技术的第一个专利于2014年由美国麻省理工学院-哈佛大学Broad研究所的张峰团队获得[12],这一专利的保护范围将一整套CRISPR/Cas9系统载体和操作方法包括在内。随后张峰团队又逐渐获批了10份相关的专利(附表2)。这些专利已被排他性地授予给美国通用电气医疗集团生命科学部和Sigma-Aldrich公司,他们都有机会将CRISPR/Cas9基因组编辑技术用于商业开发及动植物的改良等。
第一份CRISPR/Cas9系统的专利被批准,引起了科学界极大震惊。其中美国加州伯克利大学的Jennifer Doudna和德国亥姆霍兹医学研究中心的Emmanuelle Charpentier(两人因CRISPR/Cas9基因组编辑技术获得2015年的生命科学突破奖)声明她们最先发明了这一技术,并要求专利局重新考虑麻省理工学院-哈佛大学Broad研究所获得的有关CRISPR/Cas9系统的专利。做出这一声明的依据是她们最先报道利用CRISPR/Cas9技术来进行基因组编辑[8],并且也先于张峰团队递交专利申请。而张峰则认为他们才是首次证明CRISPR在人类细胞中起作用的团队[13],而Jennifer Doudna和Emmanuelle Charpentier团队只是猜测。现在CRISPR/Cas9基因组编辑技术的专利究竟在未来花落谁家还无从得知,不过可以肯定的是针对这一技术所产生的专利纠纷已经减缓了它的商业化进程。
3 对高校教育的启示
以我们从美国专利商标局调查得到的数据(附表1和附表2)和Srinivasan Chandrasegaran教授的统计结果[6]进行整合,绘制了三大基因组编辑技术的专利区域分布图(图1)。总的来看,与ZFN、TALEN及CRISPR/Cas9这3种基因组定向编辑技术相关的专利都集中在欧美的大学、研究院或公司。鲜有中国的学者或公司持有此类专利。从一方面来说,我国科研工作者的科研嗅觉及知识产权意识还有待加强;从另一方面来说,我国的生物技术公司也应该加强对此类具有重大应用开发前景专利的收购。通过对这三大基因组编辑技术有关的知识产权及相应纠纷的概述,我们认为国内学者应该做到以下3点:(1) 培养知识产权意识,重视专利申请;(2) 专利申请应注重专利的保护范围;(3) 注重成果转化,敢于将基础研究成果开发成商业应用。
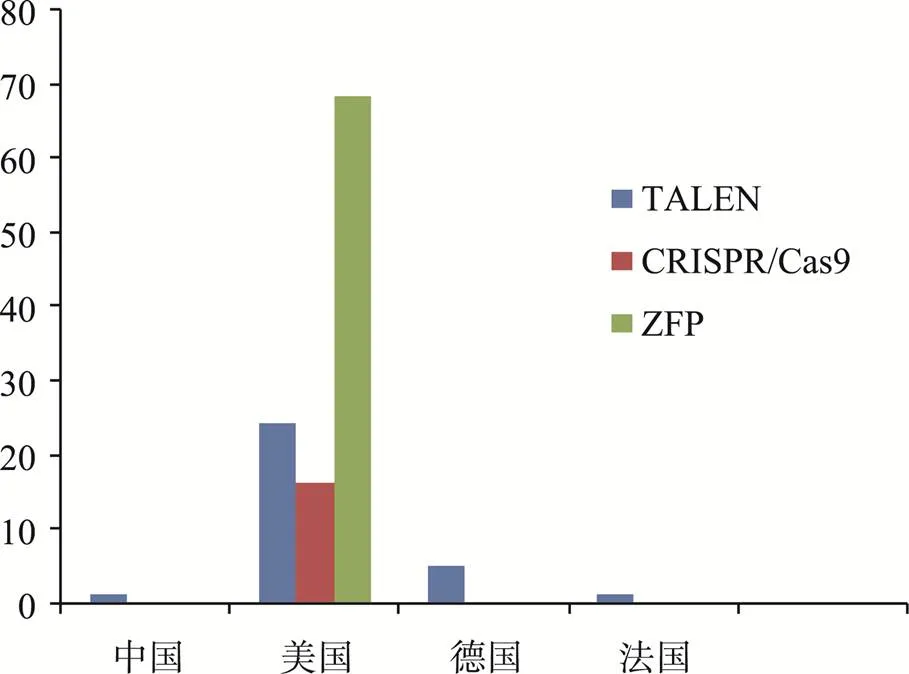
图1 三大基因组编辑技术的专利区域分布图
虽然我国重视大学生的创新创业教育,但不可否认的是现阶段高校更重视大学生创新教育,对创业教育特别是从创新走向创业的连贯性教育缺失。只有经过了这一阶段的培养,学生们才能更快地发现并抓住机遇,重视基础研究的商业应用。总的来说,对大学生进行知识产权教育及培养他们对重大科技进展的知识产权嗅觉是不可或缺的。而调查发现,现在大学的知识产权课堂面临以下问题:教材匮乏、师资不足且学生兴趣度不高。在这一背景下,要想增强大学生的知识产权意识,做到创新创业教育的融合,就需要高校管理者和相应的教师转变思维:将灌输性的知识产权课堂转换为案例教学,以最新的具有冲击力的案例吸引学生。这样,大量围绕最新生物技术的知识产权案例,解决了教材匮乏的问题;相应的专业性案例由专业课老师讲解,解决了师资不足的问题;有趣的、具有冲击力的案例,解决了学生兴趣度不高的问题。而3大基因组定向编辑技术的专利争夺战正是不可多得的良好素材。通过对ZFN、TALEN及CRISPR/Cas9的知识产权的介绍,可以看到众多生物公司及科技人才发现商机并抓住商机的过程,这对高校创新创业教育具有良好的启示和指导作用。
附录:附表见电子版www.chinagene.cn。
参考文献
[1] Kim YG, Cha J, Chandrasegaran S. Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain., 1996, 93 (3): 1156–1160.
[2] 钟强, 赵书红. 锌指蛋白核酸酶的作用原理及其应用. 遗传, 2011, 33 (2): 123–130.
[3] 肖安, 胡莹莹, 王唯晔, 杨志芃, 王展翔, 黄鹏, 佟向军, 张博, 林硕. 人工锌指核酸酶介导的基因组定点修饰技术. 遗传, 2011, 33 (7): 665–683.
[4] 沈延, 肖安, 黄鹏, 王唯晔, 朱作言, 张博. 类转录激活因子效应物核酸酶(TALEN)介导的基因组定点修饰技术. 遗传, 2013, 35 (4): 395–409.
[5] Kay S, Hahn S, Marois E, Hause G, Bonas U. A bacterial effector acts as a plant transcription factor and induces a cell size regulator., 2007, 318 (5850): 648–651.
[6] Christian M, Cermak T, Doyle EL, Schmidt C, Zhang F, Hummel A, Bogdanove AJ, Voytas DF. Targeting DNA double-strand breaks with TAL effector nucleases., 2010, 186 (2): 757–761.
[7] Cermak T, Doyle EL, Christian M, Wang L, Zhang Y, Schmidt C, Baller JA, Somia NV, Bogdanove AJ, Voytas D F. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting., 2011, 39 (12): e82.
[8] Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity., 2012, 337 (6096): 816–821.
[9] 殷利眷, 胡斯奇, 郭斐. CRISPR-Cas9基因编辑技术在病毒感染疾病治疗中的应用. 遗传, 2015, 37(5): 412–418.
[10] Chandrasekharan S, Kumar S, Valley CM, Rai A. Proprietary science, open science and the role of patent disclosure: the case of zinc-finger proteins., 2009, 27 (2): 140–144.
[11] Maeder M L, Thibodeau-Beganny S, Osiak A, Wright DA, Anthony RM, Eichtinger M, Jiang T, Foley JE, Winfrey RJ, Townsend JA, Unger-Wallace E, Sander JD, Muller-Lerch F, Fu FL, Pearlberg J, GÖbel C, Dassie JP, Pruett-Miller SM, Porteus MH, Sgroi DC, Iafrate AJ, Dobbs D, McCray PB Jr, Cathomen T, Voytas DF, Joung JK. Rapid "open-source" engineering of customized zinc-finger nucleases for highly efficient gene modification., 2008, 31 (2): 294–301.
[12] 樊祥宇, 廖国建, 谢建平. 以CRISPR/Cas9专利为例的知识产权教育. 遗传, 2014, 36 (12): 1269–1273.
[13] Cong L, Ran FA, Cox D, Lin S, Barretto R, Habib N, Hsu PD, Wu XB, Jiang WY, Marraffini LA, Zhang F. Multiplex genome engineering using CRISPR/Cas systems., 2013, 339(6121): 819–823.
Overview of patents on targeted genome editing technologies and their implications for innovation and entrepreneurship education in universities
Xiangyu Fan1, 2, Yanping Lin1, Guojian Liao3, Jianping Xie1
Zinc finger nuclease, transcription activator-like effector nuclease, and clustered regularly interspaced short palindromic repeats/Cas9 nuclease are important targeted genome editing technologies. They have great significance in scientific research and applications on aspects of functional genomics research, species improvement, disease prevention and gene therapy. There are past or ongoing disputes over ownership of the intellectual property behind every technology. In this review, we summarize the patents on these three targeted genome editing technologies in order to provide some reference for developing genome editing technologies with self-owned intellectual property rights and some implications for current innovation and entrepreneurship education in universities.
ZFN; TALEN; CRISPR/Cas; intellectual property
2015-06-03;
2015-08-12
重庆市教委研究生教改项目“全球视野高层次人才培养的区域性跨院校支撑平台”(编号:YJG123104),重庆市教委研究生优质课程《高级微生物学》,西南大学本科生教改项目(编号:2013JY201),教育部新世纪优秀人才资助计划(编号:NCET-11-0703),国家自然科学基金(编号:81371851, 81071316, 81271882, 81301394)和中央高校基本科研业务费(编号:XDJK2011D006, XDJK2012D011, XDJK2012D007, XDJK2013D003,XDJK2014D040)资助
樊祥宇,博士,讲师。研究方向:噬菌体功能基因组学。E-mail: fxysnd@126.com
谢建平,博士,研究员。研究方向:人类重要致病菌的致病耐药机理和新干预措施研发。Tel: 86-23-68367108; E-mail: georgex@swu.edu.cn
10.16288/j.yczz.15-263
网络出版时间: 2015-8-12 16:05:02
URL: http://www.cnki.net/kcms/detail/11.1913.R.20150812.1605.010.html
(责任编委: 吴强)
