绿色荧光蛋白在α-1,3半乳糖基转移酶敲除猪组织器官的表达分析
2015-10-29李智方冯冲纪慧丽石宁宁宋小凤赵勤丽龙川潘登科杨小淦
李智方,冯冲,纪慧丽,石宁宁,宋小凤,赵勤丽,龙川,潘登科,杨小淦
绿色荧光蛋白在α-1,3半乳糖基转移酶敲除猪组织器官的表达分析
李智方1,2,冯冲2,纪慧丽1,2,石宁宁2,宋小凤2,赵勤丽2,龙川2,潘登科2,杨小淦1
1. 广西大学,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004;2. 中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193
猪是人类异种器官移植的理想供体,然而猪-人的异种器官移植会产生剧烈的排斥反应。虽然已制备的α-1,3半乳糖基转移酶基因敲除(Galactosyltransferase gene knockout, GTKO)猪可有效缓解猪-人异种器官移植引起的超急性免疫排斥,但缺少报告基因直观示踪移植后的细胞迁移及器官排斥状态。本文将CAG启动子驱动增强型绿色荧光蛋白(Enhanced green fluorescent protein, EGFP)的表达载体导入GTKO猪耳成纤维细胞,通过体细胞核移植技术制备了EGFP猪。利用双荧光蛋白观测镜、荧光显微镜及定量PCR扩增观察、检测和分析克隆猪各组织器官中EGFP蛋白和转录本的表达状况。结果显示,EGFP蛋白及转录本在克隆猪各组织器官中均有表达,但在肝脏和中枢神经系统中表达较弱。本文成功获得了各组织器官表达EGFP的GTKO猪,为EGFP示踪异种细胞组织移植奠定了基础。
GTKO;增强型绿色荧光蛋白;猪;异种移植
猪的血液生理生化指标及器官大小和人类的接近,是人类异种器官移植的理想供体[1]。猪器官应用于人临床试验面临着诸多难题,其中首要的障碍是超急性排斥反应(Hyperacute rejection, HAR),这种反应主要是由α-1,3半乳糖基转移酶(α-1,3 galactosyltransferase)合成的αGal(半乳糖)表位引起的,通过消除或减少半乳糖可有效缓解猪-人异种器官移植引起的超急性免疫排斥反应。2002年,Lai等[2]率先获得了α-1,3半乳糖转移酶基因敲除(α-1,3 galactosyltransferase gene knockout, GTKO)猪。目前,国际上已有多个课题组通过体细胞核移植技术获得了GTKO猪[3~6]。近10年来,多个课题组开展了以GTKO猪为供体、非人灵长类动物为受体的异种细胞(骨髓[7]和肝细胞[8])或器官(肾脏[9]和心脏[10,11])移植研究,在心脏移植领域取得了重要进展,异种心脏移植[11]存活时间可超过1年。虽然GTKO修饰取得了较理想的效果,但缺少报告基因,不能直观示踪移植后的细胞迁移及器官排斥状态。
CAG启动子是人工构建的组合启动子,由巨细胞病毒(Cytomegalovirus, CMV)早期增强子(Early enhancer element)和鸡β-肌动蛋白(Chicken beta-actin)启动子组成,在多种细胞中都有较强的表达活性,经体内和体外实验证实其不易被甲基化。本研究以GTKO五指山小型猪[6]为供体,向其耳成纤维细胞系中导入CAG启动子驱动的增强型绿色荧光蛋白(Enhanced green fluorescent protein, EGFP),利用体细胞核移植技术制备EGFP猪,分析EGFP在克隆猪各组织和器官中的表达,成功获得了各组织器官表达EGFP的GTKO猪,为EGFP示踪异种细胞组织移植奠定了基础。
1 材料和方法
1.1 载体构建
以pIRES2-EGFP(购自Clontech公司)质粒为模板,使用EGFP-F/R引物扩增基因,将扩增得到的EGFP以无缝连接技术连接到pCAGGS-neo载体上,获得pCAGGS-EGFP-neo表达载体。引物序列为:
EGFP-F:5'-ATTCGCATGCGGCCGCTAGCATGGTGAGCAAGGGCGAGGA-3';
EGFP-R:5'-CTCGATATCGGTACCTCGAGTTACTTGTACAGCTCGTCCA -3'。
1.2 供核体细胞系的建立、αGal鉴定和体细胞转染
剪取GTKO猪耳组织,3~5 h内带回实验室。采用组织块贴壁法建立猪耳成纤维细胞系,原代细胞的培养采用添加20% 胎牛血清(FBS, Gibco)和5%双抗DMEM培养基,当细胞达到接触抑制状态时冷冻保存或传代培养,以备后续的基因转染。传代细胞采用添加20% FBS的DMEM培养基,在37℃、5%CO2、饱和湿度的培养箱中培养。
αGal鉴定采用免疫荧光染色法,即FITC绿色荧光标记的抗αGal抗体染色30 min后,荧光显微镜下观察荧光。
复苏GTKO细胞,待其长至80%汇合时进行电转染,将8 μg pCAGGS-EGFP-neo线性化载体利用Amaxa Nucleofector Ⅱ转染仪进行电转染,然后G418筛选10~15 d,获得EGFP阳性细胞,为后续体细胞核移植提供供核细胞。
1.3 体细胞核移植和胚胎移植
按照潘登科等[12]方法进行体细胞核移植操作,即从屠宰场收集卵巢,获得卵母细胞,在38.5℃、5% CO2、饱和湿度的培养箱,体外成熟培养40~44 h。然后挑选排出第一极体、卵黄膜完整、卵周隙清晰的卵母细胞进行去核、注核,利用BLS融合仪使GFP阳性细胞融合到去核的卵母细胞中,获得重构胚。体外培养胚胎于第2 d、第6 d观察卵裂和囊胚及荧光观察。胚胎移植即融合激活后的重构胚在培养40 h内进行,自然发情第0 d或第1 d的长白或大白的后备母猪作为受体母猪,移植方法为手术法输卵管深度移植。
1.4 绿色荧光蛋白在各组织器官中的表达
EGFP转基因猪出生后,Nightsea DFP-1双荧光蛋白观测镜检测仔猪,之后解剖取仔猪的心脏、肝脏、脾脏、肺脏、肾脏、脊髓、胃、肠、大脑和小脑等器官检测绿色荧光蛋白表达情况。之后石蜡切片,荧光显微镜下检测心脏、肝脏、脾脏、肺脏、肾脏、胰腺、大脑、小脑、脊髓、舌、胃和骨骼肌等组织的绿色荧光表达,并应用Image J软件对荧光切片的荧光强度进行定量分析。
1.5 实时定量PCR检测各组织的表达
常规方法提取心脏、肝脏、肾脏、脾脏、肺脏、胰腺、大脑、小脑、脊髓、舌、肠、骨骼肌和耳等组织的RNA,以基因序列特异引物进行实时定量PCR测定EGFP表达。引物序列为:
上游引物:5'-AAACGGCCACAAGTTCAGCG-3';
下游引物:5'-AAGAAGATGGTGCGCTCCTG-3'。
1.6 数据分析
采用Photoshop CS5和Image J处理图片,SPSS 20.0软件对实验数据进行单因素方差分析,<0.05为差异显著。
2 结果与分析
2.1 供核细胞αGal鉴定和EGFP阳性细胞
供核细胞系FITC抗αGal抗体染色结果如图1所示。结果表明,抗αGal抗体与Gal抗原表位结合显示绿色,证明其是野生型(WT)猪细胞(图1A);染色后未显示绿色,说明该细胞Gal抗原表位缺失即该细胞为GTKO猪细胞系(图1B)。转染筛选获得EGFP阳性供核细胞结果见图2 A。

图1 供核细胞系αGal染色分析
A、A′:野生型(WT)猪细胞,20×;B、A′:GTKO猪细胞,10×。A、B分别是显微镜下荧光观察;A′、B′为显微镜下可见光观察。
2.2 EGFP克隆胚的体外发育及胚胎移植
利用EGFP阳性细胞为供核细胞进行体细胞核移植实验,获得208枚重构胚进行体外观察,EGFP与未转EGFP的胚胎的卵裂率、囊胚率差异不显著(79.8%. 80.57%,>0.05和19.23%. 19.42%,>0.05,表1、图2B和C)。以EGFP阳性细胞进行体细胞核移植构建599枚重构胚,移植到3头受体母猪,其中1头母猪妊娠并产下2头克隆仔猪。
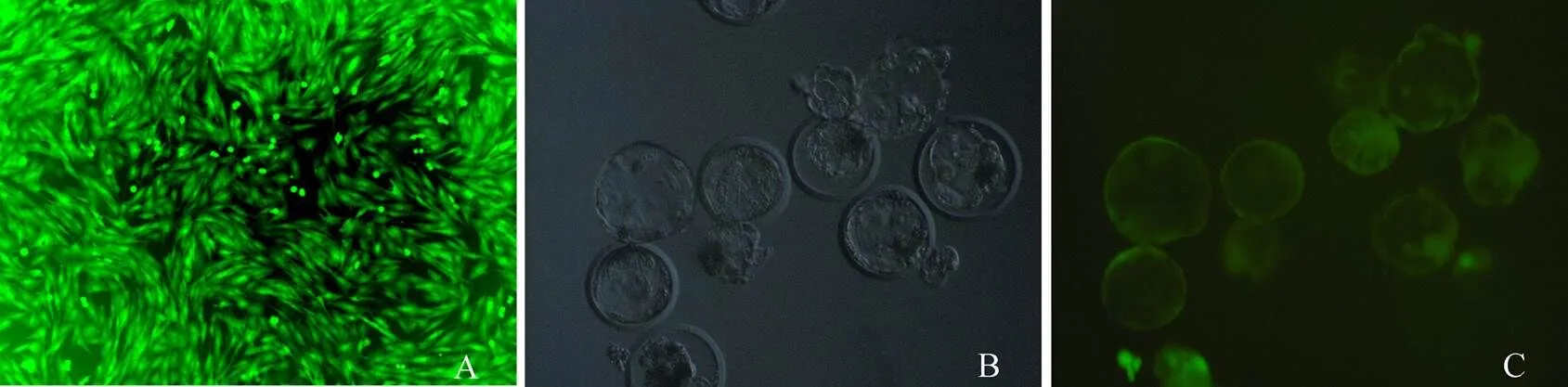
图2 显微镜观察EGFP细胞和囊胚图
A:荧光显微镜观察EGFP细胞,20 ×;B:普通光学显微镜下的囊胚;C:荧光显微镜下的囊胚,40 ×。

表1 EGFP克隆胚体外发育
注:EGFP-EF为GTKO阳性克隆,EF为GTKO细胞,=3 ;同一列间具有不同字母上标为差异显著,<0.05。
2.3 EGFP在克隆猪各组织器官中的表达情况
用Nightsea DFP-1双荧光蛋白观测镜检测心脏、肝脏、脾脏、肺脏、肾脏、胰腺、胃、肠、大脑和小脑等器官,均表达绿色荧光(图3),但肝脏中表达弱或无荧光表达。在荧光显微镜下观察心脏、肝脏、脾脏、肺脏、肾脏、胰腺、大脑、小脑、脊髓、舌、胃和骨骼肌等组织切片绿色荧光蛋白的表达情况(图4),结果表明骨骼肌肉和舌头荧光表达强,肝脏中表达极低。Image J定量分析发现,绿色荧光蛋白在各组织中均有表达,在骨骼肌和舌头中表达强,但在肝组织和中枢神经系统(大脑、小脑和脊髓)中表达较低(图5)。

图3 荧光观测镜观察各器官的荧光图
A:心脏;B:肝脏;C:肺脏;D:肾脏;E:胃;F:肠;G:大脑;H:小脑;I:脾脏;J:脊髓。左侧为EGFP组,右侧为对照组。

图4 组织切片荧光图
:心脏;B:肝脏;C:脾脏;D:肺脏;E:肾脏;F:脊髓;G:大脑;H:小脑;I:胰腺;J:胃;K:舌;L:骨骼肌。标尺:100 μm。

图5 定量分析EGFP在不同组织中的表达
2.4 实时定量分析在各组织中的表达情况
实时定量PCR检测心脏、肝脏、肾脏、脾脏、肺脏、胰腺、大脑、小脑、脊髓、舌、肠、骨骼肌和耳等组织中的表达,结果见图6。在肺脏和耳组织中表达强,但在大脑、小脑和脊髓为代表的中枢神经系统中表达较低。
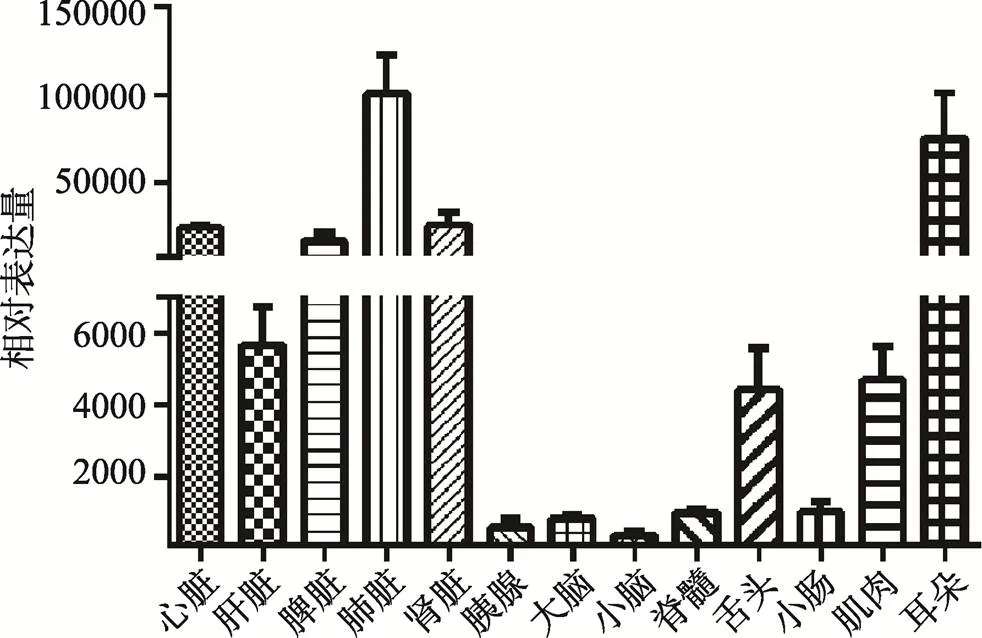
图6 qRT-PCR检测EGFP基因在不同组织中的表达
3 讨论
GTKO模型猪在异种移植研究中克服了超急性免疫排斥反应,但是目前所构建的GTKO猪都缺少报告基因,不能直观示踪移植后的细胞及器官的排斥状态。目前已有较多的实验室采用CMV广谱性表达的启动子获得了绿色荧光转基因猪[13~24],但是CMV启动子容易甲基化,可使转入的外源基因沉默。因此,本文选用CAG广泛性全身表达的启动子来制备EGFP示踪的转基因猪。
本研究通过双荧光蛋白观测镜、荧光显微镜及定量PCR技术,对EGFP在转基因猪的组织和器官中的表达进行了系统的分析。检测到猪的组织和器官均有EGFP表达,但是各种组织和器官之间的表达差异比较大,其中肝脏和中枢神经系统荧光表达弱。这与EGFP示踪报告基因模式动物(小鼠[25]、大鼠[26]、兔子[27])的研究相似,即各组织均有表达,但组织间表达差异比较大且均有表达弱的组织,如在大鼠和兔子中EGFP在肝脏中都有表达弱的迹象,这与本实验结果相似。本文推测EGFP在肝脏表达弱,这可能是因为肝脏对来自体内和体外的许多非营养性物质如药物、毒物及体内某些代谢产物,具有生物转化作用,通过新陈代谢将它们彻底分解或以原形排出,因此肝脏的这种“解毒功能”不利于绿色荧光蛋白这种报告基因的表达。另外,在本实验中qPCR检测胰腺组织RNA表达极弱,这是由于胰腺是一个混合性分泌腺体,主要有外分泌和内分泌两大功能。其中外分泌腺分泌的主要成分是胰液(含各种消化酶),很容易发生自溶,且胰腺组织含有大量内源性RNA酶,故胰腺组织RNA的提取较为困难,所以推测胰腺中表达较弱可能是胰腺中RNA较易降解。
总之,本研究成功获得了各组织器官表达EGFP的GTKO猪,为EGFP示踪异种细胞及组织移植奠定了基础。
参考文献
[1] Pierson RN III, Dorling A, Ayares D, Rees MA, Seebach JD, Fishman JA, Hering BJ, Cooper DKC. Current status of xenotransplantation and prospects for clinical application., 2009, 16(5): 263–280.
[2] Lai LX, Kolber-Simonds D, Park K-W, Cheong H-T, Greenstein JL, Im G-S, Samuel M, Bonk A, Rieke A, Day BN, Murphy CN, Carter DB, Hawley RJ, Prather RS. Production of α-1, 3-galactosyltransferase knockout pigs by nuclear transfer cloning., 2002, 295(5557): 1089–1092.
[3] Dai YF, Vaught TD, Boone J, Chen SH, Phelps CJ, Ball S, Monahan JA, Jobst PM, McCreath KJ, Lamborn AE, Cowell-Lucero JL, Wells KD, Colman A, Polejaeva IA, Ayares DL. Targeted disruption of the αl, 3-galactosyltransferase gene in cloned pigs., 2002, 20(3): 251–255.
[4] Phelps CJ, Koike C, Vaught TD, Boone J, Wells KD, Chen SH, Ball S, Specht SM, Polejaeva IA, Monahan JA, Jobst PM, Sharma SB, Lamborn AE, Garst AS, Moore M, Demetris AJ, Rudert WA, Bottino R, Bertera S, Trucco M, Starzl TE, Dai YF, Ayares DL. Production of α1, 3-galactosyltransferase-deficient pigs., 2003, 299(5605): 411–414.
[5] Kolber-Simonds D, Lai LX, Watt SR, Denaro M, Arn S, Augenstein ML, Betthauser J, Carter DB, Greenstein JL, Hao YH, Im G-S, Liu ZH, Mell GD, Murphy CN, Park K-W, Rieke A, Ryan DJ, Sachs DH, Forsberg EJ, Prather RS, Hawley RJ. Production of α-1, 3-galactosyltransferase null pigs by means of nuclear transfer with fibroblasts bearing loss of heterozygosity mutations., 2004, 101(19): 7335–7340.
[6] 郑道山, 冯冲, 朱彦宾, 龙川, 冯书堂, 潘登科, 马文丽. 利用启动子缺陷型打靶载体敲除五指山小型猪基因. 生物技术通讯, 2011, 22(4): 458–462.
[7] Tseng Y-L, Dor FJMF, Kuwaki K, Ryan D, Wood J, Denaro M, Giovino M, Yamada K, Hawley R, Patience C, Schuurman H-J, Awwad M, Sachs DH, Cooper DKC. Bone marrow transplantation from1, -3galactosyltransferase gene-knockout pigs in baboons., 2004, 11(4): 361–370.
[8] Shigeta T, Hsu H-C, Enosawa S, Matsuno N, Kasahara M, Matsunari H, Umeyama K, Watanabe M, Nagashima H. Transgenic pig expressing the red fluorescent protein kusabira-orange as a novel tool for preclinical studies on hepatocyte transplantation., 2013, 45(5): 1808–1810.
[9] Yamada K, Yazawa K, Shimizu A, Iwanaga T, Hisashi Y, Nuhn M, O'Malley P, Nobori S, Vagefi PA, Patience C, Fishman J, Cooper DKC, Hawley RJ, Greenstein J, Schuurman H-J, Awwad M, Sykes M, Sachs DH. Marked prolongation of porcine renal xenograft survival in baboons through the use of α1, 3-galactosyltransferase gene-knockout donors and the cotransplantation of vascularized thymic tissue., 2005, 11(1): 32–34.
[10] Kuwaki K, Tseng YL, Dor FJMF, Shimizu A, Houser SL, Sanderson TM, Lancos CJ, Prabharasuth DD, Cheng J, Moran K, Hisashi Y, Mueller N, Yamada K, Greenstein JL, Hawley RJ, Patience C, Awwad M, Fishman JA, Robson SC, Schuurman H-J, Sachs DH, Cooper DKC. Heart transplantation in baboons using α1, 3-galactosyltransferase gene-knockout pigs as donors: initial experience., 2005, 11(1): 29–31.
[11] Cooper DKC. A milestone in xenotransplantation research., 2014, 21(1): 13–15.
[12] 潘登科, 张莉, 周艳荣, 冯冲, 龙川, 刘晓, 董恩球, 王树臣, 万荣, 张健, 陈红星. 体细胞核移植生产转ω-3脂肪酸去饱和酶基因s克隆猪. 中国科学(C辑: 生命科学), 2009, 39(3): 295–302.
[13] Park K-W, Lai LX, Cheong H-T, Cabot R, Sun QY, Wu GM, Rucker EB, Durtschi D, Bonk A, Samuel M, Rieke A, Day BN, Murphy CN, Carter DB, Prather RS. Mosaic gene expression in nuclear transfer-derived embryos and the production of cloned transgenic pigs from ear-derived fibroblasts., 2002, 66(4): 1001–1005.
[14] Naruse K, Ishikawa H, Kawano H-O, Ueda H, Kurome M, Miyazaki K, Endo M, Sawasaki T, Nagashima H, Makuuchi M. Production of a transgenic pig expressing human albumin and enhanced green fluorescent protein., 2005, 51(4): 539–546.
[15] Cabot RA, Kühholzer B, Chan AWS, Lai LX, Park K-W, Chong K-Y, Schatten G, Murphy, CN, Abeydeera LR, Day BN, Prather RS. Transgenic pigs produced using in vitro matured oocytes infected with a retroviral vector., 2001, 12(2): 205–214.
[16] Lai LX, Park K-W, Cheong H-T, Kühholzer B, Samuel M, Bonk A, Im G-S, Rieke A, Day BN, Murphy CN, Carter DB, Prather RS. Transgenic pig expressing the enhanced green fluorescent protein produced by nuclear transfer using colchicine-treated fibroblasts as donor cells., 2002, 62(3): 300–306.
[17] Hofmann A, Kessler B, Ewerling S, Weppert M, Vogg B, Ludwig H, Stojkovic M, Boelhauve M, Brem G, Wolf E, Pfeifer A. Efficient transgenesis in farm animals by lentiviral vectors., 2003, 4(11): 1054–1058.
[18] Hyun S, Lee G, Kim D, Kim H, Lee S, Nam D, Jeong Y, Kim S, Yeom S, Kang S, Han J, Lee B, Hwang W. Production of nuclear transfer-derived piglets using porcine fetal fibroblasts transfected with the enhanced green fluorescent protein., 2003, 69(3): 1060–1068.
[19] Whitelaw CB, Radcliffe PA, Ritchie WA, Carlisle A, Ellard FM, Pena RN, Rowe J, Clark AJ, King TJ, Mitrophanous KA. Efficient generation of transgenic pigs using equine infectious anaemia virus (EIAV) derived vector., 2004, 571(1–3): 233–236.
[20] Watanabe S, Iwamoto M, Suzuki S-I, Fuchimoto D, Honma D, Nagai T, Hashimoto M, Yazaki S, Sato M, Onishi A. A novel method for the production of transgenic cloned pigs: electroporation-mediated gene transfer to non-cultured cells and subsequent selection with puromycin., 2005, 72(2): 309–315.
[21] Webster NL, Forni M, Bacci ML, Giovannoni R, Razzini R, Fantinati P, Zannoni A, Fusetti L, Dalpra L, Bianco MR, Papa M, Seren E, Sandrin MS, Mc Kenzie IFC, Lavitrano M. Multi-transgenic pigs expressing three fluorescent proteins produced with high efficiency by sperm mediated gene transfer., 2005, 72(1): 68–76.
[22] Yong HY, Hao YH, Lai LX, Li RF, Murphy CN, Rieke A, Wax D, Samuel M, Prather RS. Production of a transgenic piglet by a sperm injection technique in which no chemical or physical treatments were used for oocytes or sperm., 2006, 73(5): 595–599.
[23] 刘忠华, 宋军, 王振坤, 田江天, 孔庆然, 郑重, 尹智, 高力, 马海鹍, 孙爽, 李玉田, 王洪斌. 体细胞核移植生产绿色荧光蛋白转基因猪. 科学通报, 2008, 53(5): 556–560.
[24] 张鹏, 杨珍珍, 窦红伟, 李伟杭, 律波, Lars B, 杜玉涛, 谭萍萍, 马润林. 利用改进的手工克隆技术生产转GFP基因猪克隆胚胎. 遗传, 2011, 33(5): 527–532.
[25] Okabe M, Ikawa M, Kominami K, Nakanishi T, Nishimune Y. Green mice as a source of ubiquitous green cells., 1997, 407(3): 313–319.
[26] Hakamata Y, Tahara K, Uchida H, Sakuma Y, Nakamura M, Kume A, Murakami T, Takahashi M, Takahashi R, Hirabayashi M, Ueda M, Miyoshi I, Kasai N, Kobayashi E. Green fluorescent protein-transgenic rat: a tool for organ transplantation research., 2001, 286(4): 779–785.
[27] Takahashi R-I, Kuramochi T, Aoyagi K, Hashimoto S, Miyoshi I, Kasai N, Hakamata Y, Kobayashi E, Ueda M. Establishment and characterization of CAG/EGFP transgenic rabbit line., 2007, 16(1): 115–120.
Expression analysis of green fluorescent protein in tissues and organs in α-1,3 galactosyltransferase knockout pigs
Zhifang Li1,2, Chong Feng2, Huili Ji1,2, Ningning Shi2, Xiaofeng Song2, Qinli Zhao2, Chuan Long2, Dengke Pan2, Xiaogan Yang1
The pig is an ideal source to provide organs because its organ size and physiology are similar to humans. However, an acute rejection will ensue after pig-to-human xenotransplantation.The α-1,3 galactosyltransferase gene knockout (GTKO) pigs were generated in recent years, and could solve the problem of hyperacute rejection. But due to lack of reporting genes, the rejection status of cells and organs post pig-to-human xenotransplantation cannot be visualized. In this study, we introduced the enhanced green fluorescent protein (EGFP) gene driven by the CAG promoter into GTKO porcine ear fibroblasts. Then we produced transgenic pigs expressing the EGFP gene by nuclear transfer technology. Expression levels of EGFP in different tissues and organs of the cloned pig were investigated by Nightsea DFP-1 Fluorescent Protein Flashlight, fluorescence microscope and quantitative PCR assays. The results showed that the protein and transcript of EGFP were expressed in all tissues and organs of the GTKO pig, but the expression was weak in the liver and central nervous system. In conclusion, we have successfully produced the transgenic GTKO pigs expressing EGFP in all tested tissues and organs, which builds up a good basis to track transplanted cells or tissues.
GTKO; EGFP; pig; xenotransplation
2015-04-15;
2015-07-17
亚热带农业生物资源保护利用国家重点实验室开放课题(编号:SKL201404)和国家高技术研究发展计划(863计划)项目(编号:2012AA020601)资助
李智方,硕士研究生;专业方向:动物遗传育种与繁殖。E-mail:LIZHIFANG31@163.com
杨小淦,博士,副研究员;研究方向:动物繁殖生物技术。E-mail:xgyang@gxu.edu.cn潘登科,博士,副研究员;研究方向:转基因猪模型。E-mail:pandengke2002@163.com
10.16288/j.yczz.15-160
网络出版时间: 2015-8-12 9:49:52
URL: http://www.cnki.net/kcms/detail/11.1913.R.20150812.0949.008.html
(责任编委: 任军)
