东北特产许氏大酱中挥发性成分的提取与分析
2015-10-28孙洁雯杨克玉李燕敏刘玉平
孙洁雯,杨克玉,李燕敏,刘玉平
(食品营养与人类健康北京高精尖创新中心,食品质量与安全北京实验室,北京市食品风味化学重点实验室,北京工商大学,北京100048)
东北特产许氏大酱中挥发性成分的提取与分析
孙洁雯,杨克玉,李燕敏,刘玉平*
(食品营养与人类健康北京高精尖创新中心,食品质量与安全北京实验室,北京市食品风味化学重点实验室,北京工商大学,北京100048)
为了研究作为东北特产的许氏大酱的挥发性成分,采用同时蒸馏萃取法对许氏大酱挥发性成分进行提取,并考察了原料量和提取时间对结果的影响。提取物经气-质联用仪分析,结合计算保留指数和NIST11谱库检索,确定了许氏大酱中挥发性成分的种类,采用内标法确定了挥发性成分在许氏大酱中的含量。共鉴定出33种挥发性成分,在许氏大酱中含量为24.41 μg/g,包括酯类13种(8.24 μg/g)、醛类5种(11.74 μg/g)、杂环类4种(0.87 μg/g)、酮类3种(0.85 μg/g)、含硫化合物2种(0.36 μg/g)、其他类6种(2.35 μg/g)。其中3-甲基丁醛、2-甲基丁醛、乙酸乙酯含量较大,且香气活性值(OAV值)>1,且数值较高,属于许氏大酱特征性香气成分。此外,己醛、苯乙醛、3-辛酮、二甲基二硫、2,3-戊二酮、2-戊基呋喃虽含量较少,但OAV值>1,且数值较高,对许氏大酱整体香气贡献较大。
东北特产;许氏大酱;挥发性成分;同时蒸馏萃取(SDE);气-质联用(GC-MS);香气活性值(OAV值)
大酱又称黄豆酱、大豆酱、黄酱,我国北方地区称大酱[1]。东北特产许氏大酱是以龙江特等大豆为主要原材料,经过浸泡蒸煮后搅碎,自然接菌制成酱块后打碎入缸,加入盐水,经过几个月的天然发酵,最终形成的半流动状态的发酵性食品[2]。许氏大酱酱香浓郁,不仅美味可口,而且营养丰富。大酱经天然发酵后,大豆蛋白极易被人体吸收;而其中富含的磷、钙、铁等矿物质,也由于加工过程中酶的作用,更易被人体消化吸收[3]。
从20世纪80年代至今,对大酱的研究大多集中在微生物的检测和防腐效果的研究上,如徐鑫[1]等对农家大酱中耐盐性乳酸菌进行了分离与鉴定;刘岩[4]等研究了尼泊金酯在大酱中的防腐效果。但大酱的香气质量是其重要的感官指标,而对东北大酱中的挥发性香气成分进行系统的报道则很少,因此对其进行研究显得尤为必要。
同时蒸馏萃取(SDE)法提取挥发性成分对微量成分提取效率高,仅需要少量的溶剂就可以实现对挥发性成分的高效率萃取,并且具有良好的重复性和较高的萃取量,是一种行之有效的前处理方法[5]。香气活性值(OAV值)是香气物质的浓度与其阈值的比值,化合物的OAV值大于或者等于1,则认为该化合物对其香气有作用,且OAV值越大,对整体香气的贡献度就越大[6]。OAV值能够确切的体现该香成分对整体香气的作用。
本文采用同时蒸馏萃取(SDE)法结合气-质联用(GC-MS)分离鉴定东北特产许氏大酱的挥发性成分,分析比较原料用量和提取时间这两种因素对提取效果的影响,优化了提取条件,并采用内标法进行定量分析,结合OAV值,确定许氏大酱的特征性香成分,为许氏大酱的风味评价及工艺改进提供理论参考。
1材料与方法
1.1材料、试剂与仪器
1.1.1材料
许氏大酱(净含量100 g):黑龙江省双城市顺彩食品有限责任公司,生产日期为2015年4月2日。
1.1.2试剂
邻二氯苯(色谱纯,>98.0%)、无水硫酸钠(分析纯):国药集团化学试剂有限公司;99.5%二氯甲烷(分析纯)、99.5%甲醇(分析纯):北京化工厂;C5~C30正构烷烃混合物(色谱纯):美国Supelco公司。
1.1.3仪器
气相色谱-质谱联用仪(7890B-5977A):美国安捷仑公司;同时蒸馏萃取装置、精馏装置:肯堡博美(北京)实验器皿有限公司。
1.2挥发性成分提取方法
1.2.1内标溶液的配制
抽取100 μg邻二氯苯,打入100 mL容量瓶中,加入甲醇溶液稀释至刻度线,摇匀,待用。
1.2.2SDE法操作
取400 g许氏大酱,放入1 000 mL单口圆底烧瓶中,加入300 mL去离子水和适量沸石,放置于装置轻相端,油浴加热,温度在(125±1)℃范围内。另取50 mL重蒸二氯甲烷和适量沸石加入到100 mL圆底烧瓶中,放置于装置重相端,水浴加热,温度在(45±1)℃范围内,蒸馏萃取4 h后分离二氯甲烷相,用适量的无水硫酸钠干燥,过滤,精馏浓缩至约5 mL,再用氮气吹扫至1 mL,加入1 mL内标溶液混匀后,进行GC-MS检测,平行试验3次。
1.3分析方法
1.3.1GC-MS测定条件
色谱条件:HP-5 MS型色谱柱(30 m×250 μm× 0.25 μm),载气为He,载气流量为1.0 mL/min,进样口温度280℃;升温程序:起始温度40℃(保持2 min),以3℃/min的速度升到55℃,再以10℃/min的速度升到105℃,最后以15℃/min的速度升到300℃(保持2 min)。分流比为1 0∶1。
质谱条件:电子能量70 eV,EI源,离子源温度230℃,四极杆150℃,溶剂延迟1.8 min,全扫描模式,扫描质量范围为25 amu~500 amu。
1.3.2定性定量方法
定性方法:计算保留指数以及NIST11谱库检索保留指数计算公式[7]:
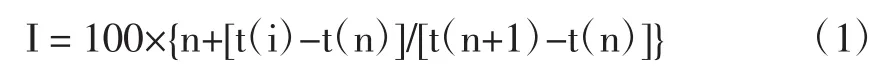
式中:n为碳数,t(i)为待测组分的调整保留时间;t(n)为具有n个碳原子的正构烷烃的调整保留时间;t(n+1)为具有(n+1)个碳原子的正构烷烃的调整保留时间。
定量方法:以邻二氯苯为内标,根据内标物的浓度、样品中各组分的峰面积与内标峰面积的比值,计算许氏大酱样品中各组分的含量,认定内标的因子为1[8]。
定量分析计算公式[9]:

式中:Ao为内标物邻二氯苯的峰面积;Ai为待测物质的峰面积;Co为内标溶液的质量浓度,(mg/mL);Ci为待测物质的质量浓度,(mg/mL);X为待测物质的含量,(mg/g);Vi为萃取液的体积,mL;no/i为混合液中所含的内标物体积与萃取液体积之比;ms为前处理前样品的质量,g。
2结果与讨论
2.1原料用量对提取效果的影响
选取原料用量分别为100、200、300、400、500 g,考察原料用量对提取效果的影响,结果见图1。
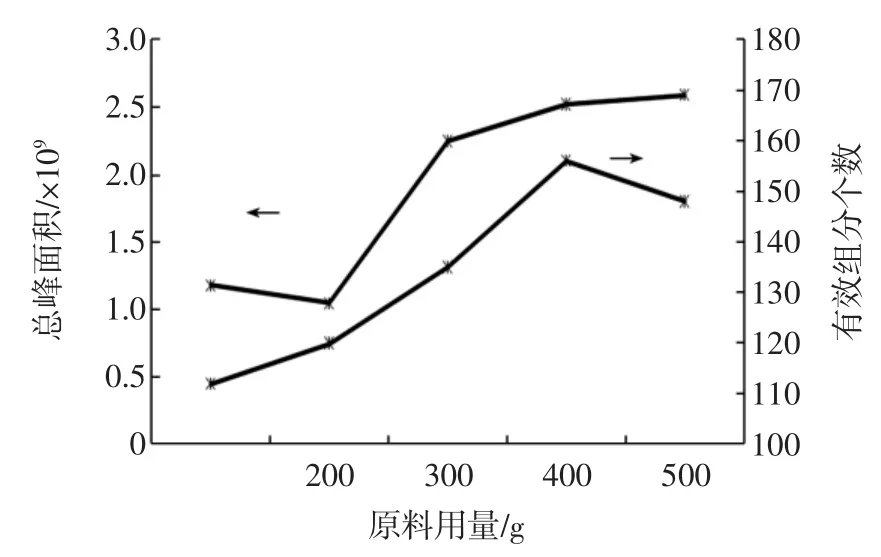
图1 原料用量对许氏大酱挥发性成分提取效果的影响Fig.1Effect of amount of raw materials on the extraction of volatile compounds from the XuShi soybean paste
由图1可见,从总峰面积和分离出的有效峰个数来看,原料量为100 g时,总峰面积以及提取的挥发性成分种类均较少,随着加入原料量的增大,挥发性成分种类增多,而总峰面积总体也呈增加趋势,在原料用量400 g时分离出的有效峰个数和总峰面积达到较大值。继续增加原料用量,总峰面积基本无太大变化,而挥发性成分的种类反而减少。这是因为去离子水的添加量固定不变,原料用量的增加会增大提取出的挥发性成分种类和含量,而当原料用量过多时,原料不能和去离子水充分混合,影响了提取效果。故原料用量为400 g时较适宜。
2.2提取时间对提取效果的影响
固定原料量400 g,分别选取提取时间为1、2、3、4、5 h,考察提取时间对提取效果的影响,结果见图2。
由图2可见,随着提取时间的增加,总峰面积和分离出的有效峰个数逐渐增大;提取时间达到4 h时,总峰面积和分离出的有效峰个数均达到较大值;提取时间继续增加,分离出的有效峰个数和总峰面积均减小。这是由于提取的挥发性成分大多是易挥发、低沸点的成分,提取时间较短时,萃取不完全;随着提取时间的增长,提取逐渐充分完全。而提取时间过长时,则会造成易挥发、低沸点成分的损失,或者使提取出来的成分之间发生反应;故提取时间为4 h时较为适宜。
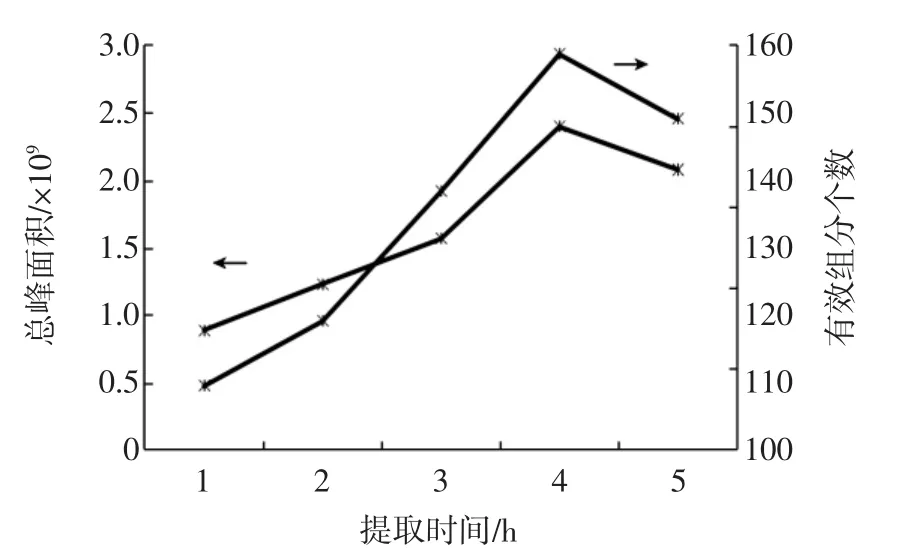
图2 提取时间对许氏大酱挥发性成分提取效果的影响Fig.2Effect of extraction time on the extraction of volatile compounds from the XuShi soybean paste
2.3挥发性成分分析
采用同时蒸馏萃取法对400 g许氏大酱提取4 h,结合GC-MS对得到的提取物进行定性分析,并采用内标法进行定量分析,所得总离子流图如图3所示,鉴定出的成分见表1。

图3 许氏大酱中挥发性成分总离子流图Fig.3Total ion chromatogram of volatile compounds from the XuShi soybean paste
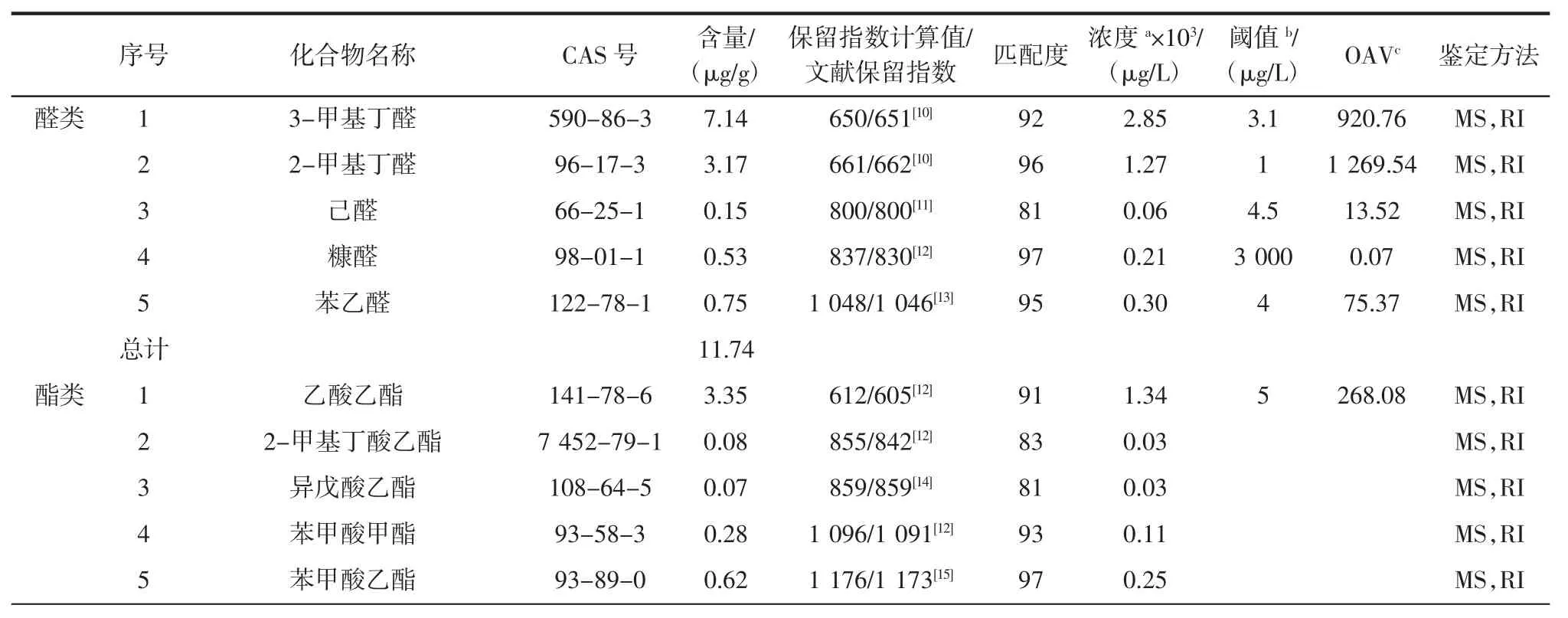
表1 许氏大酱中挥发性成分的GC-MS分析结果Table 1Results of GC-MS analysis of volatile constituents in XuShi soybean paste
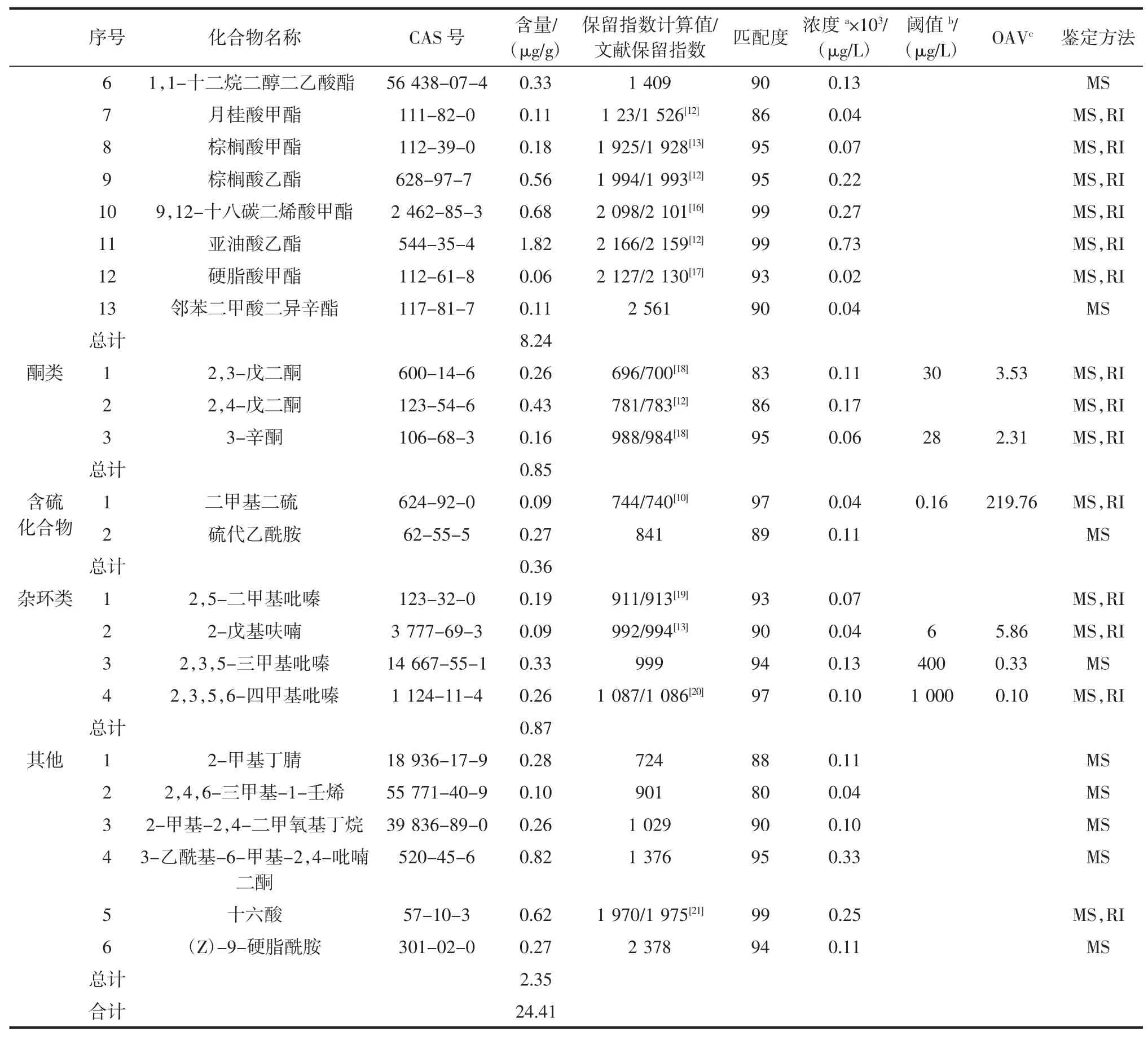
续表1许氏大酱中挥发性成分的GC-MS分析结果Continue table 1Results of GC-MS analysis of volatile constituents in XuShi soybean paste
由图3和表1可知,采用同时蒸馏萃取结合气-质联用提取分析东北特产许氏大酱的挥发性香气成分,共鉴定出33种挥发性成分,在许氏大酱中含量为24.41 μg/g,包括酯类13种(8.24 μg/g)、醛类5种(11.74 μg/g)、杂环类4种(0.87 μg/g)、酮类3种(0.85 μg/g)、含硫化合物2种(0.36 μg/g)、其他类6种(2.35 μg/g)。其中含量大于1 μg/g的化合物有:3-甲基丁醛(7.14 μg/g)、2-甲基丁醛(3.17 μg/g)、乙酸乙酯(3.35 μg/g)、亚油酸乙酯(1.82 μg/g)。
从鉴定出的成分含量来看,醛类化合物所占含量最多。并且醛类的阈值较低,对许氏大酱的整体香气有较大贡献。其中含量较大的3-甲基丁醛有强烈的辛辣刺激性气味,浓度极低时具有浓重的药草的、微带水果和坚果样的风味;而2-甲基丁醛具有强烈的窒息性气味,浓度低时有独特的可可和咖啡样的香气,且2-甲基丁醛和3-甲基丁醛的OAV值远>1,说明2-甲基丁醛和3-甲基丁醛为许氏大酱特征性香成分。而其他含量较小的醛类化合物,包括己醛具有青香;苯乙醛有近似风信子花香和甜香,己醛和苯乙醛含量虽小,但两者的OAV值也远>1,表明两者对许氏大酱的整体香气贡献也较大。醛类化合物的形成可能是发酵过程中放热引起不饱和脂肪酸的碳链氧化或者脱羧基而生成的[22]。
其次是酯类化合物,且酯类化合物的种类较多。其中含量较大的乙酸乙酯具有特有的乙醚样的气味,相似于菠萝的果香气,且乙酸乙酯的OAV值远>1,说明乙酸乙酯是许氏大酱的特征性香气成分。此外,2-甲基丁酸乙酯具有强烈苹果和菠萝香气;异戊酸乙酯具有苹果样的香气;苯甲酸甲酯带有水果微带依兰油香气;苯甲酸乙酯则稍有水果气味,近似于依兰香气,香气比苯甲酸甲酯柔和[23];亚油酸乙酯有油脂气息,可能是由于大豆中所含的亚油酸衍生而来;月桂酸甲酯具有近似于酒香的花香香气,正是由于SDE方法的萃取温度较高,使这些沸点较高的化合物被提取鉴定了出来。酯类化合物的形成可能是来源于微生物在发酵过程中的酶催化,或者是大酱中所含化合物的非酶催化的酯化反应。酯类化合物中的低级脂肪酸酯赋予了许氏大酱果香、花香和少许的酒香,而那些高级脂肪酸酯类由于它们的阈值较高,对许氏大酱的香气贡献不大。
酮类化合物中的2,3-戊二酮具有苯醌样微甜味、酒窖、黄油气味;3-辛酮具有水果微带薰衣草的气味,且2,3-戊二酮和3-辛酮虽含量小,但OAV值均>1,表明两者对许氏大酱的整体香气有所贡献。而含硫化合物中鉴定出的二甲基二硫阈值低,具有洋葱和萝卜气味,含量较小但OAV值远>1,表明二甲基二硫对许氏大酱的整体香气起了很大的贡献,为许氏大酱的特征性香气成分。而含硫化合物可能是由含硫氨基酸分解而成。酸类化合物和醇类化合物没有被检测出,可能是由于SDE法温度较高,酸类化合物与醇类化合物发生了非酶催化,进行了酯化反应。
杂环化合物阈值较低,较好的体现了许氏大酱的风味。其中2-戊基呋喃具有豆香、果香、泥土、青香及类似蔬菜的香韵,且OAV值>1,对许氏大酱整体香气起到一定的作用。2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪都具有坚果香、可可和咖啡的香气特点[24],吡嗪类化合物的生成,可能与发酵过程中微生物产生的的蛋白酶催化有关。上述化合物增加了许氏大酱的酱香、烤香,也使许氏大酱的整体香气透发浓郁。
3结论
1)采用同时蒸馏萃取法提取东北特产许氏大酱的挥发性成分,并考察了原料用量和提取时间对提取效果的影响。结果表明,原料用量为400 g、提取时间为4 h时较适宜。
2)在优化的条件下,采用SDE法提取并结合GCMS分析许氏大酱的挥发性成分,鉴定出33种挥发性成分,含量为24.41 μg/g;其中酯类化合物(8.24 μg/g)种类较多,有13种;而醛类化合物(5种)含量较多,为11.74 μg/g;另外还包括杂环类4种(0.87 μg/g)、酮类3种(0.85 μg/g)、含硫化合物2种(0.36 μg/g)、其他类6种(2.35 μg/g)。
3)根据分离鉴定出的挥发性成分的香气特证和所占含量,并结合OAV值,得出东北特产许氏大酱特征性香气成分有3-甲基丁醛、2-甲基丁醛、二甲基二硫、乙酸乙酯等。这些化合物赋予了许氏大酱果香、酱香、花香和少许的酒香。而其他化合物如吡嗪类化合物对许氏大酱的整体香气也有一定的贡献,使整体香气浓郁饱满。
[1]徐鑫,王茜茜,王晓蕊,等.传统农家大酱中耐盐性乳酸菌的分离与鉴定[J].食品与发酵工业,2014,40(11):33-40
[2]王成立.做好东北农家大酱[J].中国调味品,2007(8):56-57
[3]高秀芝,艾启俊,仝其根,等.传统豆酱和商品豆酱发酵过程中营养及理化指标动态[J].中国食品学报,2013,13(2):205-210
[4]刘岩,马春颖.尼泊金酯在酱油和大酱中防腐效果的研究[J].江苏调味副食品,2207,24(5):12-14
[5]黄香华,蒋立文,易灿.臭豆腐菌种鉴定、发酵及气味成分分析[J].农产品加工,2009(4):76-78
[6]何聪聪,苏柯冉,刘梦雅,等.基于AEDA和OAV值确定西瓜汁香气活性化合物的比较[J].现代食品科技,2014,30(7):279-285
[7]谢建春.现代香味分析技术及应用[M].北京:中国标准出版社,2008:17-18
[8]XIE Jianchun,SUN Baoguo,ZHENG Fuping,et al.Volatile flavor constituents in roasted pork of mini-pig[J].Food Chemistry,2008,109(3):506-51
[9]宋光林,杨昌彪,肖飞,等.内标-气相色谱法分析白酒中的正丙醇含量[J].贵州科学,2012,30(6):70-72
[10]Bonaiti C,Irlinger F,Spinnler H E,et al.An iterative sensory procedure to select odor-active associations in complex consortia of microorganisms:application to the construction of a cheese model[J]. Dairy Sci J,2005,88(5):1671-1684
[11]Skaltsa H D,Mavrommati A,Constantinidis T.A chemotaxonomic investigation of volatile constituents in Stachys subsect.Swainsonianeae(Labiatae)[J].Phytochemistry,2001,57(2):235-244
[12]Pino J A,Mesa J,Munoz Y,et al.Volatile components from mango(Mangifera indica L.)cultivars[J].J Agric Food Chem,2005,53(6): 2213-2223
[13]Zeng Y-X,Zhao C-X,Liang Y-Z,et al.Comparative analysis of volatile components from Clematis species growing in China,Anal[J].Chim Acta,2007,595(1/2):328-339
[14]Kim T H,Kim T H,Shin J H,et al.Characteristics of aroma-active compounds in the pectin-elicited suspension culture of Zanthoxylum piperitum(prickly ash)[J].Biotechnology Letters,2002,24(7): 551-556
[15]Zhao C X,Li X N,Liang Y Z,et al.Comparative analysis of chemical components of essential oils from different samples of Rhododendron with the help of chemometrics methods[J].Chemom Intell Lab Syst,2006,82:218-228
[16]Cho S-K,Abd El-Aty]A M,Choi J-H,et al.Optimized conditions for the extraction of secondary volatile metabolites in Angelica roots by accelerated solvent extraction[J].J Pharm Biomed Anal,2007,44(5):1154-1158
[17]Saroglou V,Dorizas N,Kypriotakis Z,et al.Analysis of the essential oilcompositionofeightAnthemisspeciesfromGreece[J].J Chromatogr A,2006,1104(1/2):313-322
[18]Vagionas K,Ngassapa O,Runyoro D,et al.Chemical analysis of edible aromatic plants growing in Tanzania[J].Food Chem,2007,105: 1711-1717
[19]Cerny C,Guntz-Dubini R.Role of the solvent glycerol in the MaillardreactionofD-fructoseandL-aniline[J].JAgricFoodChem,2006,54(2):574-577
[20]Ansorena D,Gimeno O,Astiasaran I,et al.Analysis of volatile compounds by GC-MS of a dry fermented sausage:chorizo de Pamplona[J].Food Res Int,2001,34:67-75
[21]Benkaci-Ali F,Baaliouamer A,Meklati B Y,et al.Chemical composition of seed essential oils from Algerian Nigella sativa extracted by microwave and hydrodistillation[J].Flavour Fragr J,2007,22(2): 148-153
[22]张玉玉,黄明泉,田红玉,等.“六必居”面酱挥发性成分SDE法提取及GC-MS分析[J].中国食品学报,2010,10(2):154-159
[23]朱瑞鸿,薛群成,李忠臣,等.合成食用香料手册[M].北京:中国轻工业出版社,1993:607
[24]孙宝国.食用调香术[M].北京:化学工业出版社,2003:121-140
Extraction and Analysis of Volatile Flavor Constituents of XuShi Soybean Paste as Northeast Special Product
SUN Jie-wen,YANG Ke-yu,LI Yan-min,LIU Yu-ping*
(Beijing Innovation Centre of Food Nutrition and Human Health,Beijing Laboratory for Food Quality and Safety,Beijing Key Laboratory of Flavor Chemistry,Beijing Technology and Business University,Beijing 100048,China)
The characteristic aroma components in XuShi soybean paste as Northeast Special Product were extracted by simultaneous distillation-extraction(SDE).The operating conditions of SDE were optimized for their effect on the analysis of flavors,including amount of raw materials and extraction time.Based on the calculated retention indices and RI qualitative analysis,33 compounds were identified in XuShi soybean paste,Their total content in XuShi soybean paste was 24.41 μg/g.These compounds included 13 esters(8.24 μg/g),5 aldehydes(11.74 μg/g),4 heterocyclic compounds(0.87 μg/g),3 ketones(0.85 μg/g),2 sulfur-containing ethers(0.36 μg/g),6 other compounds(2.35 μg/g).The major aroma components were 3-Methyl-butanal,2-Methyl-butanal,ethyl acetate.Hexanal,benzeneacetaldehyde,3-Octanone,dimethyl disulfide,2,3-Pentanedione,2-Pentyl furan made a greater contribution to the odor characteristics of XuShi soybean paste.
northeast special product;XuShi soybean paste;volatile compounds;simultaneous distillationextraction(SDE);gas chromatography-mass spectrometry(GC-MS);odour active values(OAV)
10.3969/j.issn.1005-6521.2015.14.029
2015-06-25
孙洁雯(1990—),女(汉),硕士研究生,研究方向:香料化学与应用。
