广西红树林根际土壤放线菌的原位培养分离及其活性筛选
2015-10-22姜明国甘光华杨立芳李西妮杨桂柳庹利孙承航黄玲蓝金枝
姜明国,甘光华,杨立芳,李西妮,杨桂柳,庹利,孙承航,黄玲,蓝金枝
(1.广西红树林保护与利用重点实验室,广西北海536000;2.广西民族大学广西高校微生物与植物资源利用重点实验室,广西南宁530008;3.广西民族大学化学化工学院广西林产化学与工程重点实验室,广西南宁530008;4.中国医学科学院/北京协和医学院医药生物技术研究所,北京100050)
广西红树林根际土壤放线菌的原位培养分离及其活性筛选
姜明国1,2,甘光华1,2,杨立芳3*,李西妮2,杨桂柳2,庹利4,孙承航4,黄玲3,蓝金枝3
(1.广西红树林保护与利用重点实验室,广西北海536000;2.广西民族大学广西高校微生物与植物资源利用重点实验室,广西南宁530008;3.广西民族大学化学化工学院广西林产化学与工程重点实验室,广西南宁530008;4.中国医学科学院/北京协和医学院医药生物技术研究所,北京100050)
为了发掘广西红树林根际土壤的放线菌资源,本文利用原位培养装置,埋于根际土壤中俘获放线菌,30 d后取回实验室,采用平板涂布法对4个地点的原位培养样品于15种培养基上进行分离纯化;对分离株基于16S rR N A基因序列进行系统发育分析;进一步进行抗菌活性和产酶活性检测。共分离得到113株放线菌。对其中33株放线菌进行测序,结果表明20株属于链霉菌属,11株属于拟诺卡氏菌属,1株属于伦兹氏菌属,1株与拟诺卡氏菌属相似性最高为90%,很可能属于放线菌一个新属。抗菌实验结果显示其中有7株、4株、18株、6株、10株、3株实验菌株分别对大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌、普通变形杆菌、乙型溶血性链球菌和肺炎克雷伯氏菌具有抑制作用;有55株、62株、24株、72株的实验菌株分别具有纤维素酶活性、淀粉酶活性、胶原蛋白酶活性、酯酶活性。原位培养可以丰富对广西红树林根际土壤的认识,分离到了新种甚至可能是新属的放线菌,分离得到的部分放线菌菌株具有较高生物活性,为后续工作提供了良好的实验材料。
原位培养;红树林;根际土壤;放线菌;生物活性
姜明国,甘光华,杨立芳,等.广西红树林根际土壤放线菌的原位培养分离及其活性筛选[J].海洋学报,2015,37(2):55—64,doi:10.3969/j.issn.0253-4193.2015.02.006
Jiang Mingguo,Gan Guanghua,Yang Lifang,et al.In situisolation of actinomycetes and screening bioactive potential from mangrove rhizosphere soi ls in Guangxi[J].Haiyang Xuebao,2015,37(2):55—64,doi:10.3969/j.issn.0253-4193.2015.02.006
1 引言
分布于热带、亚热带海岸潮间带的木本植物群落称之为红树林,是海洋向陆地的过渡带。红树林是至今世界上少数几个物种最多样化的生态系之一,有着不同于陆地的性质:水分高、盐分高以及氧气缺乏,其地下部分的微生物较之其他生态系统有很大的差异,这就赋予了红树林土壤微生物产生活性物质的潜在可能性[1]。广西红树林面积占全国红树林面积的三分之一,蕴藏着巨大的海洋微生物资源。
目前,科研工作者能在实验室条件下培养出来的微生物,只占到微生物总体的0.1%~1%,绝大部分的微生物不能通过传统的培养方法获得[2]。模拟自然环境和保持微生物间的共生关系是提高微生物培养具备共性的关键问题,目前开发新的策略培养传统“不可培养”微生物的需求十分迫切。探索更加有效的分离方法,从海洋等极端环境中分离筛选活性菌株已成为当前微生物资源开发利用的重要研究方向[2—3]。原位培养即构建模拟微生物生存的环境系统。目前可以使用“扩散室”和“载体”两种类型的原位培养模式[4—5]。A oi等设计了一种中空纤维膜室培养装置,能同时用于多个简单样品的纯培养[6]。Gavrish等采用这种扩散室装置成功的对特殊和稀有放线菌进行了培养分离[7]。Lewis和Nichols等采用高通量的“扩散室”培养以前未能培养的微生物,发现的新种远远多于用传统培养皿进行培养[8—9]。可见原位培养方法在微生物的研究领域具有巨大的潜力。
目前关于红树林根际土壤放线菌的分离培养大多采用传统的分离方法,采用原位培养法进行放线菌分离培养未见报道。我们利用放线菌产生菌丝的特点制作放线菌原位俘获装置,置于不同品系的红树林根际土壤中进行共培养,旨在培养出传统分离培养方法不能分离培养的红树林根际土壤放线菌。并对所分离到的放线菌进行生物活性评价,为后续海洋放线菌次生代谢产物的研究奠定基础。
2 材料和方法
2.1材料
2.1.1实验地点
广西山口红树林保护区、北海红树林育种中心、广西合浦老鼠簕红树林和东兴北仑河口红树林保护区。

表1 广西红树林原位培养放线菌埋样地点Tab.1 Description ofin situcultivation sites
2.1.2培养基:
原位培养基:琼脂粉30%,海水1 L,自然p H值。
分离培养基:配制以下15种培养基,海水定容至1 L,自然p H值用于菌株分离。
A.酵母膏-麦芽膏培养基(Y E M E):酵母粉4 g,麦芽浸出粉10 g,葡萄糖4 g,琼脂18 g;
B.改良E merson培养基:葡萄糖1 g,酵母粉1 g,蛋白胨4 g,氯化钠2.5 g,琼脂18 g;
C.2216E培养基:蛋白胨5 g,酵母粉1 g,磷酸高铁0.1 g,琼脂18 g;
D.M 1培养基:可溶性淀粉10 g,酵母粉4 g,蛋白胨2 g,琼脂18 g;
E.ISP2培养基:葡萄糖4 g,酵母粉4 g,麦芽浸出粉10 g,碳酸钙2 g,琼脂18 g;
E.酪蛋白-酵母浸汁培养基:酪蛋白7.5 g,酵母浸汁10 g,七水硫酸镁2 g,柠檬酸钠3 g,氯化钾2 g,氯化钠2 g,琼脂18 g;
G.H V G培养基:腐植酸1 g,磷酸氢二钠0.5 g,七水硫酸镁0.05 g,七水硫酸亚铁0.01 g,碳酸钙0.02 g,维生素B母液1 ml,琼脂18 g;
H.SC培养基:可溶性淀粉10 g,酪蛋白1 g,琼脂18 g;
I.葡萄糖-天门冬素琼脂培养基:葡萄糖10 g,天门冬素0.5 g,磷酸氢二钾0.5 g,七水硫酸镁0.5 g,琼脂18 g;
G.无机盐琼脂培养基:可溶性淀粉20 g,磷酸氢二钾0.5 g,七水硫酸镁0.5 g,硝酸钾1 g,七水硫酸亚铁0.01 g,琼脂18 g;
K.改良ISP5培养基:酵母膏5 g,L-门冬酰胺1 g,甘油10 g,磷酸氢二钾1 g,硝酸钾5 g,微量盐1 m L,琼脂18 g;
L.甘油琼脂培养基:蛋白胨5 g,酵母膏3 g,甘油20 g,琼脂18 g;
M.G Y ESA培养基:葡萄糖10 g,酵母膏10 g,可溶性淀粉10 g,氯化钠5 g,碳酸钙3 g,琼脂18 g;
N.高氏一号培养基:可溶性淀粉20 g,硝酸钾1 g,磷酸氢二钾0.5 g,七水硫酸镁0.5 g,氯化钠0.5 g,七水硫酸亚铁0.01 g,琼脂18 g;
O.察氏培养基:硝酸钠3 g,磷酸氢二钾1 g,氯化钾0.5 g,七水硫酸亚铁0.01 g,七水硫酸镁0.5 g,蔗糖30 g,琼脂18 g;
纯化培养基:ISP2培养基:葡萄糖4 g,酵母粉4 g,麦芽浸出粉10 g,碳酸钙2 g,琼脂18 g,海水加至1 L,自然p H值。
以上所有培养基在冷却至55°C左右时加入终浓度为100μg/m L的重铬酸钾作为细菌和真菌的抑制剂。
生物活性检测培养基:
(1)淀粉水解培养基:可溶性淀粉10 g,磷酸氢二钾0.3 g,氯化钠0.5 g,七水硫酸镁1 g,硝酸钾1 g,琼脂18 g,蒸馏水1 L,p H 7.2~7.4。
(2)明胶培养基:蛋白胨5 g,葡萄糖20 g,明胶200 g,蒸馏水1 000 m L,p H 7.2~7.4。
(3)酯酶活性筛选培养基:吐温-80为10 g,硝酸铵1 g,氯化钙0.1 g,磷酸氢二钾0.5 g,氯化铁0.02 g,磷酸二氢钾0.5 g,七水硫酸镁0.5 g,氯化钠1.0 g,蒸馏水1 L,p H 7.0~7.2。
(4)纤维素酶活性筛选培养基:微晶纤维素8 g,硝酸铵1 g,氯化钙0.1 g,磷酸氢二钾0.5 g,氯化铁0.02 g,磷酸二氢钾0.5 g,酵母粉0.05 g,七水硫酸镁0.5 g,氯化钠1 g,蒸馏水1 L,p H 7.0~7.2。
2.1.3指示菌株
大肠埃希氏杆菌(E.coliC M CC 44102)、铜绿假单胞菌(P.aeruginosaC M CC 10104)、金黄色葡萄球菌(S.aureusC M CC 26003)、普通变形杆菌(P.vulgarisC M CC 49027)、乙型溶血性链球菌(β-StreptococcusAT CC 21059)和肺炎克雷伯氏菌(K.pneumoniae C M CC 46117)。以上6株指示菌株由本实验室保藏。
2.1.4主要试剂
P G E M-T Easy Vector(Promega),琼脂粉,葡萄糖,酵母粉,麦芽浸出粉,可溶性淀粉,琼脂糖,异丙醇,乙醇,胰蛋白胨等,试剂均为分析纯。
2.1.5仪器
L D Z X-50 K BS立式压力蒸汽灭菌器,H PS-250生化培养箱,L E G E N DM IC R017离心机,格兰特X B70制冰机,H R-7803D微波炉,H H-6数显恒温水浴锅,JY-600电泳仪,BIO-R A D凝胶成像分析仪,BIO-R A D PC R仪,Supra 55 Sapphire型扫描电子显微镜等。
2.2放线菌分离与纯化
2.2.1原位培养装置的制作
将已灭菌的0.22μm的亲水性下滤膜(购自Mi ll ipore中国有限公司)用502胶水与已灭菌的不锈钢圈贴好,向中空内环倒入约3 m L原位培养基,待培养基冷却凝固后,将亲水性上滤膜和不锈钢圈用胶水密封(图1)。
2.2.2埋原位培养装置
将原位培养装置埋于红树林根际附近土壤中,深度为5~10 cm,每个地点都埋50个原位培养装置。整个埋样过程及取样后处理如图2所示。
2.2.3放线菌的分离纯化
30 d后将原位培养装置取回清洁后,将原位培养基转移到无菌1.5 m L的E P管中,加入无菌水,将原位培养基捣碎并充分与无菌水混匀,吸取混悬菌液100μL涂布于15种分离培养基上,置28℃恒温培养箱中培养6~15 d。将形态较典型的放线菌菌落挑出,经过3~5次平板划线分离纯化后转种到ISP2斜面培养基中保存,编号后置于4°C冰箱中保存备用。
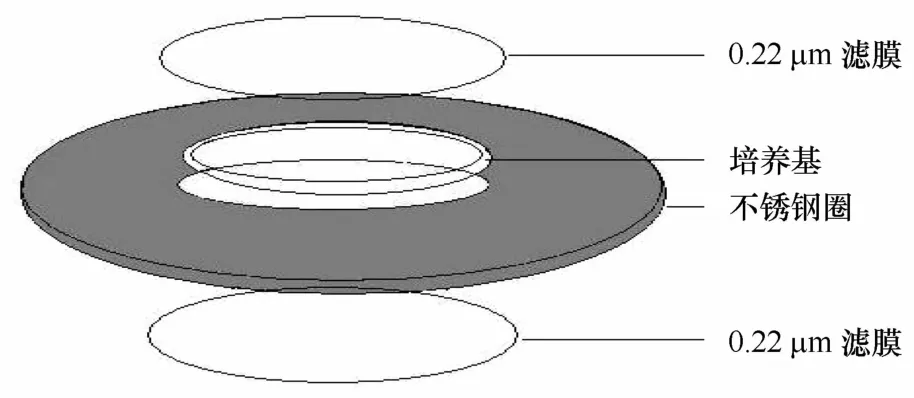
图1 放线菌原位俘获装置Eig.1 Actinobacteriain situcultivation trap

图2 原位培养装置的使用:埋样前(a)、取样中(b)、清理后(c)Eig.2 Appl ication of thein situcultivation chambers:general view of the chambers(a),the chambers in use(b),after the clean-up(c)
2.3放线菌16S rRNA基因序列测定及系统发育分析
采用微波热震荡[10]提取放线菌基因组D N A,16S rR N A基因序列的PCR扩增,使用以下两个通用引物:27E:5′-A G A G T T T G AT CC T G G C T C A G-3′,1492R:5′-A A G G A G G T G AT CC A G CC G C A-3′(由上海捷瑞公司合成),PCR扩增反应体系(25μL):引物(10μmol/L)各0.5μL,模板D N A(50~100 ng)1μL,2×PCR Master Mix 12.5μL,加无菌双蒸水补至25μL。PC R反应条件为:95℃预变性4 min;95℃变性1 min,55℃复性1 min,72℃延伸1 min,30个循环;最后72℃温育10 min。扩增产物用1.2%琼脂糖凝胶检测。PCR扩增产物经电泳检测后,进行切胶纯化,用T载体置于4℃冰箱过夜连接,将菌株的16S rR N A转化到E.coli(T OP10E′),经氨苄筛选阳性克隆,随机挑取阳性克隆子于37℃在含有氨苄的LB液体培养基摇床220 r/min,37°C培养15 h。用T7引物:5′-TA ATA C G A C T C A C TATA G G G-3′,SP6引物:5′-AT T TA G G T G A C A C TATA G-3′)进行PC R,电泳检测有目的条带的菌液送到生工生物工程股份有限公司进行测序。
将测序得到的基因序列运用BL AST程序在GenBank数据库中进行同源性分析。利用M E G A5软件,采用邻接法(Neighbor-Joining method)构建系统进化发育树。
2.4菌株生物活性检测
2.4.1菌株抑菌活性检测
选用以上6株指示菌株进行放线菌抗菌活性试验。所有细菌指示菌株都用ISP2培养基培养,采用点植法培养7 d后,观察抑菌圈并测量抑菌圈的直径。
2.4.2菌株酶活检测
采用用点植法培养7 d后,通过Lugol碘液检测淀粉酶活性,通过观察透明圈检测胶原蛋白酶和脂肪酶活性,通过观察菌落四周澄清的晕环检测纤维素酶活性。
3 结果和分析
3.1原位培养装置俘获放线菌的效果
取回原位培养装置后,将原位培养基取出,置于倒置显微镜中观察,可以看到许多具有分枝状菌丝的菌落分散在原位培养基内。根据菌落的形态初步判断原位培养基内的菌落为放线菌。将原位培养基菌悬液涂布后,可得到较多的放线菌菌落,并且无细菌和真菌的出现(图3)。表明所采用的原位培养装置能较为单一地俘获放线菌并且效果良好。值得注意的是,有部分原位培养装置的滤膜遭虫蚀而破损、胶水粘得不牢固导致脱落损坏或取样的时候被不小心戳破造成了一定的污染,这是值得改进的地方。

图3 原位培养基菌悬液涂布分离放线菌的效果Eig.3 Isolation plates of actinomycetes,which were spread within situcultivation medium suspensions and incubated at 28°C for 6 to 15 d
3.2放线菌分离结果
采用原位培养方法从广西山口红树林保护区、北海红树林育种中心、广西合浦老鼠簕红树林和东兴北仑河口红树林保护区分别得到22株、20株、70株和1株,总共获得113株放线菌。放线菌菌落大多气生菌丝发达,菌落致密干燥,菌落颜色多为白色,其次为灰色,有少数菌株菌落为红色或嫩黄色。其中分离到的放线菌G X U N10可能是放线菌新菌株(图4)。
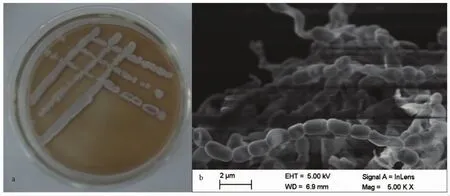
图4 放线菌G X U N10的菌落形态(a)及其电镜图(b)Eig.4 Colony morphology(a)and electron micrograph(b)ofisolate G X U N10
3.3不同培养基分离放线菌的效果
图5是不同培养基分离的放线菌数量的比较,培养基种类标号来源于分离培养基的编号。结果表明,ISP2培养基分离得到的红树林根际土壤放线菌菌株数量最多,其次是M 1培养基和无机盐琼脂培养基,H V G培养基、改良ISP5培养基和甘油琼脂培养基分离得到的菌株数量最少。由于不是唯一碳源培养基,所以不能确定哪种碳源对分离放线菌最有优势,但也可以看出,所选用的15种分离培养基中ISP2培养基、M 1培养基和无机盐琼脂培养基最适合用来分离红树林根际土壤放线菌。
3.4广西红树林根际土壤放线菌的多样性
用上述15种分离培养基从广西4个地方的红树林原位培养样品中分离并保藏放线菌113株,测序了33株。测得33株放线菌菌株的16S rR N A基因序列全长接近1 490 bp。用BL AST软件从GenBank数据库中搜索相似序列,然后采用邻接法构建放线菌与其相关菌株的系统发育树,结果(见图6)显示,33株放线菌分布于放线菌亚纲3个目3个科的4个属。链霉菌目Streptomycineae中的链霉菌科Streptomycetaceae中的链霉菌属Streptomyces20株;链孢囊菌目Streptosporangineae拟诺卡氏菌科Nocardiopsaceae中拟诺卡氏菌属Nocardiopsis11株;假诺卡氏菌目Pseudonocardineae中的假诺卡氏菌科Actinosynnemataceae中的伦兹氏菌属Lentzea1株;另外一株编号为G X U N10的放线菌在基于16S rR N A基因序列构建的系统发育树上独立划分为一个分支,与链孢囊菌目中NocardiopsisalbaPC M 2702的序列相似性最高,但相似性仅为90%,所以G X U N10很可能为链孢囊菌目Streptosporangineae中的新科或新属[11]。该菌的多相分类学研究工作正在进行中。
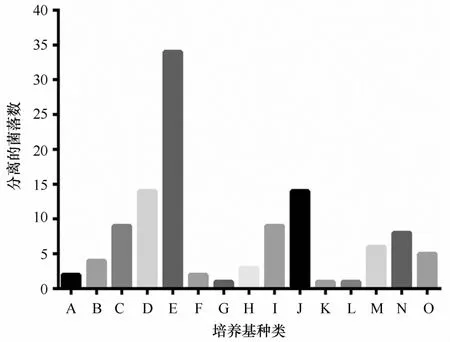
图5 不同培养基分离到的红树林根际土壤放线菌菌落数对比Eig.5 Isolate numbers of marine actinobacteria on different media

图6 邻接法构建基于16S rR N A基因序列的系统发育树Eig.6 Phylogenetic neighbour-joining tree based on the 16SrR N A gene sequences of the isolated strains
3.5生物活性检测结果
3.5.1菌株抑菌活性检测结果
对113株红树根际土壤放线菌进行了抗细菌活性的初步检测,发现47株放线菌样品在一种或多种指示菌筛选中显示为阳性(表2),初筛阳性率为41.59%。有6.19%、3.54%、15.93%、5.31%、8.85%、2.65%的实验菌株分别对大肠埃希氏杆菌、铜绿假单胞菌、金黄色葡萄球菌、普通变形杆菌、乙型溶血性链球菌和肺炎克雷伯氏菌具有抑制作用。其中,源于广西山口红树林保护区(Shankou)的22株菌中,初筛阳性菌株为5株,阳性率为22.73%;源于北海红树林育种中心(Yuzhong)的20株菌中,初筛阳性菌株为11株,阳性率为55.00%;源于广西合浦老鼠簕红树林(Hepu)的70株菌中,初筛阳性菌株为31株,阳性率为44.29%;源于东兴北仑河口红树林保护区(Dongxing)的1株菌中,初筛无阳性菌株。在47株阳性菌株中,对革兰氏阳性细菌金黄色葡萄球菌和乙型溶血性链球菌具有抑菌作用的有27株,占阳性菌株的57.45%,占总菌株的23.89%;对所试验的4种革兰氏阴性细菌具有抑菌作用的有20株,占阳性菌株的42.55%,占总菌株的17.70%。

表2 菌株的抑菌活性筛选结果Tab.2 Antimicrobial activity of actinomycetes form Guangxi mangrove rhizosphere
3.5.2菌株酶活检测结果
产酶实验结果表明(表3),在所检测的113株红树林根际土壤放线菌,有87株至少具有一种酶活,其中具有纤维素酶活性、淀粉酶活性、胶原蛋白酶活性、酯酶活性菌株分别为48.67%、54.87%、21.24%、 63.71%。另外,有70株具有至少2种以上酶活特性,占活性菌株的80.46%,占总菌株的61.95%;有46株具有3种以上酶活特性,占活性菌株的52.87%,占总菌株的40.71%;有8株具有4种酶活特性,占活性菌株的9.20%,占总菌株的7.08%。
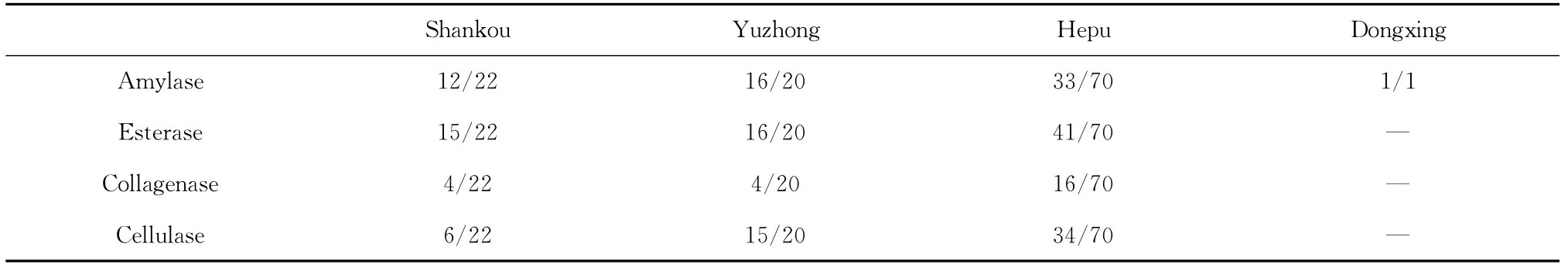
表3 菌株的产酶活性筛选结果Tab.3 Enzyme activity of actinomycetes form Guangxi mangrove rhizosphere
4 讨论
国内一些研究小组对广西北部湾海域红树林共生和附生的放线菌开展过研究,如中国热带农业科学院生物技术所H ong等采集广西26份红树林样本,分离到了93株放线菌[12]。同样是该研究小组2007年从广西的红树林区采集了71个样品,不进行微生物分离而直接发酵,取发酵上清液进行抗细菌、抗真菌与肿瘤细胞毒活性的测定,结果显示:29.6%的样品具有生物活性,仅次于取自海口的样品(34.1%),在所有来自全国各地的样品中仅在广西北海古城岭的样品中检测到肿瘤细胞细胞毒活性[13]。中国医学科学院医药生物技术研究所魏玉珍等从广西山口国家红树林生态自然保护区采集8种真红树植物和5种半红树植物,采用8种分离培养基,分离到118株放线菌。对77株阳性菌株分类表明44株属于链霉菌属,25株为小单孢属的菌株,3株属于糖丝菌属,3株为诺卡氏属菌株,1株是拟诺卡氏属菌株,1株是伦茨氏菌属的菌株[14]。广西大学梁静娟等和桂林医学院骆耐香等也对红树林放线菌开展了部分研究[15—16]。这些研究结果表明广西红树植物环境孕育了丰富多样的放线菌,但从分离方法上看,并没有全面系统地反映广西北部湾海域海洋放线菌即便是红树林共生和附生的放线菌真实面目。
传统分离培养法为了尽量杀灭细菌和真菌、使土壤放线菌孢子尽量分散,大多采用强化学试剂、强物理震荡或高温干热处理,如超声波处理法[17]、干热处理法[18]、D DC法[19]和微波处理法[20]等,尚无采用原位培养法[21]进行放线菌分离培养的报道。传统分离培养红树林土壤放线菌的方法大多比较激烈,并且使土壤放线菌离开它们原本生活的环境,放线菌的环境生长因子、营养成分势必也随之改变,可能对部分对环境要求苛刻的放线菌造成巨大伤害,从而不能分离培养这部分放线菌。而原位培养法能尽量在不改变微生物的生长环境和条件的情况下,将原位培养装置置于红树林根际土壤中,让放线菌菌丝生长进入原位培养装置中,从而将放线菌俘获。在实验室进一步用多种不同的培养基将俘获的放线菌分离、多次纯化从而得到纯培养的放线菌。原位培养法是在放线菌生长的大环境中与放线菌共培养,温和而不刺激,为分离新放线菌提供了可能。
本实验室设计的原位培养装置是在Lewis等[8]的设计的基础上进行改进的,Lewis K设计的原位培养装置是为了在实验室将原位培养装置置于土壤样品表面,俘获透过下滤膜进入原位培养装置的土壤放线菌。为了隔绝空气中的菌体透过滤膜进入到原位培养装置中上滤膜选择0.03μm孔径,选择孔径为0.2μm的下滤膜紧贴土壤表面,土壤中的放线菌菌丝可以透过下滤膜进入到原位培养基中生长。为了俘获土壤中的放线菌,我们设计了可以在真实环境埋入泥土中俘获土壤放线菌的原位培养装置:上下滤膜都选用孔径0.22μm的滤膜。这样原位培养装置上面及下面的放线菌菌丝都能进入原位培养装置中,从而被俘获。本研究成功俘获分离113株放线菌,选取33株典型的放线菌提取其基因组D N A,扩增其16S rR N A基因,克隆后成功测序。33株放线菌中的32株隶属于3个不同菌属,其中链霉菌属最多,占62.5%;拟诺卡氏菌属占34.375%;伦兹氏菌属占3.125%。得到一株G X U N10很可能隶属于放线菌一个新分类单元。这表明原位培养装置埋于红树林根际土壤放线菌原本生活的环境俘获放线菌的可行性,为国内放线菌研究者寻找新的放线菌资源提供了新的参考途径。并且我们用原位培养法所分离到的放线菌具有较好的抑菌活性和酶活活性,为后续放线菌次生代谢产物的进一步研究奠定了良好的基础。
[1]徐丽华,李文均,刘志恒,等.放线菌系统学[M].北京:科学出版社,2007:19.
Xu Lihua,Li W enjun,Liu Zhiheng,et al.Systematics of Actinobacteria[M].Bei j ing:Science Press,2007:19.
[2]Alain K,Querel lou J.Cultivating the uncultured:l imits,advances and future chal lenges[J].Extremophi les,2009,13(4):583-594.
[3]Eerrari B C,Binnerup S J,Gi ll ings M.Microcolony cultivation on a soi l substrate membrane system selects for previously uncultured soi l bacteria[J].Appl Environ Microbiol,2005,71(12):8714-8720.
[4]Yasumoto-Hirose M,Nishi j ima M,Ngirchechol M K,et al.Isolation of marine bacteria byinsituculture on media-supplemented polyurethanefoam[J].Mar Biotechnol,2006,8(3):227-237.
[5]Bol lmann A,Lewis K,Epstein S S.Incubation of environ mentalsamplesin a diffusion chamberincreasesthe diversity ofrecoveredisolates[J].Appl Environ Microbiol,2007,73(20):6386-6390.
[6]Aoi Y,Kinoshita T,Hata T,et al.H ollow-fiber membrane chamber as a device forin situenviron mental cultivation[J].Appl Environ Microbiol,2009,75(11):3826-3833.
[7]Gavrish E,Bol lmann A,Epstein S,et al.A trap for in situ cultivation of fi lamentous actinobacteria[J].J Microbiol M ethods,2008,72(3):257-262.
[8]Lewis K,Epstein S,D'Onofrio A,et al.U ncultured microorganisms as a source of secondary metabol ites[J].The Journal of Antibiotics,2010,63:468-476.
[9]Nichols D,Cahoon N,Trakhtenberg E M,et al.Use ofIchip for high-throughputin situ cultivation of“uncultivable”microbialspecies[J].Appl En-viron Microbiol,2010,76(8):2445-2450.
[10]徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组D N A[J].微生物学通报,2003,30(4):82-84.
Xu Ping,Li W enjun,Xu Lihua,et al.A microwave-based method for genomic D N A extraction from actinomycetes[J].Microbiology China,2003,30(4):82-84.
[11]Stackebrandt E,Goebel B M.Taxonomic Note:A placefor D N A-D N A reassociation and 16S rR N A sequence analysisin the present species definition in bacteriology[J].Int J Syst Bacteriol,1994,44(4):846-849.
[12]Hong K,Gao A H,Xie Q Y,et al.Actinomycetes for marine drug discovery isolated from mangrove soi ls and plantsin China[J].Marine Drugs,2009,7(1):24-44.
[13]刘颖,洪葵,庄令,等.红树林样品不经分离的微生物群体培养物生物活性研究[J].微生物学报,2007,47(1):110-114.
Liu Ying,Hong Kui,Zhuang Ling,et al.Bioactivity survey of natural microbial consortiu m from mangrove[J].Acta Microbiologica Sinica,2007,47(1):110-114.
[14]魏玉珍,张玉琴,赵莉莉,等.广西山口红树林内生放线菌的分离、筛选及初步鉴定[J].微生物学通报,2010(6):823-828.
W ei Yuzhen,Zhang Yuqin,Zhao Li l i,et al.Isolation,screening and prel iminary identification of endophytic actinobacteria from mangroves at Shankou of Guangxi province[J].Microbiology China,2010(6):823-828.
[15]梁静娟,庞宗文,詹萍.红树林海洋细菌的分离鉴定及其活性物质初步分析[J].热带海洋学报,2006,25(6):47-51.
Liang Jingjuan,Pang Zongwen,Zhan Ping.Isolation and identification of mangrove marine bacteria and analysis of their bioactive products[J]. Journal of Tropical Oceanography,2006,25(6):47-51.
[16]骆耐香,陈森洲,袁桂峰,等.广西沿海地区红树林根系土壤中放线菌的分离与鉴定[J].基因组学与应用生物学,2010,29(2):310-313.
Luo Naixiang,Chen Senzhou,Yuan Guifeng,et al.Isolation and identification of actinobacteria from the soi l ofroot system of mangrove forestin Guangxi coastal area[J].Genomics and Appl ied Biology,2010,29(2):310-313.
[17]姜怡,曹艳茹,赵立兴,等.超声波处理土样分离放线菌[J].微生物学报,2010,50(8):1094-1097.
Jiang Yi,Cao Yanru,Zhao Lixing,et al.Ultrasonictreatment of soi lsamplesfor actinomyceteisolation[J].Acta Microbiologica Sinica,2010,50(8):1094-1097.
[18]曹艳茹,姜怡,李有龙,等.孟加拉虎粪便放线菌的分离及其多样性[J].微生物学报,2012,52(7):816-824.
Cao Yanru,Jiang Yi,Li Youlong,et al.Isolation methods and diversity of culturable fecal actinobacteria associated with Panthera tigris tigrisin Yunnan Safari Park[J].Acta Microbiologica Sinica,2012,52(7):816-824.
[19]罗红丽,黄英,王黎明,等.西藏地区土壤放线菌种群多样性及拮抗活性研究[J].微生物学报,2005,45(5):724-727.
LuoHongl i,H uang Ying,Wang Liming,et al.Study on population diversity and antimicrobial activity ofactinomycete from acidic soi lin Xizang area[J].Acta Microbiologica Sinica,2005,45(5):724-727.
[20]杨斌.放线菌分离方法的研究[D].咸阳:西北农林科技大学,2008.
Yang Bin.Study on the method of actinomycetes isolation[D].Xianyang:North W est Agriculture and Eorestry University,2008.
[21]Kaeberlein T,Lewis K,Epstein S S.Isolating“uncultivable”microorganismsin pure culturein a simulated naturalenvironment[J].Science,2002,296(5570):1127-1129.
In situisolation of actinomycetes and screening bioactive potential from mangrove rhizosphere soilsin Guangxi
Jiang Mingguo1,2,Gan Guanghua1,2,Yang Lifang3,Li Xini2,Yang Guil iu2,Tuo Li4,Sun Chenghang4,H uang Ling3,Lan Jinzhi3
(1.Guangxi Key Lab ofM angrove Conservation and Utilization,Guangxi M angrove Research Center,Eeihai536000,China;2.School of M arine Sciences and Eiotechnology,Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Eotanical Resources,Guangxi University for N ationalities,Guangxi N anning530008,China;3.Schoolof Chemistry and Chemical Engineering,Guangxi University for N ationalities Guangxi Key Laboratory of Chemistry and Engineering of Eorest Products,N anning530008,China;4.Chinese Academy of Medical Sciences&Peking Union Medical College,Institute of Medicinal Eiotechnology,Eeijing100050,China)
In orderto efficiently capture actinomycetesfrom mangrove rhizosphere soi lsin Guangxi,trapsfor particularly cultivating actinomycetesin situwereimplanted into soi l and wereincubated for thirty days.A general selec-tive isolation procedure was employed onto fifteen different media.Phylogenetic neighbour-joining tree was conducted on the 16S rR N A gene sequences ofthe isolates and type strains.The biological activities and enzyme production of the isolated strains were evaluated.One hundred thirty-three actinomycetes were recovered.Of the thirtythree randomly picked isolates,twenty wereStreptomyces,eleven wereNocardiopsisand one wasActinosynnema. One isolate,G X U N10,was most closely related toNocardiopsiswith a low 16S rR N A gene sequence identity of 90.0%,and mightrepresent a new genus.Seven,four,eighteen,six,ten and threeisolates showed antimicrobialactivities respectively toEscherichia coli,Pseudomonas aeruginosa,Staphylococcus aureus,Proteusbacillus vulgaris,HemolyticstreptococcusandPneumococcus.Eifty-five,sixty-two,twenty-two and seventy-two isolates respectively showed cellulase,amylase,collagen enzyme and esterase activities.This study provides further evidence that unusual and rare actinomycetes from mangrove rhizosphere soi lsin Guangxican be recovered byinsitucultivation traps.
in situcultivation;mangrove;rhizosphere soils;actinomycetes;biological activity
Q938
A
0253-4193(2015)02-0055-10
2014-01-12;
2014-05-02。
广西红树林保护重点实验室(G K L M C-201204);国家自然基金(31260004,81172963);广西自然基金(2012G X NSE A A053038);高等学校博士学科点专项科研基金博导类项目(20111106110032);广西民族大学重点科研项目(2012 M DZD041)。
姜明国(1973—),男,吉林省长春市人,主要从事微生物资源研究。E-mai l:mzxyj iang@163.com
杨立芳。E-mai l:yanglf1990@163.com
