几种常见微生物降胆固醇机制探讨
2015-10-21黄润庭李宗军
黄润庭,李宗军,2,*,伍 婧
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128)
几种常见微生物降胆固醇机制探讨
黄润庭1,李宗军1,2,*,伍婧1
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128)
高胆固醇血症是引起动脉粥样硬化等严重疾病的潜在危险因素,对于降胆固醇方法的研究也成为了医学和食品界的研究热点。用微生物降胆固醇的方法具有成本低、效率高等优点,本文主要介绍乳酸菌、酵母菌、红曲霉等几种常见具有降胆固醇能力的微生物及其降胆固醇作用机制。
降胆固醇,微生物,作用机制
当今社会发展速度快,人们生活水平有了很大提高,而一些慢性病也悄然走进了现代人的生活中。膳食结构对人们身体健康有很大影响,而高脂肪、高热量的现代人膳食结构使得血脂异常患者有了显著增多。2002年,由卫生部开展的关于中国居民营养状况的调查在全国范围内进行,结果发现:在我国,成年人高血压的患病率为18.8%,成年人血脂异常的患病率为18.6%[1]。2012年,研究人员对中国75个城市监测点的居民进行了营养与健康状况调查,结果发现大城市居民的高胆固醇血症患率增至12.8%,高甘油三酯症的患病率增至26.6%[2]。人体血脂异常会引起如高血脂症、高血压、动脉粥样硬化、冠心病等一系列慢性心血管疾病。其中血浆胆固醇特别是低密度脂蛋白胆固醇(LDL-C)含量过高则是引起动脉粥样硬化等一系列心血管疾病的主要危险因素[3]。因此,寻求一种有效可行的降胆固醇方法正是很多科研工作者所奋斗的目标。
在生物体内,胆固醇来源分为外源性胆固醇(约占1/3)以及内源性胆固醇(约占2/3)两种。降低胆固醇的方法主要为:脱除食物中胆固醇,从而得到低胆固醇含量食品以及抑制胆固醇体内合成这两种方法。20世纪70年代国外就有研究发现肠道微生物在猪体内具有降胆固醇作用[4]。随之对微生物降胆固醇作用有了广泛研究并发现微生物降胆固醇方法具有效率高、成本低,还能为食品带来优良风味等特点,因此研究开发利用微生物降胆固醇的方法备受关注。
具有降胆固醇能力的微生物种类较多,其作用机制也有所差异。本文将对几种常见的具有降胆固醇能力微生物的作用机制进行探究,希望有利于为以后更深入的研究提供参考。
1 与食品有关的降胆固醇的微生物及其作用机理
1.1降胆固醇乳酸菌的多样性及其机制
乳酸菌大量存在于发酵制品中,并能够为发酵制品提供良好风味,提高其营养物质含量、增强其保健作用以及延长产品货架期等功能。乳酸菌对人体还能起到很好的调节胃肠道功能、降胆固醇、调节血脂、增强免疫力等益生功能[5]。在乳酸菌降胆固醇作用及其作用机理方面人们有了广泛的研究并发现很多乳酸菌对食品及含胆固醇培养基具有脱除胆固醇的作用(见表1)。

表1 具有降胆固醇作用的乳酸菌菌株Table 1 Strain of lowing cholesterol lactic acid bacteria
乳酸菌降胆固醇作用机制主要有三种观点:胆固醇共沉淀作用、乳酸菌对胆固醇同化吸收作用以及共沉淀和吸收共同作用降胆固醇。
1.1.1乳酸菌对胆固醇的共沉淀作用胆盐水解酶(bile salt hydrolase,BSH)是微生物在生长,繁殖过程中产生的一种代谢物;主要由乳酸菌产生,能特异地水解结合态胆酸盐中的酰胺键(见图1),并将其转变成氨基酸以及游离胆酸[13]。体外实验发现,在含有一定浓度胆盐的高胆固醇培养基中,乳酸菌产生的胆盐水解酶能够催化水解结合胆盐,使得结合胆盐水解为游离胆酸,在酸性(pH<6.0)条件下,游离胆酸溶解度下降且其共轭活性增强,继而与胆固醇形成沉淀,从而降低了培养基中胆固醇含量[14]。
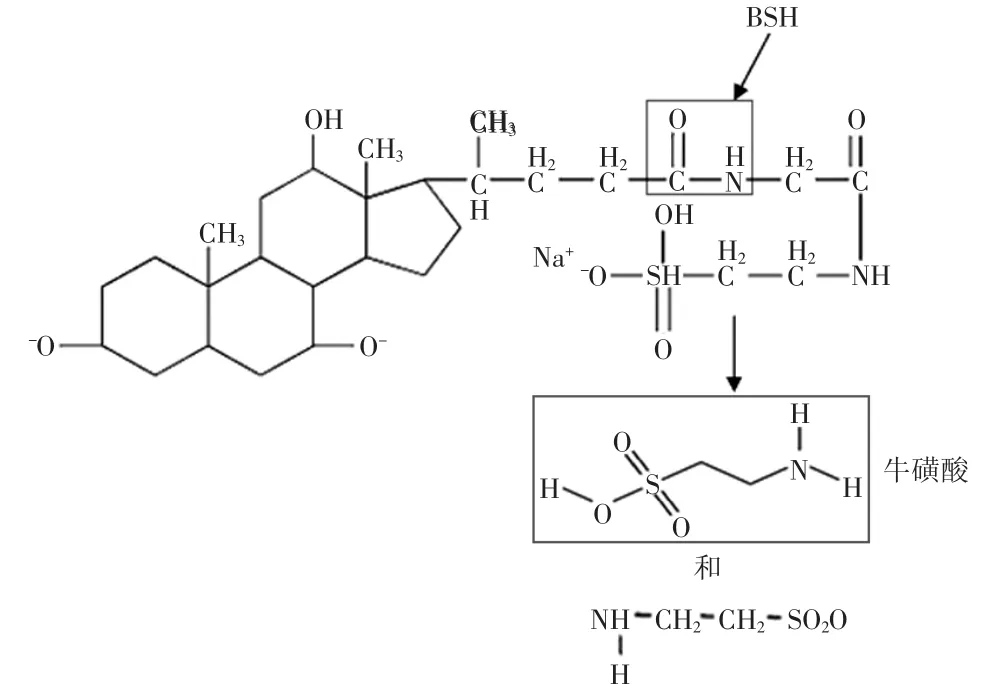
图1 胆盐水解酶水解牛磺胆酸盐示意图Fig.1 Themechanism of BSH hydrolyzes taurocholate
在胆固醇共沉淀作用中,胆盐水解酶起着重要作用。因此探讨胆盐水解酶作用最优条件以及寻求更高活性的胆盐水解酶成为了胆固醇共沉淀研究方向中的一个热点。胆盐水解酶在解离胆盐时对不同胆盐的水解能力表现出一定的选择性。相比牛磺胆酸盐,胆盐水解酶对于甘氨胆酸盐具有更强的解离能力,因此由甘氨胆酸盐解离出来的游离胆酸能够更多地和胆固醇结合并形成沉淀;而对于模拟人体胆盐比例的组合胆盐其水解能力不如单纯甘氨胆酸盐强[15]。在pH为5.2时,胆盐水解酶活性最高,厌氧状态下,胆固醇共沉淀去除率要比有氧条件下高;胆固醇存在形式对于胆盐水解酶的产生有很大的影响,对于只有水溶性胆固醇存在的条件下,即使在较低pH环境也不能发生共沉淀作用[16]。李秀凉等[17],通过响应面分析法发现葡萄糖、蛋白胨和无水乙酸钠是影响植物乳杆菌产胆盐水解酶的主要影响因素,研究人员对发酵培养基成分进行优化,发现在最优培养基组成中,植物乳杆菌发酵产生的胆盐水解酶的产量为单因素实验的6.4倍。
不同乳酸菌产生胆盐水解酶受不同核苷酸序列编码,有的菌株可能存在多个编码基因序列。随着分子技术的发展,乳酸菌编码胆盐水解酶的基因逐渐被发现。了解编码胆盐水解酶的基因序列信息(见表2)有利于利用分子技术对相应基因作出调控,从而能够深入了解胆盐水解酶合成机理或提高其活性。杨士芹等[18],通过基因重组技术将两双歧杆菌和嗜酸乳杆菌的胆盐水解酶基因片段重组到大肠杆菌中表达并具有较高酶活性,这一研究为日后探究高活性高产胆盐水解酶的生产提供了参考基础。

表2 乳酸菌胆盐水解酶的基因序列信息Table 2 Gene sequence of bile salthydrolase
体外乳酸菌通过共沉淀去除胆固醇的作用已被国内外大量实验所证实,然而,在体内能否起到相同作用其机理如今仍不太明晰。有人提出对体内胆固醇共沉淀作用机理的猜测,认为在肠道中乳酸菌为了降低胆盐对自身的危害而通过产生胆盐水解酶将胆盐水解为游离胆酸;游离胆酸不能被肠道重吸收而随粪便排出,因此减少了胆酸在消化系统中的循环次数,从而增加了胆酸的生物合成;而胆固醇又是形成胆酸的前体物质,所以为了弥补胆酸的损失而加速了胆固醇的消耗代谢[22]。然而,虽然游离胆酸不被人体吸收,但是如果游离胆酸没能及时排出体外而在大肠中被其他微生物降解为次生胆盐则会对人体产生致癌的风险。因此对于共沉淀作用在体内的机理以及产物毒理学和去向的研究仍需要更多的动物实验作进一步的验证。
1.1.2乳酸菌对胆固醇的吸收作用20世纪80年代S E GILLILAND等[23]发现,在体外乳酸菌能通过吸收作用去除培养基中的胆固醇。乳酸菌吸收胆固醇的主要机理是胆固醇进入细胞膜并与磷脂双分子层进行疏水结合,进而起到了吸收环境中胆固醇的作用。由体外乳酸菌吸收胆固醇实验发现,将乳酸菌放置于高胆固醇MRS培养基培养48h后,镜检发现乳酸菌细胞膜疏水部分结合了大量胆固醇;再将吸收了大量胆固醇的乳酸菌细胞转接到新鲜MRS培养基上,经过培养发现细胞膜中胆固醇含量降低,而培养基中胆固醇含量则增加,增加量恰好是细胞膜中胆固醇的下降量,由此可知吸收胆固醇作用并非乳酸菌代谢作用的结果[24]。Huey-Shi Lye等[7]通过比较多株乳酸菌吸收清除胆固醇能力的实验发现干酪乳杆菌L.casei ATCC 393清除胆固醇能力较强,还发现吸收了胆固醇的乳酸菌细胞对于超声波处理较普通乳酸菌细胞有较强的抵抗能力,并通过扫描电镜直观地看出吸收了胆固醇的乳酸菌表面较对照组更粗糙不平。可见胆固醇在细胞膜中并非均匀分布,又由于胆固醇富集于细胞膜中,从而大大地降低了细胞膜的通透性,因此导致细胞对超声波有较强的抵抗力。
乳酸菌需要在有胆盐存在的情况下才能起到同化胆固醇的作用,反之则不起作用。适宜的胆盐浓度能够使得乳酸菌细胞壁通透性增强,从而有利于胆固醇穿过细胞壁并与细胞膜磷脂层进行疏水结合;然而,胆盐浓度过高,则可能破坏细菌细胞壁,从而破坏了细胞结构最后导致乳酸菌死亡。同时,细胞壁上肽聚糖的特性影响着胆固醇的吸附特性,这与其中氨基酸种类有关[25]。乳酸菌对胆固醇吸收作用还受到乳酸菌的种类、乳酸菌生长情况、接种量、胆固醇存在形式、胆盐种类、pH条件以及是否为厌氧环境培养等因素影响。综合国内外资料发现:在一定时间范围内,乳酸菌对培养基中胆固醇吸收程度和时间成正比,整体吸收趋势与乳酸菌生长周期趋势一致,并发现活细胞降胆固醇活性最强,休眠细胞次之,死细胞相对最弱。对于这一现象可以解释为:随着乳酸菌生长周期的推移,其细胞壁通透性下降,细胞膜疏水结合胆固醇能力也随之下降。不同菌株对胆盐的选择性不一致,这也许跟其本身合成酶活性以及细胞壁中氨基酸种类有关。
1.1.3乳酸菌通过共沉淀和吸收相互作用降胆固醇
随着对乳酸菌降胆固醇作用及其机制的深入研究,人们发现在实践中,乳酸菌降胆固醇并不只是一种机制起作用,而更多是吸收和共沉淀作用相互协调的结果,而且在一定条件下会表现出以其中一种方式为主导的作用形式。田建军等[26]在筛选能高效降低胆固醇乳酸菌的实验中发现,其体外降胆固醇机制是以共沉淀作用为主同化作用辅助的协同机制进行的。FRANK A M KLAVER等[27]对乳酸杆菌以及两双歧杆菌体外降胆固醇机制的探究实验发现80%为共沉淀作用,20%为同化作用,共同降低胆固醇。于平等[28]实验筛选植物乳杆菌也发现两株具有降胆固醇能力的菌株其作用除了有共沉淀和同化共同协调作用外,还能通过产生特殊酶对胆固醇进行转化。
乳酸菌在体内降胆固醇作用也得到了很多动物实验的证实。动物实验还发现,向高血脂胆固醇小鼠饲料中添加乳酸菌,除了血浆总胆固醇以及总甘油三酯水平下降外,低密度脂蛋白胆固醇(LDL-C)含量下降,高密度脂蛋白胆固醇(HDL-C)的含量却有所增加[29]。高密度脂蛋白胆固醇能够将血浆中的胆固醇运往肝脏细胞,从而促进胆固醇的代谢减少血浆中的含量;而低密度脂蛋白作用则相反,能够提高血浆中胆固醇含量。乳酸菌还能够抑制胆固醇形成胶束形式,进而能够减少胆固醇被小肠吸收,而且能够促进胆固醇共沉淀的作用。乳酸菌要在体内发挥降胆固醇作用,需要具有一定的抗胃肠道逆环境的能力所以对于其耐酸以及耐胆盐能力也有一定的要求。然而,具有降胆固醇益生功能的乳酸菌不一定具有很好的抗胃肠道逆环境的能力,因此将具有降胆固醇能力的益生菌制成制剂则是一个很好的选择。将具有高抗胃肠道逆环境能力的菌与具有降胆固醇益生作用菌制成混合菌制剂,可以减少益生菌在胃肠道中受到损失,提高其存活率;多层包埋微胶囊技术也能够增强益生菌抗胃肠道逆环境能力,并能够定点释放乳酸菌,达到增强其在肠道发挥预期作用的效果。
1.2酵母菌降胆固醇作用
酵母菌是被人类应用历史较长的微生物,酵母菌在自然界广泛分布。在食品行业中,酵母菌被广泛应用于酒类酿造、面包制作等方面。有研究发现,从藏灵菇分离出的酵母具有较强的抗胃肠道逆环境能力以及降胆固醇的作用[30],从藏灵菇分离出来的酵母与乳酸菌混合发酵的蛋乳饮料,发现其中胆固醇含量比乳酸菌单独一次发酵的还要低39%[31],因而可以制得胆固醇含量更低,而其他营养成分含量不变的功能性食品。
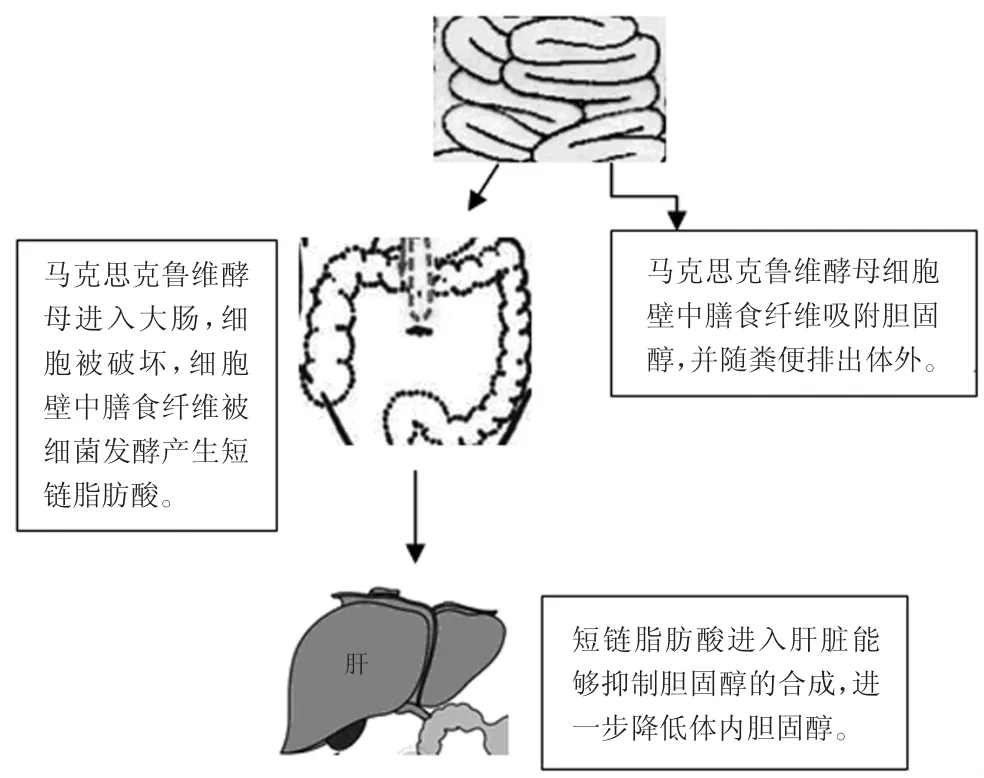
图2 马克思克鲁维酵母体内降胆固醇作用Fig.2 The progress of the reduction of cholesterol in vivo by Kluyveromycesmarxianus
酵母菌降胆固醇作用机制根据菌株的不同而异,主要分为产生胆盐水解酶发生的共沉淀作用以及细胞壁膳食纤维对胆固醇的吸收作用两种机制。从藏灵菇分离出来的克鲁维酵母主要通过产生胆盐水解酶使得胆固醇发生共沉淀的作用,从而降低了胆固醇[32]。马克思克鲁维酵母由于富含膳食纤维的细胞壁对胆固醇进行吸附作用,从而降低了用高胆固醇饲料喂养的小鼠的血浆胆固醇含量[33]。膳食纤维主要通过对胆固醇的吸附作用,从而使胆固醇不能被肠道吸收,并随粪便排出体外。还有实验发现马克思克鲁维酵母还能促进实验小鼠结肠产生大量短链脂肪酸[34],这与马克思克鲁维酵母细胞壁含有大量膳食纤维有关。由于膳食纤维在小肠内不被吸收,进入大肠后被细菌发酵产生短链脂肪酸。短链脂肪酸中的丙酸能够影响胆固醇合成限速酶(HMG-Co A还原酶)活性,能够有效地抑制肝脏胆固醇的合成,短链脂肪酸还能与胆固醇竞争小肠吸收位点,进而可以进一步降低血浆总胆固醇的含量(见图2)[35]。
酵母由于富含B族维生素,而且蛋白质含量高,已经被制作成酵母片等促进消化的保健品。然而,针对于酵母菌降胆固醇功能制作的保健产品市面上仍然比较少。研究发现具有降胆固醇能力的酵母其抗胃肠道环境能力也比较强,因此,针对这一特性开发相应的降胆固醇酵母产品将具有宽广的发展前景。
1.3红曲霉降胆固醇作用
红曲霉在国内外通常应用于酿酒、制醋、发酵肉等方面。由于其发酵时可产生大量的红色素——红曲色素,因此红曲色素经常作为一种天然染色剂使用。随着对红曲霉研究的深入,人们发现红曲霉能发酵产生具有降胆固醇作用的代谢物——莫纳可林K(Monacolin K),随后又相继发现了和莫纳可林K结构相似的莫纳可林J、L、M等活性物质[36]。如今,莫纳可林K已经被制造成一种常见的降胆固醇药物弗洛他汀。莫纳可林K(见图3)分为酸式和内酯式,酸式莫纳可林K具有一个与胆固醇合成过程中限速酶3-羟基-3甲基戊二酰辅酶A还原酶(HMG-Co A还原酶)相似的羟基基团,能与该酶的COOR末端相互作用,能够和HMG-Co A还原酶底物发生竞争作用,因此可以有效抑制该酶活性,从而抑制了胆固醇的体内合成[37]。

图3 红曲霉产生降胆固醇物质的分子结构Fig.3 The structural formula of the lowing cholesterol substance produced bymonascus
然而,红曲霉发酵产生莫纳可林K的同时也会产生有毒物质桔霉素。桔霉素主要损害肾脏,并具有致肿瘤、致突变、致畸等危害性;据研究发现小鼠的经口半致死量为110mg/kg[38]。然而,红曲色素中还含有丰富的黄酮、麦角甾醇和不饱和脂肪酸等物质,这些物质同样具有很好的调节血脂的作用;而仅将莫纳可林K分离出来单独作用也许不如多种物质协同作用的效果好。因此对于具有高效降胆固醇能力而使用剂量低的红曲霉的开发以及探究降低桔霉素产量的发酵条件工艺优化这两方面研究备受科学研究者的关注。
Lee Chun-Lin等[39]通过与添加弗洛他汀组对比发现只需10.78mg/100g剂量的M.purpureus NTU568喂养高血脂仓鼠即可获得理想的降胆固醇的效果,同时低剂量红曲霉所产生桔霉素的含量也比较少,推广至人体也未能造成危害。有研究发现,在35℃条件下,将16株红曲霉菌接种到土豆葡萄糖培养基中振荡培养8d,只有4株菌产桔霉素且含量在3~21mg/L之间,含氮量高的培养基桔霉素产量也增加[40]。由此可见桔霉素的合成不仅与菌株有关,而且与培养基的营养组成以及培养环境条件也有关系。对于控制桔霉素产量以减少其对人体的危害的探究,有利于人们更好地利用红曲霉。
2 微生物产生转化胆固醇的酶作用
除了以上综述的常见具有降胆固醇能力微生物外,还有很多微生物通过产生一些特殊的酶转化胆固醇(见表3),使之从食物中脱除或者转化成不被人体吸收的物质。
研究表明胆固醇氧化酶(Cholesterol oxidase,COD)可以催化胆固醇氧化以及异构化反应,生成胆甾-4-烯-3-酮和过氧化氢,并发现胆甾-4-烯-3-酮具有降血脂的功效[48]。通过对胆固醇氧化酶特性及其基因信息的了解(见表4),人们可以更好地利用胆固醇氧化酶,例如通过调节作用条件提高酶活性,或者利用基因工程等技术获得高活性胆固醇氧化酶以及高产量菌株,也是对于胆固醇氧化酶方面研究的热点。由微生物代谢得到的胆固醇氧化酶具有一定的安全性,而且通过胆固醇氧化酶作用于胆固醇后得到的产物具有降血脂作用,因此微生物产胆固醇氧化酶也得到了更多的研究。

表3 产转化胆固醇酶的微生物Table 3 Producing cholesterol invertasemicroorganism
通过胆固醇还原酶(Cholesterol reductase)作用将胆固醇还原转化为不能被胃肠道吸收的粪甾醇,也是降胆固醇的一种方法,研究发现大多数产胆固醇还原酶的微生物存在于大肠菌群中[49]。
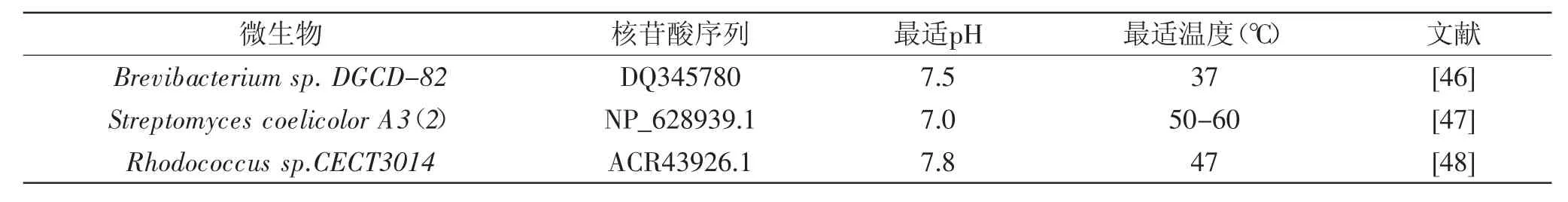
表4 部分胆固醇氧化酶基因序列及其特性信息Table 4 Gene sequence and properties of some cholesterol oxidase
3 降胆固醇微生物开发利用前景
微生物降胆固醇作用在近年来得到了大量体外实验以及动物实验的验证,微生物降胆固醇方法具有应用价值高、成本低、安全等特点,受到很多研究者的关注。对于微生物降胆固醇应用投入企业生产中,也成为了很多企业的新项目。
因此对于微生物降胆固醇作用的各个方面应进行更深入的研究,主要为:
a.优化微生物产降胆固醇物质的发酵条件。通过优化微生物产降胆固醇物质的发酵条件,促进降胆固醇代谢物的产生,以便提取应用。例如:通过优化发酵条件,使得莫纳可林K、胆盐水解酶等代谢物更多的产生。
b.加强对微生物产生的具有降胆固醇功能代谢物的作用机理、作用条件以及作用产物毒性的研究,从而达到充分利用微生物降胆固醇代谢物的目的。
c.利用代谢组学分析方法,分析微生物在发酵过程中所产生的代谢产物及其作用,进而发现更多具有降胆固醇作用的微生物代谢物质。
d.探究酶作用转化胆固醇后产物对人体的毒性作用及其去向。如结合胆盐经胆盐水解酶作用后的解离胆盐在体内去向,以及降低次生胆盐转化率的方法也仍需进一步的探究;又如,对胆固醇经过胆盐氧化酶转化产物的降血脂作用及其回收利用进行开发等。
e.通过基因工程等生物工程手段对具有降胆固醇作用的微生物进行基因改良,以得到具有更高效更稳定的降胆固醇作用的菌株。基因工程可以有选择性地让目标基因得到表达,因此可以通过对编码微生物降胆固醇能力有关基因进行选择,通过基因重组技术制得具有更高降胆固醇能力的微生物。
f.结合新的分子生物技术发现更多具有降胆固醇的微生物,以及对其作用机制进行探究。例如,通过分子工具对微生物进行鉴定以及对基因序列进行研究,进而更深入掌握微生物降胆固醇的机制[50]。
g.对于具有降胆固醇益生功能的微生物安全性进行深入研究,确保对其利用不会对人体或动物体造成危险。
h.将微生物降胆固醇作用与药物治疗结合起来,通过微生物的协调作用来减轻药物作用对身体的损害。
微生物降胆固醇是一个备受关注的研究领域,具有很好的前景,因此开发更多降胆固醇微生物研究将为人类健康做出巨大贡献。
[1]杨晓光,翟凤英,朴建华,等.中国居民营养状况调查[J].中国预防医学杂志,2010,11(1):5-7.
[2]刘艳芳.中国城市居民营养不良不断改善营养失衡状况在加重[N].中国食品报,2013(110):1-2.
[3]Katsuyuki Nakajima,Yasuhiro Nakajima,Takeichi S,et al. Plasma remnant-like lipoprotein particles or LDL-C as major pathologic factorsin sudden cardiac death cases[J].Atherosclerosis,2008,198(1):237-246.
[4]Glen EMott,RWayne Moore,Redmond H E,et al.Lowering of serum cholesterol by intestinal bacteria in cholesterol-fed piglets[J].Shirt Communications,1973,8(7):428-431.
[5]刘艳姿.乳酸菌的生理功能特性及应用的研究[D].秦皇岛:燕山大学,2010.
[6]Gilliland S E,Nelsin C R,Maxwell C.Assimilation of cholesterol by Lacobacilus[J].Appl Environ Microb,1985,49(2):377-381.
[7]Huey-Shi Lye,Gulam Rusul Rahmat-Ali,Min-Tze Liong. Mechanismsof cholesterol removal bylactobacilli under conditions that mimic the humangastrointestinal tract[J]. International Dairy Journal,2010(20):169-175.
[8]Esra Tok,Belma Aslim.Cholesterol removal by some lactic acid bacteria that can be used as probiotic[J].Microbiology and Immunology,2010(54):257-264.
[9]Do Kyung Lee,Seok Jang,Eun Hye Baek,et al.Lactic acid bacteria affect serum cholesterol levels,harm ful fecal enzyme activity,and fecalwater content[J].Lipids in Health and Disease,2009,8(21):1-8.
[10]Liu H L C,Li Z P,Jing Y,et al.Removed cholesterol of lactic acid bacteria isolated from mink[J].Proceeding of the 4th International Conference on Sustainable Animal Agriculture for Developing Countried,2013,446-447.
[11]Yanping Wang,Nv Xu,Aodeng Xi,et al.Efficts of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolismand intestinal microflora of rats fed on highcholesterol diet[J].Applied Microbiology and Biotechnology,2009,84(2):341-347.
[12]严玉婷,潘道东.发酵乳杆菌SM-7的筛选及对小鼠降胆固醇作用[J].食品科学,2010,31(9):224-228.
[13]张本恒主编.益生菌[M].北京:化学工业出版社,2004:96-97.
[14]Maire Begley,Cormac G M Gahan,Colin Hill.The interaction between bacteria and bile[J].Microbiology Reviews,2005,29(4):625-651.
[15]M T Liong,N P Shah.Bile salt deconjugation ability,bile salt hydrolase activity and cholesterol co-precipitation ability oflactobacilli strains[J].International Dairy Journal,2005(15):391-398.
[16]Ahn,Y T Kim,G B Lim,et al.Deconjugation of bile salts byLactobacillus acidophilus isolates[J].International Dairy Journal,2003,13:303-311.
[17]李秀凉,王继超.响应面法优化植物乳杆菌发酵产胆盐水解酶的培养基成分[J].中国酿造,2013,32(5):47-51.
[18]杨士芹,满朝新,曲行光,等.不同来源胆盐水解酶基因在大肠杆菌中的表达[J].食品科学,2013,34(7):144-147.
[19]Eric Altermann,W Michael Russell,M Andrea Azcarate-Peril,et al.Complete genome sequence of the probiotic lactic acid bacterium Lactobacillus acidophilus NCFM[J].PNAS,2005,102(11):3906-3912.
[20]Christopher A Elkins,Dwayne C Savage.Identification of Gene Encoding Conjugated Bile Salt Hydrolase and Transport in Lactobacillus johnsonii100-100[J].Journal of Bacteriology,1998,180(17):4344-4349.
[21]Geun-Bae Kim,Carol M Miyamoto,Edward A Meighen,et al.Cloning and Characterization of the Bile Salt Hydrolase Genes(bsh)from Bifidobacterium bifidum Strains[J].Applied and EnvironmentalMicrobiology,2004,70(9):5603-5612.
[22]张刚主编.乳酸菌—基础、技术和应用[M].北京:化学工业出版社,2007:111-112.
[23]S E Gilloland,C R Nelson,C Maxwell.Assimilation of Cholesterol by Lactobacillus acidophilus[J].American Society for Microbiology,1985,49(2):377-381.
[24]程秀芳,王丛丛,谷巍.体外降胆固醇乳酸菌的筛选及其作用机制研究[J].现代预防医学,2013,40(13):2511-2514.
[25]Kimoto-Nira H,Mizumachi K,Nomura M,et al.Lactococcus sp.Asprobiotic lactic acid bacteria[J].Japan AgriculturalResearch Quarterly,2007,41(3):181-189.
[26]田建军,张开屏,靳烨.高效降胆固醇乳酸菌的筛选[J].食品科技,2011,36(11):21-30.
[27]Frank A M Klaver,Roelof van Der Meer.The Assumed assimilation of cholesterol by Lactobacilli and bifidobacterium bifidum is due to their bile salt-Deconjugation activity[J]. American Society for Microbiology,1993,59(4):1120-1124.
[28]于平,孙海森,励建荣,等.植物乳杆菌LpT1和LpT2体外降胆固醇机制[J].微生物学报,2011,51(4):561-565.
[29]G KeiBling,JSchneider,G Jahreis.Long-term consumption of fermented dairy products over 6 months increases HDL cholesterol[J].European Journal of Clinical Nutrition,2002,56:843-849.
[30]刘慧,陈湘宁,李晨,等.藏灵菇酵母M3耐胃肠道逆环境特性及降胆固醇的实验研究[J].中国农学通报,2009,25(15):60-63.
[31]张晶,张红星,谢远红,等.藏灵菇酵母菌和乳酸菌降胆固醇蛋乳发酵饮料的研制[J].中国酿造,2013,32(9):50-53.
[32]潘昌莉,张红星,耿新,等.藏灵菇克鲁维酵母M3菌株胆盐水解酶的分离纯化研究[J].中国酿造,2011(3):58-62.
[33]Yasuto Yoshida,Wakae Yokoi,Ohishi,et al.Effects of Cell Wall of Kluyveromyces YIT 8292 on the Plasma Cholesterol and Fecal Sterol Excretion in Rats Fed on a High-Cholesterol Diet[J].Biosci Biotechnol Biochem,2005,69(4):714-723.
[34]钟礼云,林文庭.膳食纤维降血脂作用及其机制的研究概况[J].海峡预防医学杂志,2008,14(1):26-28.
[35]刘松珍,张雁,张名位,等.肠道锻炼脂肪酸产生机制及生理功能的研究进展[J].广东农业科学,2013(11):99-103.
[36]童群义.红曲霉产生的生理活性物质研究进展[J].食品科学,2003,24(1):163-167.
[37]李梅,台喜生,冯佳丽,等.微生物来源的弗洛他汀的研究进展[J].食品工业科技,2011,32(18):457-460.
[38]李云,阎雪秋,李枚秋,等.红曲与桔霉素[J].食品发酵工业,2000,26(3):82-87.
[39]Lee Chun-Lin,Tai Tsung-Yu,Wang Jyh-Jye.In vivo hypolipidemic effects and safety of low dosage Monascus powder inahamster model of hyperlipidemia[J].Appl Microbiol Biotechnol,2006(70):533-540.
[40]许杨,李燕萍,赖卫华,等.不同培养条件对红曲霉产桔霉素影响的研究[J].食品工业科技,2002,23(10):33-35.
[41]Yu Xin,Hailin Yang,Xiaole Xia,et al.Expression and comparisonof recombinant cholesterol oxidases(COD) in Escherichia coli with native cholesterol oxidase expressed in Brevibacterium sp.[J].African Journal of Biotechnology,2011,10(66):14968-14976.
[42]Ram Niwas,Vineeta Singh,Rajbir Singh,et al.Production,purification and characterization of cholesterol oxidase from a newly isolated Streptomyces sp.[J].World JMicrobiol ogy and Biotechnology,2013(29):2077-2085.
[43]Yuchang Liu,Guiying Chen,Fanglan Ge,et al.Efficient biotransformation of cholesterol to androsta-1.4-diene-3,17-dione by a newly isolated actinomycete Gordonia neofeliaecis[J]. World JMicrobiology and Biotechnology,2011,27(4):759-765.
[44]Owen RW,Tennesson,Bilton R F,et al.The degradation of cholesterol by Escherichia coli isolated from human faeces[J]. Biochemistry Social Translation,1978(6):377-379.
[45]Freier T A,Beitz D C,Li L,et al.Characterization of Eubacterium coprostanoligenes sp.Nov.,a cholesterol reducing anaerobe[J].International Journal of Syatemstic Bacteriology,1994,44(1):137-142.
[46]张玲,杨海麟,孙燕,等.微生物胆固醇氧化酶的研究进展[J].食品科学,2009,30(9):225-228.
[47]Longgang Wang,Wu Wang.Coenzyme precursor-assisted expression of a cholesterol oxidase from Brevibacterium sp.In Escherichia coli[J].Biotechnol Lett,2007,29:761-766.
[48]Nai-hua Hsiao,Ralph Kirby.Comparative genomics of Streptomycesavermitilis,Streptomycesmaritimusand KitasatosporaaureofaciensusingaStreptomycescoelicolor microarray system[J].Antonie van Leeuwenhoek,2008,93:1-25.
[49]王龙刚,邬敏辰,王武.胆固醇氧化酶基因的克隆及在E.coli中的表达[J].微生物学通报,2006,33(8):39-42.
[50]Kaouther Ben Amor,Elaine E Vaughan,Willem M devos. Advanced molecular tools for the identification of lactic acid bacteria[J].The Journal of Nutrition,2007(7):741-747.
Research progress in the mechanism s of lowering cholesterolof several common kinds ofm icroorganism s
HUANG Run-ting1,LIZong-jun1,2,*,WU Jing1
(1.College of Food Science and Technology Hunan Agricultural University,Changsha 410128,China;2.Hunan Province Key Laboratory of Food Science and Biotechnology,Changsha 410128,China)
Hypercholesterolem ia was the potential risk factors that could lead to some serious diseases like atherosc lerosis.Researches about the method to reduce cholesterolbecome a focus in the field ofmedicaland food.There are many advantages such as costing lower p rice and efficiency by using m ic roorganisms to lower cholesterol.This study would introduce several kinds of common m icroorganisms that had the ability of low ing cholesterol,such as,lac tic acid bacteria,yeast,monascus,etc and the mechanisms of low ing cholesterol.
low ing cholesterol;m ic roorganism s;mechanism s
TS201.3
A
1002-0306(2015)06-0385-06
10.13386/j.issn1002-0306.2015.06.075
2014-04-28
黄润庭(1990-),女,硕士研究生,研究方向:食品生物技术。
李宗军(1968-),男,博士,教授,研究方向:食品生物技术。
