发菜多糖对小鼠血清中细胞因子及抗氧化能力的影响
2015-10-21符宏磊侯茂霞孙紫悦岳利芳贾士儒戴玉杰
符宏磊,侯茂霞,孙紫悦,岳利芳,贾士儒,戴玉杰
(天津科技大学生物工程学院,天津300457)
发菜多糖对小鼠血清中细胞因子及抗氧化能力的影响
符宏磊,侯茂霞,孙紫悦,岳利芳,贾士儒,戴玉杰*
(天津科技大学生物工程学院,天津300457)
研究了野生发菜多糖(EPSA)和人工培养发菜多糖(EPSB)对小鼠血清中肿瘤坏死因子(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-12(IL-12)的影响并且测定了谷胱甘肽-过氧化物酶(GSH-PX),过氧化氢酶(CAT),超氧化物岐化酶(SOD),丙二醛(MDA)的活性。实验表明,EPSA和EPSB对血清中IL-1的含量几乎没影响。EPSA高剂量组(100mg/kg·d)和EPSB高剂量组(100mg/kg·d)均能提高小鼠血清中IL-6的含量,其中EPSB高剂量组与空白组比较,差异显著(p<0.05)。而且,不同剂量的EPSA和EPSB均极显著的提高了血清中IL-12的含量(p<0.01)。此外,在高剂量条件下,EPSA和EPSB与空白组相比,均能显著性地提高血清中TNF-α含量(p<0.05)。同时,研究发现,高剂量(100mg/kg·d)EPSA与低剂量(50mg/kg·d)EPSB的CAT活性均极显著的高于对照组(p<0.01)。高剂量(100mg/kg·d)EPSA与对照组相比,可以极显著的提高小鼠血清中的谷胱甘肽氧化物酶(GSH-PX)的含量(p<0.01)。两种多糖对MAD含量影响不显著(p>0.05)。EPSA能够显著(p<0.05)提高小鼠血清中SOD的含量,此外,低剂量的EPSB能极显著(p<0.01)提高小鼠血清中SOD的的含量。
发状念珠藻,多糖,细胞因子,抗氧化
发菜(发状念珠藻,Nostoc flagelliforme),主要分布于北部和西北部的干旱、半干旱地区。野生发菜分泌大量多糖在体外形成鞘体、黏液层和荚膜,液体培养条件下发菜细胞可将多糖分泌到培养液中。研究发现从野生发菜中提取的酸性多糖—nostoflan,是一种潜在的抗病毒药物[1]。同时,发菜多糖能清除多种自由基[2],并且具有显著的抗突变能力[3]。但是由于野生发菜资源濒临枯竭,使发菜及其多糖应用受到限制。
由于野生发菜资源濒临枯竭,同时满足其市场需求,研究者们提出了发菜的液体悬浮培养方法。苏建宇等[4]从天然藻体中分离出细胞对其进行液体悬浮培养,提高了发状念珠藻细胞的生长速度和胞外多糖的产量。同时,为了对比人工培养发菜多糖和野生发菜多糖的区别,一些学者如贾士儒等[5]研究发现人工培养发菜多糖具有和野生发菜多糖相近的结构和组成,单糖组成均为葡萄糖、木糖、半乳糖、甘露糖;表观分子量分别为2.79×105、2.26×105,这为研究人工培养发菜多糖和野生发菜多糖的功能区别做了铺垫。
免疫调节作用是多糖最重要的活性作用之一,但发菜多糖免疫调节活性的研究及报道不多。戴玉杰等[6]研究发现野生发菜多糖可以提高单核巨噬细胞、腹腔巨噬细胞的吞噬能力并且可以促进T淋巴细胞的增殖。目前,在细胞因子水平上发菜多糖如何调节免疫功能尚不完全清楚,且目前对发菜多糖体外抗氧化的研究较多,对发菜多糖体内抗氧化的研究较少。本实验主要从四种免疫细胞因子的角度初步探讨了发菜多糖的免疫调节作用机制,并且通过测定GSH-PX、CAT、SOD、MDA的酶活性评价了发菜多糖的体内抗氧化功能。
1 材料与方法
1.1材料与仪器
实验采用BALB/c小鼠SPF级,雄性,体重为18~20g,购自中国食品药品检定研究院,许可证号SCXK(京)2009-0017,饲养在温度20~25℃,相对湿度50%±5%的动物房内,将动物随机分为3组,每组12只,分别为空白组、发菜多糖50mg/kg剂量组、发菜多糖100mg/kg剂量组;IL-1、IL-6、L-12、TNF-γ细胞因子ELISA试剂盒上海研辉生物科技有限公司;CAT检测试剂盒、SOD检测试剂盒、GSH-PX检测试剂盒、MDA检测试剂盒上海研辉生物科技有限公司。
150i/240i型 CO2培 养 箱Thermo公 司 ;SPECTRAmax 190型全自动酶标仪美国Molecular Devices公司;UEIP-503实验型膜过滤装置天津膜天膜工程技术有限公司;RE3000旋转蒸发器上海亚荣生化仪器厂;TD5A-WS湘仪离心机湖南湘仪实验室仪器开发有限公司。
1.2实验方法
1.2.1发菜胞外多糖的制备
1.2.1.1野生发菜胞外多糖的提取[7]将野生发菜洗净后,80℃热水反复浸提4次后,浸提液使用截流分子量为10000u超滤膜浓缩。浓缩液经离心(4000r/min,10m in)后得上清液。向上清液中加入4倍体积的无水乙醇,使乙醇含量为80%,4℃过夜,离心取得多糖沉淀,用无水乙醇洗涤沉淀后将沉淀冻干后得野生发菜胞外多糖[5],人工命名为EPSA。
1.2.1.2人工培养发菜胞外多糖的提取发菜细胞经人工液体悬浮培养[8]20d,培养液使用截流分子量为10000u的超滤膜浓缩。浓缩液处理方法同上,沉淀冻干后备用,人工命名为EPSB。
然后分别将浓缩液在4000r/m in下离心10m in得上清液。向上清液中加入4倍体积的无水乙醇,使乙醇体积分数为80%,4℃过夜,使用sevag法[9]反复除蛋白7次后,将多糖冷冻干燥,最后得到发菜胞外多糖,使用苯酚-硫酸法测得其多糖含量为73%。
1.2.2细胞因子IL-1、IL-6、IL-12、TNF-α的测定小鼠给药结束后摘眼球取血,于4℃冰箱放置4h,待血清析出后,以3000r/m in离心10m in,收集血清。细胞因子的测定严格按照试剂盒说明进行操作,采用SPECTRAmax 190型全自动酶标仪检测。
1.2.3GSH-PX、CAT、SOD、MDA的测定小鼠给药结束后摘眼球取血,于4℃冰箱放置4h,待血清析出后,以3000r/m in离心10m in,收集血清。血清中GSH-PX、CAT、SOD、MDA的测定严格按照试剂盒说明进行操作,采用SPECTRAmax 190型全自动酶标仪检测。
1.2.4数据处理采用SPSS19.0统计软件ANOVA程序对数据进行方差分析,用Duncan法进行多重比较,结果均以±s表示。
2 结果与分析
2.1EPSA和EPSB对小鼠血清中IL-1、IL-6、IL-12、TNF-α含量的影响
表1为发菜多糖对小鼠血清中细胞因子(IL-1、IL-6、IL-12、TNF-α)浓度的影响。由表1可以看出,与空白组相比,不同剂量的发菜多糖可以不同程度地提高小鼠血清中细胞因子的含量。结果如表1所示,EPSA和高剂量组的EPSB可以略微提高血清中IL-1的含量,但没有显著性(p>0.05)。由此推断,前期研究发现发菜多糖对小鼠胸腺指数和体内脾淋巴细胞增殖的影响不明显[5],可能与发菜多糖对血清中IL-1浓度无明显影响有关。
IL-6由多种细胞产生,如单核细胞在受到LPS刺激时能产生IL-6,在机体发生炎症时单核细胞和巨噬细胞能最早产生IL-6,成纤维细胞可自发产生IL-6。IL-6具有多种生物活性,如刺激多种细胞生长和促进细胞分化,调节肿瘤细胞生长和分化等[10]。实验结果表明,与空白组相比,EPSB和EPSA高剂量组(100mg/kg·d)均能提高IL-6的浓度,其中高剂量组的EPSB能显著性提高小鼠血清中IL-6的含量(p<0.05)。低剂量组的多糖对IL-6浓度几乎无影响。
IL-12[11]主要由单核细胞和巨噬细胞产生,它能提高NK细胞的杀伤活性和LAK细胞粘附分子的表达,还可以调节淋巴细胞的增殖,刺激T细胞和NK细胞产生IFN-γ。灌胃发菜多糖后,与空白组相比,不同剂量组的EPSB和EPSA均极显著的提高了小鼠血清中IL-12的含量(p<0.01)。此外,相同剂量的EPSB比EPSA,小鼠血清中IL-12的水平偏高,高剂量(100mg/kg·d)的EPSB与EPSA相比,IL-12的含量差异极显著(p<0.01)。灌胃发菜多糖后小鼠血清中IL-12含量的提高进一步说明了多糖能够提高单核巨噬细胞和腹腔巨噬细胞的活性;而小鼠NK细胞活性的增加,可能与小鼠血清中IL-12浓度的提高有一定关系,这与之前的报道结果一致[6]。
如表1所示,两种多糖均能有效提高小鼠血清中肿瘤坏死因子TNF-α,并存在剂量依赖性。较空白组,高剂量的EPSA和EPSB均能显著性提高血清中TNF-α的含量(p<0.05),并且EPSB对TNF-α的影响更大。肿瘤坏死因子TNF-α主要由单核细胞和巨噬细胞合成产生,它在体内及体外都能杀死或抑制某些肿瘤细胞。在体内肿瘤坏死因子还可以提高T细胞及其他杀伤细胞对肿瘤细胞的杀伤活性,活化单核细胞和巨噬细胞,调节不同细胞的分化,促进T淋巴细胞[12]和B淋巴细胞的增殖。本课题组已有研究结果表明发菜多糖在体外能抑制A549人肺癌细胞、BEL-7402人肝癌细胞、Hela细胞的生长[13]。灌胃发菜多糖后小鼠血清中的肿瘤坏死因子TNF-α浓度增加进一步表明EPSA和EPSB都具有潜在的抗肿瘤的活性。

表1 发菜多糖对小鼠血清中细胞因子含量的影响(n=6)Table 1 Effectof N.flagelliforme polysaccharides on cytokines in serum ofmice(n=6)
2.2EPSA和EPSB体内抗氧化活性研究
CAT、GSH-PX、SOD是机体抗氧化系统中重要的酶类[14-17]。从表2可知,EPSA和EPSB组CAT、SOD活性均高于空白组,其中,高剂量(100mg/kg·d)EPSA与低剂量(50mg/kg·d)EPSB的CAT活性均极显著的高于空白组(p<0.01);低剂量(50mg/kg·d)EPSB和EPSA,相比空白组,均极显著(p<0.01)和显著(p<0.05)的提高SOD活性,从而减少超氧阴离子对机体的伤害。高剂量(100mg/kg·d)EPSA与空白组相比,极显著提高了GSHPX活力。从表2还可以看出随着EPSB浓度的升高,CAT、GSH-PX、SOD三种酶的活性降低。而相反,随着EPSA浓度的升高,CAT、GSH-PX、SOD三种酶的活性升高,存在剂量依赖效应。表2中,多糖组的MDA浓度较空白组略高,但没表现出显著性差异。综合分析可知,在抗氧化功能方面,低剂量(50mg/kg·d)EPSB的作用明显优于高剂量(100mg/kg·d)EPSB,而高剂量(100mg/kg·d)EPSA的作用明显优于低剂量(50mg/kg·d)EPSA。
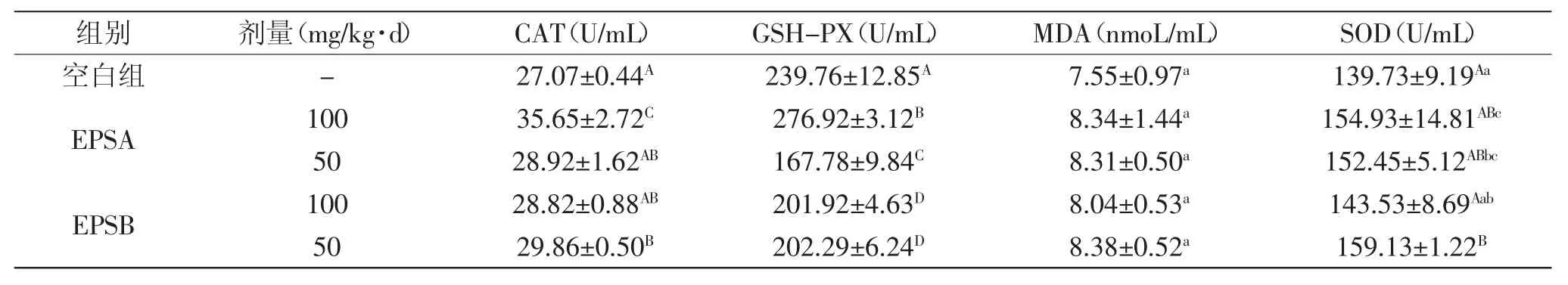
表2 发菜多糖对小鼠血清中CAT、GSH-PX、MDA、SOD的影响(n=6)Table 2 Effectof N.flaggelliforme on the concentration of CAT,GSH-PX,MDA and SOD in serum ofmice(n=6)
3 结论
白细胞介素在机体免疫应答过程中发挥重要调节作用。IL-12作为一种细胞因子和免疫调节因子对肿瘤有直接对抗作用,在原发性、继发性肿瘤的免疫反应中起重要作用[18-19]。TNF-α是一种多功能细胞因子,具有直接抗肿瘤作用的细胞因子。本文研究结果表明,不同剂量组的EPSB和EPSA均极显著(p<0.01)的提高了小鼠血清中IL-12的含量,高剂量的EPSA和EPSB均能显著性提高血清中肿瘤坏死细胞因子TNF-α的含量(p<0.05),这可能是发菜多糖抗肿瘤的原因之一。
陈雪峰等[20]通过自由基清除实验对发菜多糖的体外抗氧化活性进行了测定,发现发菜多糖有很强的清除羟自由基和超氧阴离子自由基的作用。但是,由于在生命体中,有更多的生物分子比多糖更易受到攻击,故多糖体内抗氧化和体外抗氧化的机制可能不同。本研究以检测CAT、GSH-PX、SOD和MDA为指标来评价体内抗氧化能力。研究发现,高剂量(100mg/kg·d)EPSA与低剂量(50mg/kg·d)EPSB分别极显著(p<0.01)和显著(p<0.05)提高了CAT和SOD活性,表明发菜多糖可以通过增强体内的抗氧化系统,发挥抗氧化作用。至于发菜多糖的免疫调节作用与抗氧化作用之间是否存在关联、存在怎样的作用机制,是今后研究的重点。
[1]Kanekiyo K,Lee JB,HayashiK,etal.Isolation ofan Antiviral Polysaccharide,Nostoflan,froma Terrestrial Cyanobacterium,Nostoc flagelliforme[J].Journal of Natural Products,2005,68(7):1037-1041.
[2]陈雪峰,李一当.发菜多糖清除自由基活性的研究[J].安徽农业科学,2008,36(8):3088-3089.
[3]孙强,纪志娜,黄辉,等.发状念珠藻(Nostoc flagelliforme)多糖的抗氧化与抗突变性质分析[J].食品研究与开发,2010,31(2):159-162.
[4]Su J,Jia S,Chen X,et al.Morphology,Cell Growth and Polysaccharide Production of Nostoc flagelliforme in Liquid Suspension Culture at Different Agitation Rates[J].Journal of Applied Phycology,2008,20(3):213-217.
[5]于海峰,贾士儒.发状念珠藻胞外多糖的纯化与性质分析[J].生物工程学报,2008,24(6):1029-1034.
[6]Dai Y,Hou M,Man S,et al.Immunomodulatory Activities of Wild Nostoc flagelliforme Polysaccharide[C].2014 International Conference on Biological Engineering and Biomedical.Yichang,China:DEStech Publications,2014:1-11.
[7]林永贤,于海峰,许鹏,等.发菜多糖的提取及性质研究[J].现代食品科技,2007,(5):34-36.
[8]Yu H,Jia S,Dai Y.Accumulation of exopolysaccharides in liquid suspensionculture of Nostoc flagelliforme Cells[J]. Applied Biochemistry and Biotechnology,2010,160(2):552-560.
[9]ShiaoMS,Lee KR,Lin LJ,etal.Naturalproductsand biological activities of the Chinesemedicinal fungus ganoderma lucidum[C]. ACSsymposium series(USA):ACSPublications,1994:342-355.
[10]肖顺汉,任美萍,刘明华,等.黄芪多糖对荷瘤小鼠IL-2、IL-6、IL-12和TNF-α水平的影响[J].四川生理科学杂志,2009,31(1):7-8.
[11]Leong JW,Chase JM,Romee R,et al.Preactivation with IL-12,IL-15,and IL-18 induces CD25 and a functional highaffinity IL-2 receptor on human cytokine-induced memory-like naturalkillercells[J].BiologyofBlood and Marrow Transplantation,2014,20(4):463-473.
[12]DeBerge M,Ely K,Enelow R.TNF-αprocessing is required to limit the CD8+T-cell response and the extent of lung injury during influenza infection[J].The Journal of Immunology,2014,192:74-75.
[13]姚瑾.发菜提取物的抗氧化活性及发菜营养成分的研究[D].天津:天津科技大学,2009.
[14]王炳岩,季宇彬.海藻多糖对白血病L615小鼠LPO含量及GR,GSH—PX,CAT,SOD酶活性的影响[J].中医药信息,1994,11(5):43-45.
[15]Öztürk-Ürek R,Bozkaya L A,Tarhan L.The effects of some antioxidant vitamin-and trace element-supplemented diets on activities of SOD,CAT,GSH-Px and LPO levels in chicken tissues[J].Cellbiochemistry and function,2001,19(2):125-132.
[16]康龙丽,郭雄.过量氟对大鼠血清过氧化物抗氧化物及骨和软骨RNA含量的影响[J].中国地方病学杂志,2001,20(2):100-103.
[17]Kalaiselvi T,Panneerselvam C.Effect of L-carnitine on the status of lipid peroxidation and antioxidants in aging rats[J].The Journal of Nutritional Biochemistry,1998,9(10):575-581.
[18]Engel MA,Neurath MF.Anticancer properties of the IL-12 family--focus on colorectal cancer[J].Curr Med Chem,2010,17(29):3303-3308.
[19]Del Vecchio M,Bajetta E,Canova S,et al.Interleukin-12:biological properties and clinicalapplication[J].Clin Cancer Res,2007,13(16):4677-4685.
[20]陈雪峰,贾士儒,王岳,等.发菜多糖的红外光谱分析与抗氧化活性的研究[J].食品与发酵工业,2009(7):133-137.
Effect of extracellular polysaccharides from Nostoc flagelliforme on the levelof cytokine and antioxitation capacity ofm ice serum
FU Hong-lei,HOU Mao-Xia,SUN Zi-yue,YUE Li-fang,JIA Shi-ru,DAIYu-jie*
(College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
The effects of polysaccharides from liquid-cultured Nostoc flagelliforme(EPSA)and w ild Nostoc flagelliforme(EPSB)on the level of cytokine(TNF-α,IL-1,IL-6,IL-12)and the contents of GSH-PX,CAT,SOD,MDA of BALB/c Mice were investigated.Evidences indicated that the serum level of IL-6 was raised by high dose of EPSA(100mg/kg·d)and EPSB(100mg/kg·d)and the serum level of IL-6 was significantly(p<0.05)raised by high dose of EPSB(100mg/kg·d).Meanwhile,IL-12 was extrem ly enhanced(p<0.01)by different concentrations of EPSA and EPSB com pared w ith the control.Morever,the level of TNF-αwas remarkab ly inc reased(p<0.05)by high dose of EPSA(100mg/kg·d)and EPSB(100mg/kg·d).The content of CAT was enhanced(p<0.01)by high dose of EPSA(100mg/kg·d)or low dose of EPSB(50mg/kg·d).The content of GSH-PX was significantly enhanced(p<0.01)by high dose of EPSA(100mg/kg·d).The content of MDA was slightly enhanced by EPSA and EPSB w ith no significance(p>0.05).Besides,the content of SOD was significantly enhanced(p<0.05)by EPSA and extrem ly enhanced(p<0.01)by low dose of EPSB(50mg/kg·d).
Nostoc flagelliforme;polysaccharides;cytokine;antioxitation func tion
TS201.4
A
1002-0306(2015)06-0351-04
10.13386/j.issn1002-0306.2015.06.068
2014-07-30
符宏磊(1988-),女,硕士研究生,研究方向:生物分离工程、微藻培养。
戴玉杰(1965-),男,博士,教授,研究方向:生物分离工程、微藻培养及药物设计与合成。
国家自然科学基金资助项目(31271809)。
