复合微生态制剂和中草药对母猪繁殖性能、粪便菌群数量及哺乳仔猪生长性能的影响
2015-10-19谢全喜于佳民徐海燕张建梅
谢全喜, 于佳民, 徐 辉, 徐海燕, 张建梅, 谷 巍
(山东宝来利来生物工程股份有限公司,山东泰安 271000)
微生态制剂是一种利用正常微生物或促进微生物生长的物质经过特殊加工制成的活的微生物制剂,能调节肠道微生态平衡,促进有益微生物菌群的生长繁殖,抑制致病菌的生长繁殖,具有防病和促生长的作用(霍永久等,2012;祝镔,2010)。研究表明,乳酸菌、芽孢菌和酵母菌等益生菌对于肠道菌群平衡的调节至关重要。王不留行,系石竹科麦蓝菜的种子,为常用中草药,对雌性动物具有通乳、泌乳的作用,能刺激乳腺细胞增殖和乳蛋白合成(孟海洋,2013;丁月云,2008)。通草为五加科类植物,是目前应用广泛的中草药之一,具有良好的通气下乳功效(郑涛等,2012)。本试验旨在探讨复合微生态制剂和中草药对泌乳母猪繁殖性能、粪便微生物菌群及哺乳仔猪生产性能等的影响,为复合微生态制剂和中草药在泌乳母猪上的应用提供试验依据。
1 材料与方法
1.1 试验材料 复合微生态制剂:由山东宝来利来生物工程股份有限公司研究院研制,主要由乳酸杆菌、芽孢杆菌和酵母菌等组成,其活菌总数≥8.0×108cfu/g;试验所用中草药由王不留行和通草组成,均购自泰安市永春堂药业有限公司永春堂药店;载体为麦饭石。
1.2 试验日粮 基础日粮为玉米-豆粕型,以NRC(1998)中泌乳母猪的饲养标准为依据配制,日粮组成及营养水平见表1。
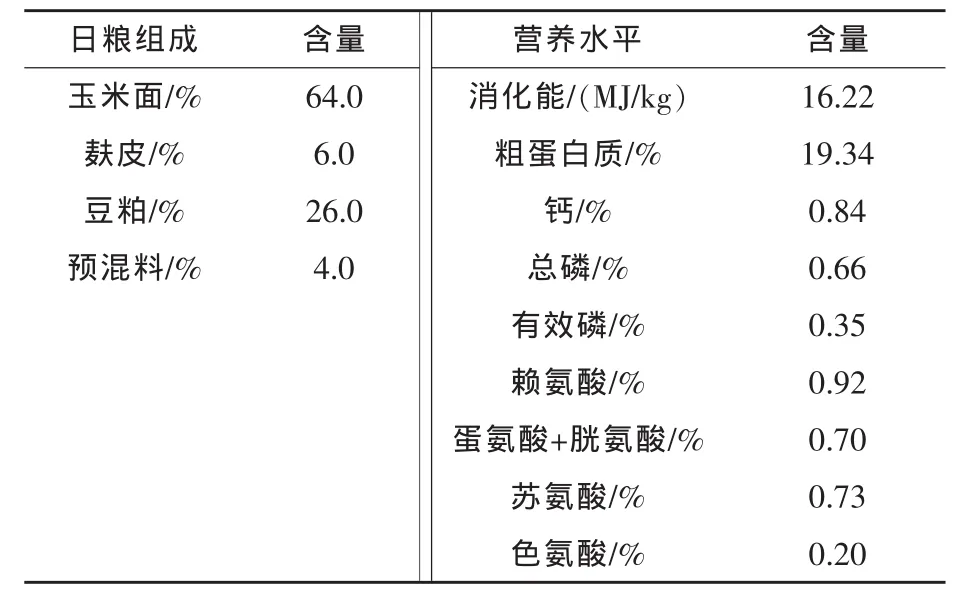
表1 基础日粮组成及营养水平(风干基础)
1.3 动物选择与分组 采用单因素完全随机试验设计,将胎次相同、体重和体况相近、健康无病的妊娠后期 (105 d左右)莱芜黑猪90头分为3组,每组3个重复,每重复10头。对照组饲喂基础日粮,试验Ⅰ组饲喂基础日粮+1.0‰复合微生态制剂+0.7‰中草药,试验Ⅱ组饲喂基础日粮+0.7‰中草药。
1.4 饲养管理 试验母猪饲养于双列式产房内,单栏饲养,水泥地面,排气扇通风。试验母猪从预产期前7 d开始采食试验日粮,日喂2次,保证料槽中不断料及料槽内的清洁卫生,自由饮水。哺乳期仔猪不教槽,并且通过隔离仔猪与母猪料槽来避免哺乳仔猪采食母猪料,随时观察猪的食欲、精神状况、粪便等情况。每天清扫圈舍2次,以保持圈内清洁。整个圈舍采取自然通风,所有圈舍进行定期消毒。预饲期7 d,正式期从分娩第一天开始至仔猪断奶结束,共28 d,分娩后1~7 d喂料情况参照猪场进行,7 d后母猪自由采食(以料槽中略有剩料为准)。试验期间,按猪场常规免疫程序进行免疫,驱虫。
1.5 测定指标
1.5.1 母猪繁殖性能及哺乳仔猪生长性能的测定母猪繁殖性能:分别记录每头母猪的总产仔数、活仔数、弱仔数(初生重小于0.9 kg)、初生个体重和窝重。弱仔率为弱仔数占活仔数的比例;活仔率为活仔数占总产仔数的比例。根据母猪的产活仔数和乳房发育情况调整母猪带仔数,使母猪实际带仔数为10头左右,记录每头母猪的实际带仔数;仔猪育成率为母猪带仔数与断奶仔猪数的比例。
哺乳仔猪生长性能:测定哺乳仔猪28日龄的断奶个体重和窝重,分别计算各组仔猪在哺乳期间的增重速度。
腹泻率/%=腹泻猪头次数/(试验猪头数×正式期天数)×100。
1.5.2 母猪泌乳力和常乳乳汁成分的测定 以同窝存活仔猪哺乳至21日龄时的全窝增重代表母猪的泌乳力,包括寄养的仔猪在内,但寄出仔猪的体重不计在内。
日泌乳量=(断奶窝重-初生窝重)×3/21。
采集每头母猪泌乳14 d的乳汁放入灭菌离心管中,-20℃保存备用,用福斯乳汁分析仪测定初乳成分。
1.5.3 乳汁中IgG和IgM的测定 采集每头母猪泌乳7 d和14 d的乳汁放入灭菌离心管中,-20℃保存备用,采用猪IgG和IgM酶联免疫检测试剂盒检测,测定OD450nm值,根据标准曲线计算样品中IgG和IgM含量,每个样品3个平行。
1.5.4 血清催乳素(PRL)含量的测定 每头母猪分娩后 7、14、21 d,每组随机挑选 15头母猪(共30头)用真空采血管耳缘静脉采血10 mL,分离血清,盛放于灭菌离心管中,-20℃保存备用。采用猪催乳素(PRL)ELISA检测试剂盒检测。

表2 复合微生态制剂和中草药对母猪繁殖性能的影响
1.5.5 母猪粪便菌群数量的测定 在母猪哺乳期14 d和28 d的08∶30,于母猪饲喂前采集其新鲜粪便,-20℃保存备用;将每头母猪2次粪样等量混匀,用平板菌落计数法测定粪便菌群数量。大肠杆菌采用伊红美蓝培养基,乳酸菌采用LBS培养基,采用十倍稀释计数法进行菌群计数,分别于37℃培养48 h后,记录菌落数,并换算成每克内容物所含菌落数。
1.6 数据处理 试验数据用Excel软件进行初步处理后,采用SPSS 13.0进行统计分析,采用Oneway ANOVA进行方差分析,LSD法进行组间多重比较,结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 复合微生态制剂和中草药对母猪繁殖性能的影响 由表2可知,各组试验猪的总产仔数、活仔数、死胎数、弱仔数、断奶仔猪数差异均不显著(P>0.05),其中试验Ⅰ组死胎数最少,比对照组降低了40.00%,活仔率最高,提高了8.57%;试验Ⅱ组死胎数低于对照组34.00%,活仔率高于对照组7.15%,差异均不显著。仔猪育成率试验Ⅰ组最高,分别高出对照组和试验Ⅱ组6.75%和1.93%。说明单独使用王不留行和通草类催乳中草药对母猪繁殖性能有所改善,但复合益生菌与中草药联用时效果更佳。
2.2 复合微生态制剂和中草药对哺乳仔猪生长性能及腹泻率的影响 由表3可知,与对照组相比,试验Ⅰ、Ⅱ组断奶重和平均日增重分别提高14.01%(P<0.05)、3.03%(P>0.05) 和25.73%(P<0.05)、6.52%(P > 0.05), 其中试验Ⅰ组平均日增重较试验Ⅱ组提高18.03%(P>0.05)。仔猪腹泻率试验Ⅰ组最低,分别低于对照组和试验Ⅱ组24.62%和21.59%(P<0.05)。说明在改善哺乳仔猪生产性能和降低腹泻率方面各试验组均比对照组好,其中以试验Ⅰ组效果最优。
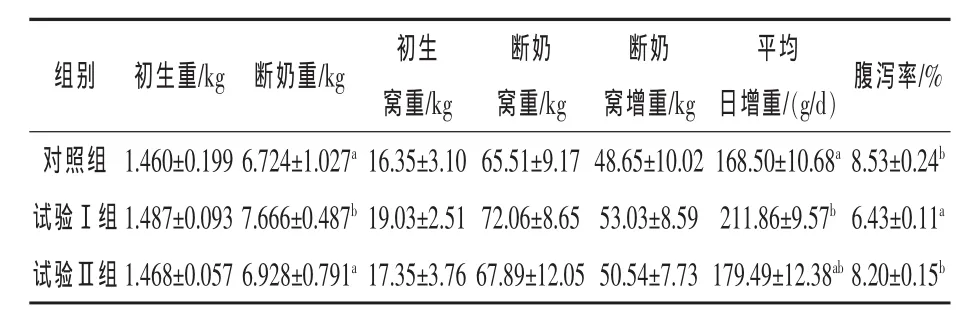
表3 复合微生态制剂和中草药对哺乳仔猪生长性能及腹泻率的影响
2.3 复合微生态制剂和中草药对母猪泌乳力的影响 由表4可知,母猪泌乳力方面,试验Ⅰ组和Ⅱ组分别高出对照组38.04%和25.06%(P<0.05),其中试验Ⅰ组高出Ⅱ组 10.38%(P>0.05);总耗料量方面,试验Ⅰ组和Ⅱ组分别高出对照组5.02%和4.55%(P>0.05);料乳比方面,试验Ⅰ组最低,分别低于对照组和试验Ⅱ组18.81%和4.77%(P>0.05)。在提高母猪泌乳力方面各试验组均比对照组高,差异显著。在提高总耗料量和降低料乳比方面效果均不显著。
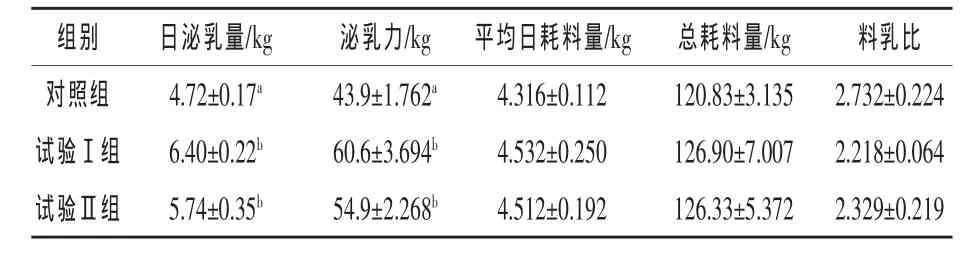
表4 复合微生态制剂和中草药对母猪泌乳力的影响
2.4 复合微生态制剂和中草药对泌乳14d常乳乳成分含量的影响 由表5可知,14 d时乳汁中乳脂、非脂、乳蛋白和乳糖含量各组间差异均不显著(P>0.05),其中乳脂、非脂和乳蛋白含量以试验Ⅰ组稍高。说明使用复合微生态制剂和中草药对乳汁中各成分含量无显著影响。
2.5 复合微生态制剂和中草药对乳汁中IgG和IgM含量的影响 由表6可知,IgM含量方面,7 d时试验Ⅱ组最高,高出对照组和试验Ⅰ组42.17%和24.56%(P>0.05);14 d时试验Ⅰ组最高,分别高出对照组和试验Ⅱ组23.28%和31.16%(P>0.05)。IgG含量方面,7 d和14 d时均为试验Ⅰ组最高,分别高出对照组、试验Ⅱ组25.49%、16.51%和 35.54%、80.30%,但差异均不显著(P>0.05)。可见,饲喂复合微生态制剂和中草药对母猪乳汁中免疫球蛋白含量影响不显著。
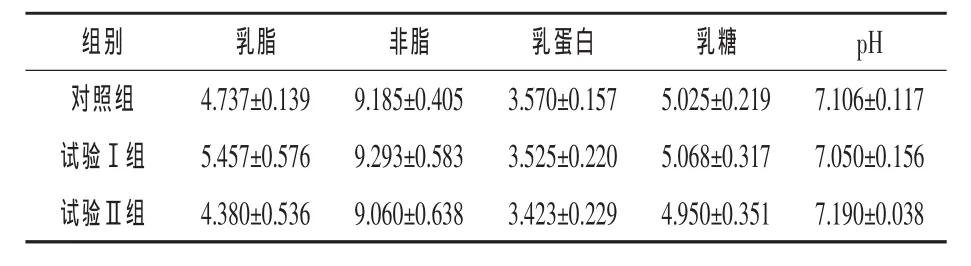
表5 复合微生态制剂和中草药对母猪14 d常乳乳成分含量的影响
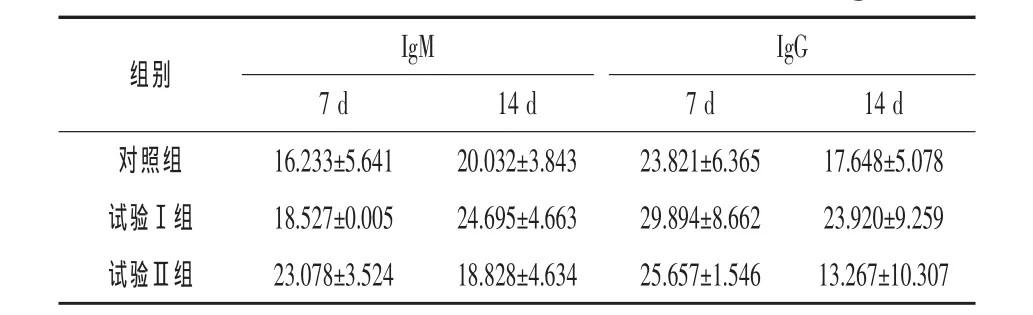
表6 复合微生态制剂和中草药对乳汁IgG和IgM含量的影响 ng/mL
2.6 复合微生态制剂和中草药对母猪血清催乳素含量的影响 由表7可知,7 d、14 d和21 d各试验组母猪血清中催乳素含量均以试验Ⅰ组最高,但差异均不显著(P>0.05),说明复合微生态制剂、王不留行和通草等对母猪血清中催乳素含量无显著影响。
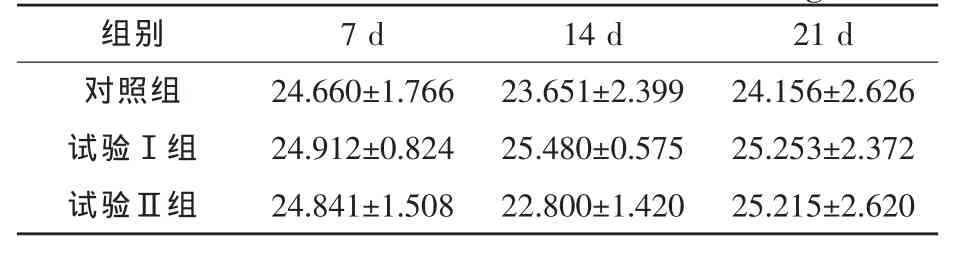
表7 复合微生态制剂和中草药对母猪血清PRL含量的影响 ng/mL
2.7 复合微生态制剂和中草药对母猪粪便菌群数量的影响 由表8可知,大肠杆菌方面,与对照组相比,试验Ⅰ组母猪粪便大肠杆菌数降低了4.71%(P<0.05),试验Ⅱ组与对照组间差异不显著(P>0.05);乳酸杆菌方面,试验Ⅰ组最高,分别高出对照组和试验Ⅱ组6.63%和6.94%(P<0.05);R/D常作为动物肠道健康的评价指标,试验Ⅰ组R/D值最高,高出对照组11.82%(P>0.05)。在改善母猪粪便菌群方面,试验Ⅱ组猪只饲喂中草药时和对照组相比无显著差异,但试验Ⅰ组由于复合益生菌的添加调节了肠道的菌群平衡,维持了肠道健康。

表8 复合微生态制剂和中草药对母猪粪便菌群数量的影响 lg cfu/g
3 讨论
3.1 复合微生态制剂和中草药对母猪繁殖性能的影响 目前有关益生菌或中草药在哺乳母猪上的应用报道较多。曹国文等(2008)在母猪产前30 d开始每天每头饲喂含30 g复方女贞子散的日粮到仔猪40日龄断奶,结果显示,母猪的产活仔数、成活率均提高,仔猪初生重、断奶重和日增重均极显著提高。本试验结果表明,给泌乳母猪饲喂复合微生态制剂和中草药能够提高繁殖性能,在一定程度上降低了仔猪死胎数,提高了仔猪活仔率和育成率。显著提高了母猪泌乳力,同时在一定程度上改善了乳汁品质,为哺乳仔猪的生长发育提供了保障,也保证了断奶母猪具有良好的体况。
3.2 饲喂复合微生态制剂和中草药对哺乳仔猪生长性能及腹泻率的影响 本试验结果表明,试验Ⅰ组由于复合微生态制剂的添加显著提高了哺乳仔猪断奶重和平均日增重,同时显著降低了仔猪的腹泻率。主要是因为泌乳母猪日粮中添加复合微生态制剂,改善了母猪肠道菌群平衡及母猪泌乳性能,为仔猪提供充足的乳汁营养 (韦明宇等,2012)。同时,仔猪刚出生时的肠道是无菌的,出生后随着仔猪哺乳以及与产床等环境的接触,外来菌群进入肠道,经过黏附和定植,建立自身的肠道菌群。给泌乳母猪饲喂复合微生态制剂,可使得有益菌通过哺乳进入仔猪肠道,使得乳酸菌等有益菌较早占据优势,竞争抑制其他病原菌的黏附和繁殖,有效阻止有害菌的入侵,降低仔猪腹泻等疾病的发生(兰青,2008)。
3.3 饲喂复合微生态制剂和中草药对母猪繁殖性能和哺乳仔猪生长性能影响的作用机理 本试验结果表明,试验Ⅰ组由于添加复合微生态制剂提高了母猪泌乳7 d和14 d乳汁中IgG和IgM含量,均高出对照组20%以上。添加微生态制剂和中草药对14 d常乳中乳脂、非脂和乳蛋白含量也具有一定的影响。IgG和IgM是母猪初乳中的主要免疫球蛋白,能活化补体,清除病原体,增强仔猪免疫力(Klobasa等,1981)。母猪胎盘为上皮绒毛膜型,妊娠期免疫球蛋白等大分子物质不能通过胎盘传递到仔猪体内,同时,母乳是仔猪初生最重要的营养物质,母乳中所含的蛋白质在仔猪体内消化率极高。因此母乳的营养水平及泌乳量直接影响仔猪生长性能及后期健康状况(秦宜德,2000)。本试验中饲喂复合益生菌和中草药对母猪血清中催乳素含量无显著影响。这与王不留行等中草药类催乳作用的试验结果并不完全一致。苗培(2007)研究发现,对大鼠灌服王不留行提取液后显著提高了血清、乳腺和脑垂体中催乳素水平。但本试验中各试验组添加了王不留行提取液并未提高母猪血清中催乳素含量。
本试验结果表明,饲喂复合微生态制剂能够显著降低母猪粪便中大肠杆菌的数量,显著提高母猪粪便中乳杆菌的数量。这与许多研究结果相一致。楚青惠等(2014)研究发现,饲喂乳酸菌能够降低母猪粪便中大肠杆菌和沙门氏菌的数量,提高乳酸菌的数量。Muralidhara等(1977)研究发现,饲喂乳酸菌能显著降低仔猪肠道组织及粪便中大肠杆菌、沙门氏菌等有害菌的数量,增加乳酸菌菌群数量。肠道内由于乳酸菌和芽孢菌等有益微生物的增加,竞争抑制了致病微生物的生长,使其数量减少。
4 结论
本试验结果表明,给泌乳期母猪饲喂1.0‰复合微生态制剂+0.7‰中草药对其繁殖性能、泌乳性能、粪便菌群数量及哺乳仔猪生长性能、腹泻率等有一定改善作用。
[1]曹国文,张邑凡,陈春林,等.“复方女贞子散”对繁殖母猪生产性能与哺乳仔猪生长性能的影响[J].饲料工业,2008,29(10):4 ~ 5.
[2]楚青惠,汪官保,曾勇庆,等.饲喂乳酸菌对母猪和哺乳仔猪生长性能、血清生化指标及粪便微生物数量的影响 [J].动物营养学报,2014,26(11):3362~3370.
[3]丁月云.王不留行、黄芪对奶牛乳腺上皮细胞体外增殖与分泌功能影响的研究:[博士学位论文][D].南京:南京农业大学,2008.
[4]霍永久,张艳云,施青青,等.芽孢杆菌1259制剂对生长肥育猪生产性能及猪粪氨气产生量的影响[J].江苏农业科学,2012,40(2):159 ~ 161.
[5]兰青.仔猪主要肠道菌群分布的研究和益生菌对仔猪生长发育及免疫功能的影响:[硕士学位论文][D].雅安:四川农业大学,2008.
[6]孟海洋.王不留行对奶牛乳腺上皮细胞泌乳信号转导通路的影响:[硕士学位论文][D].哈尔滨:东北农业大学,2013.
[7]苗培.王不留行提取液对试验大鼠的泌乳量和催乳素的合成与释放的影响:[硕士学位论文][D].郑州:河南农业大学,2007.
[8]秦宜德.猪乳中蛋白质的动态变化及一组高分子量蛋白质的多态性和鉴定:[博士学位论文][D].南京:南京农业大学,2000.
[9]韦明宇,陆建明,赵武,等.NS复合乳酸菌制剂对母猪生产性能和免疫水平的影响[J].安徽农业科学,2012,40(5):2728 ~ 2730.
[10]郑涛,杨祖菁,钱林溪.通草增加哺乳期乳汁分泌的机制研究[J].上海交通大学学报(医学版),2012,6(32):7 ~ 10.
[11]祝镔.适于母猪使用的微生态制剂研究进展[J].猪业科学,2010,27(9):32~34.
[12]Klobasa F,Werhahn E,Butler J E.Regulation of humoral immunity in the piglet by immunoglobulins of maternal origin [J].Research in Veterinary Science,1981,31(2):195 ~ 206.
[13]Muralidhara K S,Sheggeby G G,Ellikerp R,et al.Effect of feeding Lactobacillus on the coliform and Lactobacillus flora of intestinal tissue and feces from piglets[J].Journal of Food Protection,1977,40(5):288 ~ 295.■
