明胶、阿拉伯胶复合凹土制备乳酸菌微胶囊研究
2015-10-19冯云琪
冯云琪
(淮阴工学院生命科学与食品工程学院,江苏淮安 223001)
明胶和阿拉伯胶均为具有良好生物亲和性的天然高分子材料,明胶是一种蛋白质,阿拉伯胶是一种多聚糖,均可作为微胶囊制备的理想壁材。在pH=4左右,明胶带正电荷较多,阿拉伯胶带负电荷较多,可中和形成复合物,再加入固化剂,形成交联状的网状结构而成囊 (孙燕婷等,2013)。凹土是一种天然非金属粘土矿物质,具有特殊纤维晶体形态结构,具有较好的生物亲和性,其本身可作为益生菌载体,当在微胶囊壁材中添加该物质时,又可较好地提高微囊的机械强度和通透性(赵玉萍等,2013、2012)。本试验以载菌凹土为芯材,以明胶、阿拉伯胶复合凹土作为壁材制备微囊胶,研究该壁材对益生菌在胃肠环境中的保护作用,旨在为饲料用益生菌制剂的制备提供一定的参考。
1 材料与方法
1.1 材料与仪器 乳酸杆菌由江苏省生物质转化与过程集成工程实验室筛选保藏;凹土由江苏省凹土资源利用重点实验室提供;牛肉膏、蛋白胨、酵母浸膏、胃蛋白酶、胰蛋白酶购自日本Sigma公司;其他试剂购自国药集团化学试剂有限公司。
722N型可见光分光光度计(上海精密科学仪器有限公司);JJ-1型精密增力电动搅拌器(金坛市荣华仪器制造有限公司);TGL-16G-A型台式高速冷冻离心机 (上海安亭科学仪器厂);BSD-YX3200型立式双层智能精密摇床 (上海博讯实业有限公司医疗设备厂);BL-50A型立式压力蒸汽灭菌锅 (上海博讯实业有限公司医疗设备厂);90-3型恒温双向磁力搅拌器(上海振荣科学仪器有限公司)。
1.2 培养基及人工胃肠液的配制 乳酸杆菌的培养基为MRS培养基:牛肉膏10 g,蛋白胨10 g,酵母浸膏 5 g,K2HPO42 g,柠檬酸二铵 2 g,乙酸钠 2 g,葡萄糖 20 g,MnSO4·4H2O 0.25 g,MgSO4·7H2O 0.58 g,吐温-801 mL,水 1000 mL,pH 6.2 ~6.4(赵玉萍和方芳,2013)。
人工胃液:胃蛋白酶10g,NaCl 2 g,加水定容至 1000 mL,pH 2.5(赵玉萍等,2013)。
人工肠液:胰蛋白酶 10 g,KH2PO46.8 g,加水定容至 1000 mL,pH 6.8(李宁,2007)。
人工胃肠液均用0.2 μm滤膜过滤备用。
1.3 试验方法
1.3.1 凹土的纯化 将未经处理的凹土研磨,过200目筛,以10%的量加入去离子水,磁力搅拌器搅拌24 h后,静置4 h,取中间层凹土悬液,以10%的量加入去离子水,重复3次(赵玉萍等,2012)。
1.3.2 复凝聚法制备乳酸菌微胶囊
1.3.2.1 复凝聚法制备乳酸菌微胶囊方法 乳酸菌在MRS培养基中于37℃静置培养,2000 r/mim离心 10 min,取沉淀备用(赵玉萍等,2013)。
载菌凹土的制备:适量菌悬液和凹土在pH 6.5,35℃吸附40 min,冷冻干燥备用(赵玉萍等,2015;Rong 等,2008)。
微囊的制备:将适量明胶、凹土、载菌凹土和Tween-80于40℃混合,搅拌均匀,恒温加入阿拉伯胶溶液,继续搅拌均匀,用稀盐酸溶液调节pH至3.6~4.0。
微囊的固化:上述混合液自然冷却至25℃左右,再以冰浴冷却至10℃以下,加入一定量戊二醛固化剂,搅拌15 min后,用10%NaOH溶液调pH至8~9,继续搅拌至胶囊析出(于乐军,2009)。
微胶囊的收集:离心收集并洗涤固化后的微胶囊产品。
1.3.2.2 明胶-阿拉伯胶复合凹土微囊制备的适宜条件的确定 适宜菌胶比例的确定:明胶-阿拉伯胶胶体质量总浓度为4%(质量比为1∶1),凹土0.2%,pH 4.0,于25℃反应 20 min,菌胶质量比例分别为 1∶5、1∶6、1∶7、1∶8、1∶9(菌体的量为载菌凹土的质量),考察其对乳酸菌微胶囊包埋率以及模拟胃肠环境的释放率的影响。
在单因素试验中,明胶-阿拉伯胶复合胶体用量分别为2%、3%、4%、5%、6%,其质量比分别为1.5∶1、1.2∶1、1∶1、1∶1.2、1∶1.5, 凹 土 用 量 分 别 为0.1%、0.2%、0.4%、0.6%、0.8%, 反应温度分别为15、20、25、30、35 ℃,凝聚 pH 分别为 3.6、3.7、3.8、3.9、4.0,反应时间分别为 10、20、30、40、50 min。
1.3.2.3 微胶囊质量初步评价 包埋率按以下公式计算:

活菌数测定采用菌落总数计数法。
包埋前活菌数计数:取包埋前的菌液,稀释到适当倍数后取0.2 mL涂布,37℃培养48 h,计数。
未包埋活菌数计数:取微胶囊离心上清液,用无菌水洗涤数次,收集上清和洗涤液稀释到适当倍数后取0.2 mL涂布,37℃培养24~48 h,计数。
1.3.2.4 耐胃肠环境试验 将1 g微胶囊置于100mL人工胃液中,于37℃水浴恒温振荡150r/min,分别于0、l、2、3 h进行活菌计数,然后将微胶囊于2000 r/min离心10 min并经生理盐水洗涤后,转至100 mL人工肠液中,于37℃水浴恒温振荡150 r/min, 分别于 0、2、4、6、8、10、12 h 进行活菌计数。同时与未经包埋的菌体与载菌凹土作对照(尹尉翰等,2011)。
2 结果与讨论
2.1 菌胶比的确定 菌胶比对微囊包埋率影响较大,若菌胶比过高,菌体过量,壁材不能将菌体完全包裹;若菌胶比例过低,壁材过量,虽然包埋率高,但因包埋过于致密不利于菌体释放。菌胶比对乳酸菌微胶囊包埋率的影响结果如图1所示。
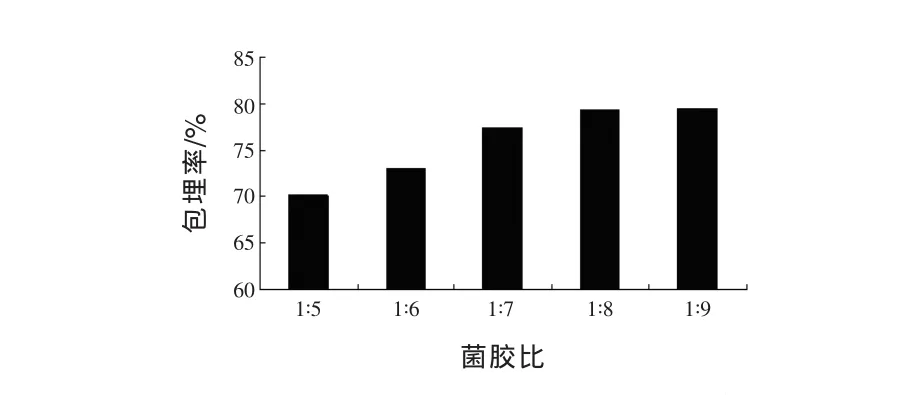
图1 菌胶比对包埋率的影响
由图1可以看出,随着菌胶比的不断减小,微胶囊的包埋率不断增大。当菌胶比为1∶5时包埋率最低,为70.1%;菌胶比为1∶9时包埋率最高,为79.5%。当菌胶比从1∶5降低到1∶8时,微胶囊粒径有所减小,包埋率明显提高,达79.3%,但随着菌胶比的降低,微胶囊包埋菌体量亦逐渐降低,综合包埋率和包埋量两个因素,确定菌胶比为 1∶8。
2.2 明胶-阿拉伯胶复合胶体用量的确定 壁材浓度过低或过高均会影响微胶囊产品的外观均匀度和圆整性。若明胶-阿拉伯胶复合胶体用量过少,形成的微胶囊量少,包埋率亦随之下降,若用量过多,加入戊二醛后会形成凝胶状而非微胶囊。复合胶体用量对包埋率影响结果如图2所示。

图2 复合胶体用量对微胶囊包埋率的影响
由图2可以看出,随着复合胶体用量的不断增大,微胶囊的包埋率先增大后减小,当复合胶体用量为4%时,包埋率最大为79.9%。可能是当复合胶体浓度较低时,胶体电离电荷较少,能够形成的微胶囊数量少,包埋率亦较低;随着复合胶体浓度的增大,两者电离电荷增加,因此能够形成的胶囊数量增加,包埋率增大;当明胶-阿拉伯胶复合胶体的浓度大于5%时,由于复合胶体浓度过高、黏度较大,形成的微胶囊相互粘连,导致包埋率也随之下降。
2.3 适宜明胶-阿拉伯胶质量比的确定 由图3可知,随着明胶-阿拉伯胶质量比的增加,微胶囊的包埋率先增加后减小,当明胶∶阿拉伯胶为1∶1时,包埋率最大为90.4%,可能是因为明胶所带正电荷和阿拉伯胶所带负电荷恰好完全中和。
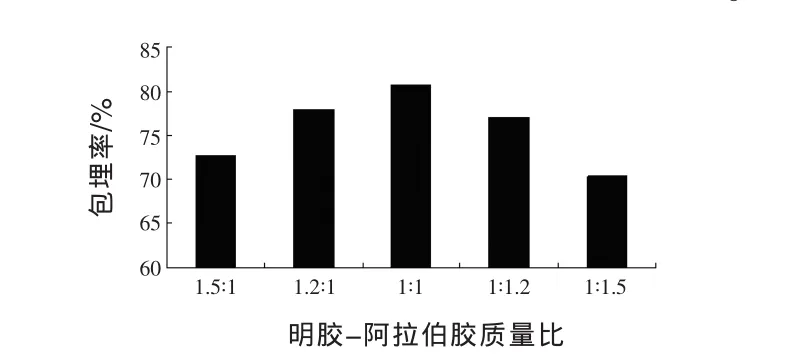
图3 明胶-阿拉伯胶质量比对微胶囊包埋率的影响
2.4 适宜凹土用量的确定 载菌凹土减少了复凝聚过程中菌体的损失,在壁材中添加凹土会增加微胶囊的机械强度(赵玉萍等,2012)。凹土用量对包埋率的影响结果如图4所示。
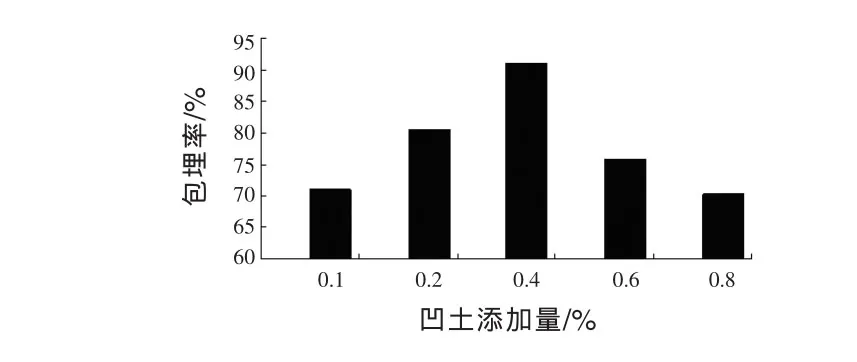
图4 凹土添加量对微胶囊包埋率的影响
由图4可知,随着凹土用量的不断增加,微胶囊的包埋率先增大后减小。当凹土用量为0.4%时,包埋率最高为91.1%,再增加凹土用量包埋率反而下降,原因可能是随着凹土用量的增加,降低了成囊性。
2.5 适宜复凝聚反应时间的确定 足够的反应时间会使明胶-阿拉伯胶凹土复合体系反应充分,可将菌体尽可能地充分包埋,保证了形成的微胶囊数量,结果如图5所示。
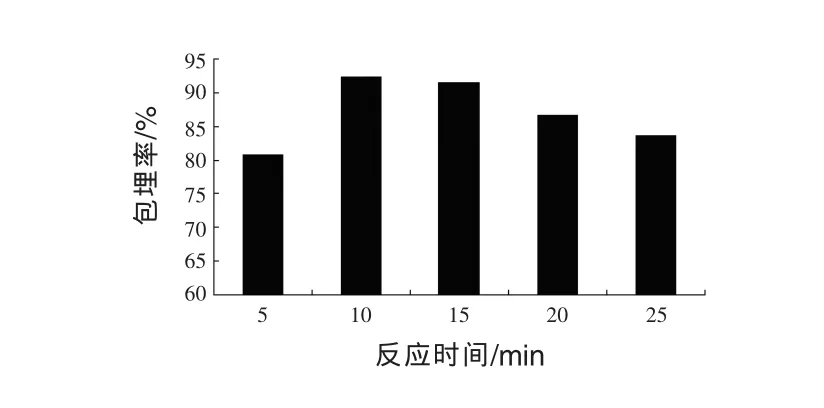
图5 反应时间对微胶囊包埋率的影响
由图5可以看出,随着复凝聚反应时间的增加,微胶囊包埋率逐渐增加后趋于稳定,当反应时间为10 min时,包埋率已达到92.4%。
2.6 适宜凝聚pH的确定 在不同的pH条件下,明胶和阿拉伯胶带电性质不同,交联反应程度不同,试验结果如图6所示。
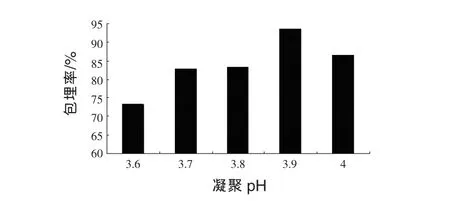
图6 凝聚pH对微胶囊包埋率的影响
由图6可以看出,当pH在3.9时,微胶囊的包埋率最高,为93.6%。可能是因为pH为3.9时,明胶所带的正电荷最多,而阿拉伯胶此时带负电荷,因此形成的微胶囊量也最多(于乐军,2009)。
2.7 适宜反应温度的确定 低温时复凝聚反应不易发生,因为明胶溶液呈冻凝状,阿拉伯胶溶液黏度较大;高温时,分子热运动速率较快,且不易凝聚在载菌凹土周围,因此会影响微胶囊的形成,所以适宜的反应温度会对微胶囊的包埋率产生影响,结果如图7所示。
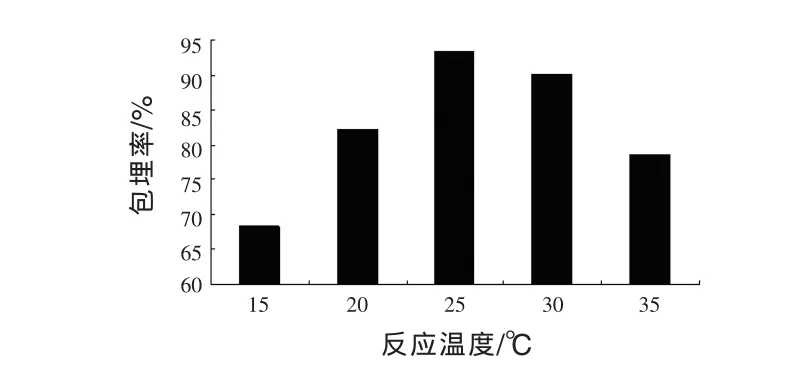
图7 反应温度对微胶囊包埋率的影响
由图7可以看出,随着温度的升高,微胶囊的包埋率先升高后下降,温度为25℃时,包埋率最高,为93.3%。
2.8 微胶囊在模拟胃肠环境中的释放率 按上述方法和步骤制得乳酸菌微胶囊,经冷冻干燥后获得活菌制剂。将未经任何保护的乳酸杆菌、负载在凹土上的乳酸杆菌和微胶囊制剂在模拟人工胃肠环境下进行试验,0~3 h为模拟胃环境,3~15 h为模拟肠环境。由图8可知,在胃环境中载菌凹土和微胶囊释放比率接近,但在肠环境中,微胶囊能较长时间地保持活菌比率,证明明胶-阿拉伯胶-凹土复合壁材对于乳酸菌具有较好的保护作用。

图8 人工肠胃环境下活菌释放率与时间的关系
3 结论
本试验以明胶、阿拉伯胶复合凹土作为壁材,以载菌凹土作为芯材,制备乳酸杆菌微胶囊制品,经人工模拟胃肠环境作用发现,载菌凹土与微胶囊在胃环境中的乳酸杆菌的释放率接近,但在肠环境中,微胶囊中的乳酸杆菌却能在很长时间保持活性,说明本试验中所用的壁材对乳酸杆菌具有较好的保护作用。在微胶囊的制备过程中,与仅以明胶、阿拉伯胶作为壁材的微胶囊相比,本试验所用的胶体总量、交联pH、固化时间和温度等参数均发生了变化,尤其是胶体用量从15%降为4%,但仍可保持较高的包埋率,节约了成本。可能是因为凹土的添加,其表面的电荷影响了明胶、阿拉伯胶的表面电荷,从而使固化条件均发生了变化,关于这方面的机理有待进一步深入研究。
[1]李宁.双歧杆菌微胶囊制备工艺及功能特性的研究:[硕士学位论文][D].保定:河北农业大学,2007.
[2]孙燕婷,黄国清,肖军霞,等.阿拉伯胶/壳聚糖复凝聚相的制备及表征[J].中国食品学报,2013,13(2):43.
[3]尹尉翰,雷涵,徐宇虹.海藻酸钙微囊对乳酸乳球菌在胃肠道环境中的保护作用[J].微生物学通报,2011,38(8):1228 ~ 1234.
[4]于乐军.明胶/阿拉伯胶复凝聚微胶囊技术用于乳酸菌保护的研究:[硕士学位论文][D].青岛:中国海洋大学,2009.
[5]赵玉萍,方芳.应用微生物学实验[M].南京:东南大学出版社,2013.11.
[6]赵玉萍,黄颖娟,吴洁,等.以凹土为载体的新型益生菌制剂的制备[J].食品工业科技,2013,34(19):141 ~ 144.
[7]赵玉萍,唐梓鑫,杨莉,等.凹土对乳酸球菌的吸附条件优化[J].食品与机械,2015,1:46 ~ 49.
[8]赵玉萍,徐岩,王栋.固定化耶氏酵母提高产γ-癸内酯能力[J].食品工业科技,2012,33(6):230 ~ 233.
[9]Rong X M,Huang Q Y,He X M,et al.Interaction of pseudomonas putida with kaolinite and montmorillonite:a combination study by equilibrium adsorption,ITC,SEM and FTIR [J].Colloids and surfaces B:Biointerfaces,2008,64:49 ~ 55.■
