miR-186对C2C12中myogenin基因表达的抑制研究
2015-12-16苏欣
苏 欣
(白城职业技术学院,吉林白城 137000)
骨骼肌分化是一个复杂并且严格的程序化过程,由中胚层细胞定向分化成成肌细胞,然后成肌细胞增殖,不可逆地退出细胞周期,最终由单核前体细胞融合形成多核体细胞 (肌管)(Sabourin和Rudnicki,2000)。在这个复杂的过程中,肌肉调节因子(MRFs)起到重要的调节作用。MRFs属于碱性螺旋-环-螺旋 (bHLH)转录因子家族,包括Myf5、MyoD、Myf6 和 myogenin (Yun 和 Wold,1996),其中myogenin在骨骼肌分化的后期起到重要的调节作用(Pownall等,2002)。 Myogenin基因敲除小鼠出生后由于骨骼肌发育严重缺陷致死,其肌细胞不能融合形成多核的肌纤维(Hasty等,1993)。有报道称下调内源myogenin基因的表达可以抑制C2C12成肌细胞的分化(Mastroyiannopoulos等,2012)。
miRNAs是一类高度保守的,长约22个核苷酸的非编码单链小分子RNA,可结合于靶基因mRNA的3’-UTR区,促进其mRNA降解或抑制转录(Bartel,2009)。 大量研究指出,miRNAs可调节肌细胞生成过程中相关基因和转录因子的表达,如miR-148可通过抑制ROCK1基因而促进肌肉分化 (Zhang等,2011),miR-27可通过调节PAX3而影响成肌进程(Crist等,2009)。本试验旨在研究miR-186对C2C12成肌细胞中myogenin基因的调节作用。
1 材料与方法
1.1 试验材料与试剂 鼠源成肌细胞C2C12,购自中国科学院上海生化所干细胞库。
主要试剂:DMEM(Hyclone)、胎牛血清(FBS,Gibco)、马血清(Gibco)、谷氨酰胺(Invitrogen)、细胞裂解液(Promega)、TRNzol-A+reagent(天根,北京)、荧光素酶报告分析系统 (Promega)、抗体myogenin(abcam)、GAPDH(武汉三鹰)、山羊抗兔和山羊抗小鼠HRP标记的二抗(碧云天)。
1.2 细胞培养及处理 细胞培养及诱导分化:将C2C12细胞等密度接种于6孔板,用生长培养基培养(GM,含10%浓度的胎牛血清),培养细胞长至70% ~80%密度时,换成分化培养基(DM,含2%浓度的马血清)于37℃、5%CO2培养箱中培养1~4 d,诱导其分化。
细胞转染:将100 pmol的miRNA mimic、antimiR和阴性对照miRNA与X-tremeGENE 9转染试剂(Roche)加入到Opti-MEM培养液中(Invitrogen)。24 h后,将构建的小鼠野生型 myo genin 3'-UTR荧光素酶质粒和对照质粒用脂质体3000(Invitrogen)分别转染至细胞。
1.3 RNA提取及反转录成cDNA 使用miR-cute miRNA提取分离试剂盒(天根,北京)对收获的细胞进行RNA提取。然后用cDNA第一链合成试剂盒(天根,北京)制备合成cDNA。
1.4 实时荧光定量PCR (qRT-PCR) 使用BioEasy SYBR Green I实时 PCR试剂盒(Bioer Technology,杭州)对上述反转录得到的cDNA进行qRT-PCR检测,反应体系为25 μL。反应条件如下:
95℃预变性 3 min,95℃变性 10 s,55℃退火15 s,72℃延伸15 s,共40个循环。使用BIORAD iQ5 Multicolor Real-Time PCR检测系统进行扩增和检测,每个样本重复3次。
1.5 蛋白质提取及蛋白质印迹 取出细胞,弃掉培养液,PBS清洗2次,每孔加入200 μL的细胞裂解液,在冰面上裂解10 min后吸取至离心管,冰上继续裂解 10 min,4℃、12000 r/min离心 10 min,吸取上清。用BCA法测定蛋白质浓度,取等量蛋白进行SDS-PAGE电泳分离,恒压80 V电泳约2 h。然后在90 V的条件下电转膜1.5 h,将蛋白转移至NC膜上,5%脱脂奶粉室温封闭2 h,分别加入相应的一抗 (myogenin稀释浓度为1∶2000;GAPDH的稀释浓度为 1∶4000)4℃孵育过夜。TBST洗涤NC膜3次,每次室温摇动洗涤10 min。加入HRP标记的兔抗小鼠或羊抗兔IgG抗体(稀释浓度均为1∶2000),室温摇动 1 h,再用 TBST洗涤NC膜3次,每次室温摇动洗涤10 min。ECL化学发光后分析结果。
1.6 荧光素酶活性分析 在细胞转染24 h后收获并裂解细胞,使用荧光素酶活性分析试剂盒分析荧光素酶活性,经酶标仪定量后与标准化的荧光素酶表达对照进行对比分析得到结果。
1.7 统计分析 数据采用SPSS 11.5软件进行统计分析,P<0.05表示统计学差异显著。
2 结果与分析
2.1 C2C12细胞分化过程中miR-186的变化将C2C12细胞用生长培养基(GM)培养,培养至80% ~90%密度后,换成分化培养基(DM)培养,在1~4 d时分别收取细胞并对其中miR-186的表达量进行检测。结果表明,miR-186在刚刚换至分化培养基的第1天时表达显著增加(P<0.05),并随着分化完成(第2~4天)表达量逐渐下降(P<0.01或 P < 0.05)(图 1)。

图1 miR-186在C2C12细胞中的表达
2.2 miR-186抑制C2C12细胞分化过程中myogein基因的表达 为了研究miR-186是否可调节内源myogenin水平,将miR-186 minics和miR-186抑制剂(amiR-186)分别转染入经分化培养基(DM)诱导分化1 d的C2C12细胞中,通过Western Blot检测到C2C12细胞中内源myogenin的蛋白水平,与阴性对照miRNA相比,miR-186可以明显抑制分化中的C2C12细胞的myogenin水平,而amiR-186则反之(图2)。
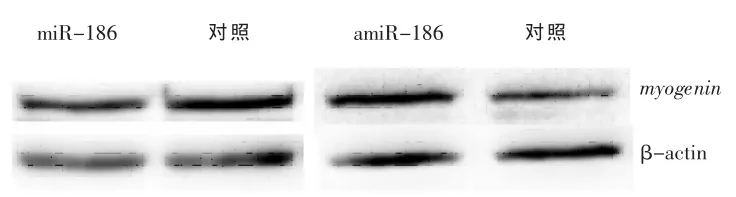
图2 miR-186对诱导分化的C2C12中myogenin蛋白的调节
2.3 miR-186通过与myogenin的3'-UTR区结合抑制myogenin 为了检测miR-186是否作用于myogenin的3'-UTR,将小鼠myogenin的3'-UTR区插入到荧光素酶基因下游后转入293t细胞中。结果显示,与单独转入myogenin的3'-UTR区,或者同时转入myogenin 3'-UTR区和miRNA阴性对照(miR对照)相比,转入miR-186可以有效地抑制约60%的荧光素酶活性 (P<0.05)(图3)。说明miR-186通过作用于myogenin的3'-UTR区来抑制myogenin。
3 讨论与结论

图3 荧光素酶分析检测miR-186对myogenin的3'-UTR的作用
miR-186在C2C12细胞分化前期显著上调,随着分化的逐渐完成,miR-186的表达量也随之下降,这说明miR-186对C2C12细胞分化存在着某种调控作用。同时,本试验证明miR-186结合于myogenin的3'-UTR区从而抑制其表达。由此可见,miR-186可能通过抑制myogenin基因的表达而抑制C2C12成肌细胞的分化过程。
尽管miR-186在骨骼肌和心肌中表达影响肌肉分化,但是miR-186并不是肌肉特异性表达的,也有文献指出miR-186在癌细胞的细胞周期调 节 中 起 作 用 (Cai等 ,2013;Zhou 等 ,2008)。miR-186存在于ZRANB2基因的第8和第9外显子之间的内含子中,其表达与ZRANB2基因的表达呈正相关性,而ZRANB2广泛表达于多种组织中(Adams等,2001)。
本试验结果表明,miR-186在C2C12细胞诱导分化初期表达上调,并且是myogenin的调节子,能通过作用于myogenin的3'-UTR区抑制myogenin的表达,从而抑制肌细胞的分化。
[1]Adams D J,van der Weyden L,Mayeda A,et al.ZNF265-a novel spliceosomal protein able to induce alternative splicing[J].The Journal of cell biology,2001,154:25~32.
[2]Bartel D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136:215~233.
[3]Cai J,Wu J,Zhang H,et al.miR-186 downregulation correlates with poor survival in lung adenocarcinoma,where it interferes with cell-cycle regulation[J].Cancer research,2013,73:756~766.
[4]Crist C G,Montarras D,Pallafacchina G,et al.Muscle stem cell behavior is modified by microRNA-27 regulation of Pax3 expression[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106:13383~13387.
[5]Hasty P,Bradley A,Morris J H,et al.Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene[J].Nature,1993,364:501~506.
[6]Mastroyiannopoulos N P,Nicolaou P,Anayasa M,et al.Down-regulation of myogenin can reverse terminal muscle cell differentiation[J].PloS one,2012,7:e29896.
[7]Pownall M E,Gustafsson M K,Emerson Jr C P.Myogenic regulatory factors and the specification of muscle progenitors in vertebrate embryos[J].Annual review of cell and developmental biology,2002,18:747~783.
[8]Sabourin L A,Rudnicki M A.The molecular regulation of myogenesis[J].Clinical genetics,2000,57:16~25.
[9]Yun K,Wold B.Skeletal muscle determination and differentiation:story of a core regulatory network and its context[J].Current opinion in cell biology,1996,8:877~889.
[10]Zhang H,Li Y,Huang Q,et al.MiR-148a promotes apoptosis by targeting Bcl-2 in colorectal cancer[J].Cell death and differentiation,2011,18:1702 ~1710.
[11]Zhou L,Qi X,Potashkin J A,et al.MicroRNAs miR-186 and miR-150 down-regulate expression of the pro-apoptotic purinergic P2X7 receptor by activation of instability sites at the 3'-untranslated region of the gene that decrease steady-state levels of the transcript[J].The Journal of biological chemistry,2008,283:28274~28286.
