非小细胞肺癌患者原发病灶的糖代谢与化疗疗效的关系:一个以PERCIST为评价标准的初步研究
2015-10-17陈美洁杜补林李亚明
陈美洁,李 娜,杜补林,李亚明
(中国医科大学附属第一医院核医学科,辽宁 沈阳 110001)
非小细胞肺癌患者原发病灶的糖代谢与化疗疗效的关系:一个以PERCIST为评价标准的初步研究
陈美洁,李娜,杜补林,李亚明
(中国医科大学附属第一医院核医学科,辽宁 沈阳110001)
目的:探究非小细胞肺癌患者原发病灶的糖代谢指标肿瘤代谢体积(MTV)和病变总体糖酵解(TLG)在化疗疗效预测中的价值。材料和方法:回顾性分析了18例Ⅲ~Ⅳ期非小细胞肺癌患者的临床资料。患者均接受以铂类为基础的一线化疗方案,并在治疗前后行18F-FDG PET/CT检查,分别以30%SUVmax及50%SUVmax为阈值测定MTV和TLG,疗效评价采用PERCIST标准。行秩和检验进行统计分析,ROC曲线分析诊断效能。结果:化疗治疗前后的指标的变化率ΔTLG30%SUVmax(u=73,P= 0.003)、ΔMTV30%SUVmax(u=73,P=0.003)、ΔTLG50%SUVmax(u=65,P=0.025)、ΔMTV50%SUVmax(u=65,P=0.025)和ΔSUVmax(u=74,P=0.003)存在统计学意义,通过ROC曲线分析得出以30%SUVmax勾画,MTV和TLG的变化率分别为56.3%,62.2%时可以判别出化疗敏感者,而以50%SUVmax勾画时,MTV和TLG的变化率分别为63.3%和68.9%。结论:非小细胞肺癌患者化疗前后原发病灶的糖代谢指标TLG和MTV的变化率有助于筛选出化疗敏感者。
癌,非小细胞肺;氟脱氧葡萄糖F18;正电子发射断层显像术
肺癌是目前世界上因癌症造成死亡的首要原因,肺癌中80%~85%为非小细胞肺癌[1]。约有一半的非小细胞肺癌患者在明确诊断的时候已存在淋巴结甚至远隔器官的转移。对于晚期的非小细胞肺癌患者化疗为主要治疗方案,但是研究表明约有30%的患者在一线化疗期间出现疾病进展,并有相当一部分患者并未见化疗收益反而一直受到化疗毒性的侵害。因此早期筛选出化疗敏感性对于化疗方案的制定及预后有很大助益,本文拟探讨非小细胞肺癌肿瘤代谢情况与化疗的敏感性是否有一定的相关性。
目前关于肿瘤负荷情况的指标肿瘤代谢体积(Metabolic tumor volume,MTV)和病变总体糖酵解(Total lesion glycolysis,TLG)的相关研究逐渐成为热点。既往对MTV和TLG与化疗疗效间的关系研究,包括宫颈癌、肺癌、食道癌、直肠癌、多发性骨髓瘤、恶性胸壁间皮瘤等,得出的结论不尽相同[2-8],大多数结论表明化疗前后的代谢差值可以预测化疗疗效,尚有代谢情况不能预测化疗疗效的相反结论。通过回顾分析这些文献发现,上述研究评价化疗疗效的方法为反映形态学改变的实体肿瘤疗效评价标准(Response evaluation criteria in solid tumors,RECIST),本研究将采用反映代谢情况的PET评价实体肿瘤疗效标准(PET response criteria in solid tumors,PERCIST)进行化疗的疗效评价,拟从肿瘤生物学行为的方面来评价上述两种指标与化疗疗效的关系。
1 资料与方法
1.1一般资料
本研究回顾性分析了就诊于中国医科大学附属第一医院核医学科的18例患者的病例资料,男10例,女8例,年龄44~74岁,平均(60.33±9.82)岁,这18例患者在行首次PET/CT检查前均有病理证实为非小细胞肺癌(病理类型包括腺癌14例,鳞癌2例,巨细胞癌1例,肉瘤1例),TNM分期均为Ⅲ~Ⅳ期,且于检查前均未行手术、放疗或化疗治疗。首次行PET/CT检查后1周内行化疗治疗,化疗方案均为含铂类的两药化疗方案,化疗周期为1~6周期(化疗1个周期2例,2个周期9例,4个周期5例,6个周期2例)并于化疗结束后2周内于本院行第2次PET/ CT检查评价化疗疗效。
1.2显像方法
患者行PET/CT检查前均需空腹6 h以上,空腹血糖低于10mmol/L,且非怀孕哺乳期,并明确患者于1周之内未行胃肠钡餐透视检查。静脉注射5.55MBq/kg18F-FDG后静卧休息60min,行PET/ CT显像。仪器使用GE Discovery LS4 PET/CT,18FFDG由GE Minitrace回旋加速器产生,放化纯>95%。CT为4排螺旋CT,层厚4.25mm,140 kV,80mA。图像重建采用迭代法,重建矩阵为128×128。
1.3图像处理
使用Xeleris工作站对原发病灶进行逐层计算,分别采用30%SUVmax和50%SUVmax(图1)扣本底计算机自动勾画感兴趣区(ROI)[9],对于病灶与心脏等正常生理性高摄取器官同层面的情况,采用手动勾画ROI。记录每一层的SUVmean及对应的面积大小,层厚为4.25mm,即可计算出每一层的MTV,之后逐层相加即可得出总的MTV,而TLG为每一层肿瘤代谢体积与SUVmean的乘积的总和。分别记录原发灶前后两次的代谢情况即MTV治疗前,MTV治疗后,TLG治疗前,TLG治疗后,SUVmax治疗前,SUVmax治疗后以及化疗前后的变化率ΔMTV、ΔTLG和ΔSUVmax。变化率的计算方法为两次测量的差值与基线下的数值之比。
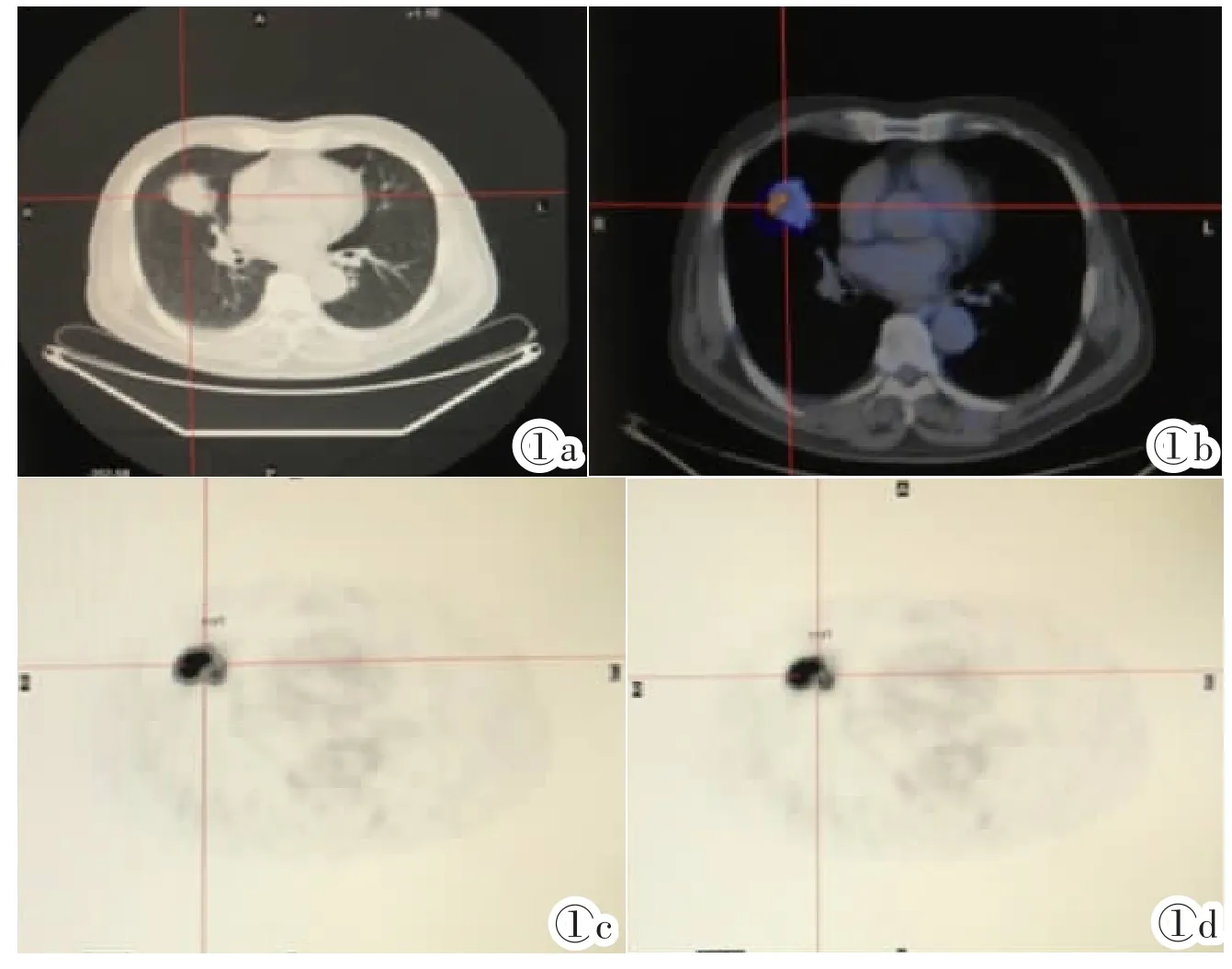
图1a原发病灶CT图像。图1b原发病灶PET与CT融合图像。图1c以30%SUVmax为阈值扣本底勾画ROI。图1d同一层面以50%SUVmax为阈值扣本底勾画ROI。
Figure 1a.The CT image of primary lesion.Figure 1b.The fusion image of primary lesion.Figure 1c.ROI under the threshold of 30%SUVmax.Figure 1d.The same layer of ROI image under the thresholdof 50%SUVmax.
采用PERCIST标准进行疗效评价[11],即选取SUVmax最大处,勾画1个直径为1.2 cm的球体(入选病灶直径均<1.2 cm),以瘦体体质量进行校正得出1 cm3球体内的SULpeak,保证该处SULpeak>1.5倍肝血池SULmean+2SD。根据前后两次PET/CT得出的SULpeak的变化值,根据PERCIST标准将评价结果分为代谢完全缓解 (Complete metabolic response,CMR),代谢部分缓解(Partial metabolic response,PMR),代谢稳定(Stable metabolic disease,SMD)和疾病代谢进展 (Progressive metabolic disease,PMD)。将PMR和CMR归类为化疗反应敏感组,SMD和PMD归类为代谢不敏感组。
1.4统计学分析
2 结果
分析了18例患者的18F-FDG PET/CT图像,得出SUVmax,30%和50%SUVmax扣本底勾画的化疗前后两次的MTV,TLG以及患者的疗效评价。根据PERCIST标准评价结果为CMR 1例,PMR 7例,SMD 8例,PMD 2例。即化疗敏感组 (CMR+ PMR)共8例,化疗不敏感组(SMD+PMD)10例。表1为该18例患者治疗前、治疗后各项指标的数据。结果提示当分别以30%SUVmax和50%SUVmax扣本底进行勾画ROI时,化疗敏感组与不敏感组的MTV和TLG的变化率有统计学差异,且SUVmax的变化率也具有统计学差异,其余指标均未见统计学意义(表1)。通过ROC曲线分析得出,无论以哪个阈值进行勾画ROI,治疗前后ΔTLG和ΔMTV变化率较之治疗前和治疗后的指标值对化疗敏感性预测价值更高。以30%SUVmax扣本底勾画ROI时,TLG和MTV的变化率分别为62.2%和56%时可以预测出化疗敏感性,其敏感度和特异度分别为87.5%,90.0%,二者曲线下的面积均为0.913;以50%SUVmax勾画ROI时TLG和MTV和变化率分别为68.9%和63.3%时可以预测敏感性,敏感度和特异度分别为87.5%,80.0%,二者曲线下的面积均为0.813(图2)。

表1 18例非小细胞肺癌患者TLG、MTV和SUVmax的数据信息

图2a 不同阈值勾画的TLG变化率ROC曲线。 Figure 2a.The ROC curve ofΔTLG under different threshold.

图2b 不同阈值勾画的MTV变化率ROC曲线。Figure 2b.The ROC curve ofΔMTV under different threshold.
3 讨论
MTV是从代谢的角度反映病灶的大小,可以更好的反应出病灶整体摄取显像剂的情况,代表了肿瘤负荷情况。TLG是结合了MTV及代谢高低(SUVmean)的一个半定量参数,相对于反映肿瘤负荷的MTV来说,TLG反应的是肿瘤整体代谢的高低情况,两个指标能更好的反映肿瘤的负荷及生物学特性。
对于探讨MTV和TLG与肿瘤化疗关系的研究也日渐增多,得出的结论不尽相同。回顾这些结论不同的研究发现,在评价化疗疗效的时候均使用的是以形态学改变为前提的RECIST。Masahiro等在食道癌新辅助化疗的研究中比较了PERCIST标准和RECIST标准在评价化疗疗效和疾病预后的能力,结论指出二者在评价疗效和预后的估计上存在显著的差异,PERCIST标准在疗效的评价上可能更加合适[11]。由于本文研究的指标TLG、MTV及SUVmax均为代谢指标,因此本研究试从代谢的角度来探究TLG及MTV这两个反应肿瘤代谢负荷的指标对化疗疗效有否预测作用。
本研究分析了化疗治疗前后各项指标的变化率与化疗疗效间的关系,得出的结论提示治疗前后的指标变化率ΔTLG、ΔMTV和ΔSUVmax在化疗敏感组和不敏感组之间存在统计学差异。这个结果与Huang等的结论相似[3],通过对37例行放化疗治疗的非小细胞肺癌患者的前瞻性研究发现,治疗敏感组患者的SUVmax和MTV这两种指标在化疗前后的改变率要明显高于化疗不敏感组,且SUVmax改变率通过ROC曲线得出的预测疗效的截点为37.2%,敏感度和特异度分别为83.3%,84.6%,而本研究得出的SUVmax的变化率截点为27.81%,敏感度和特异度分别为100%,90%。类似的结论亦见于Denz等对非小细胞肺癌化疗治疗的研究[12],该研究对30例非小细胞肺癌Ⅳ期患者的资料进行了分析,这些患者分别于治疗前和治疗后1周、6周行PET/ CT检查,其结论认为化疗前后(第6周)TLG的变化率可以预测出对化疗治疗敏感者,通过ROC曲线分析得出预测敏感性的截点为20%,这个结论与本研究类似但是数据方面差异明显,由于本文样本数量较少,还需扩大样本量进行进一步的验证。
在进行测量MTV和TLG时选用了两个阈值即30%SUVmax和50%SUVmax,在研究基线状态下的代谢指标与化疗疗效的关系时二者得出的结论未见差异。但是在研究化疗前后代谢指标的变化率与化疗疗效的相关性时发现,无论以哪个阈值进行勾画得出的TLG、MTV两种指标的变化率均与化疗敏感相关,差别在于进行ROC曲线分析诊断效能时,30%SUVmax为阈值得出的曲线下的面积>50% SUVmax,二者分别为0.913和0.813。可能原因在于本研究入组患者的病灶较大,以50%SUVmax进行勾画ROI时忽略了一部分肿瘤的代谢信息,因此不能更好的反映肿瘤的整体代谢特征,而以一个较低的阈值进勾画时更能贴近肿瘤的代谢情况[13]。
本研究的不足在于其回顾性特点病例数较少。本研究入组患者的病理类型并不一致,可能会对实验结果造成一定的影响。在今后的研究中,大样本量,且统一病理类型的实验设计有待进行,以便对上述结论进一步考证。
对于非小细胞肺癌患者,原发病灶化疗治疗前后的糖代谢指标TLG和MTV的变化率有助于筛选出化疗敏感性,而基线状态下的上述指标与化疗敏感性的预测关系不明确。
[1]Manegold C,Thatcher N.Survival improvement in thoracic cancer:progress from the last decade and beyond[J].Lung Can,2007,57(suppl 2):3-5.
[2]Azzoli CG,Baker S Jr,Temin S,et al.American societies of clinical oncology clinical practice guideline update on chemotherapy for stageⅣ non-small-cell lung cancer[J].J Clin Oncol,2009,27(36):6251-6260.
[3]Huang W,Zhou T,Ma L,et al.Standard uptake value and metabolic tumor volume of18F-FDG PET/CT predict short-term outcome early in the course of chemo-radiotherapy in advanced non-small cell lung cancer[J].Eur J Nucl Med Mol Imaging,2011,38(9):1628-1635.
[4]Kidd EA,Thomas M,Siegel BA,et al.Changes in cervical cancer FDG uptake during chemoradiation and association with response[J].Int J Radiation Oncol Biol Phys,2013,85(1):116-122.
[5]Roedl JB,Colen RR,Holalkere NS,et al.Adenocarcinomas of the esophagus:response to chemoradiotherapy is associated with decrease of metabolic tumor volume as measured on PET-CT comparison to histopathologic and clinical response evaluation[J]. Radiother Oncol,2008,89(3):278-286.
[6]Francis RJ,Byrne MJ,vander Schaaf AA,et al.Early prediction of response to chemotherapy and survival in malignant pleural mesothelioma using a novel semiautomated 3-dimensional volume-based analysis of serial18F-FDG PET scans[J].J Nucl Med,2007,48(9):1449-1458.
[7]Cook GJ,Yip C,Siddique M,et al.Are pretreatment18F-FDG PET tumor textural features in non-small cell lung cancer associated with response and survival after chemoradiotherapy?[J].J Nucl Med,2013,54(1):19-26.
[8]Guillem JG,Ruby JA,Leibold T,et al.Neither FDG-PET nor CT can distinguish between a pathological complete response and an incomplete response after neoadjuvant chemoradiation in locally advanced rectal cancer:a prospective study[J].Ann Surg,2013,258(2):289-295.
[9]Ciernik IF,Dizendorf E,Baumert BG,et al.Radiation treatment planningwithanintegratedpositronemissionandcomputer tomography(PET/CT):a feasibility study[J].Int J Radiat Oncol Biol,Phys,2003,57(3):853-863.
[10]Wahl RL,Jacene H,Kasamon Y,et al.FromRECIST to PERCIST:Evolving considerations for PET response criteria in solid tumors[J].J Nucl Med,2009,50(suppl 1):122-150.
[11]Yanagawa M,Tatsumi M,Miyata H,et al.Evaluationof responsetoneoadjuvant chemotherapyfor esophageal cancer:PET response criteria in solid tumors versus response evaluation criteria in solid tumors[J].J Nucl Med,2012,53(6):872-880.
[12]Kahraman D,HolsteinA,Scheffler M,et al.Tumor lesion glycolysis and tumor lesion proliferation for response prediction and prognostic differentiation in patients with advanced nonsmall cell lung cancer treated with erlotinib[J].Clin Nucl Med,2012,37(11):1058-1064.
[13]Biehl KJ,Kong FM,Dehdashti F,et al.18F-FDG PET definition of gross tumor volume for radiotherapy of non-small cell lung cancer:is a single standardized uptake value threshold approach appropriate?[J].J Nucl Med,2006,47(11):1808-1812.
The relationship between primary lesion glucose metabolism of NSCLC and chemotherapy:a prelim inary study according to PERCIST criteria
CHEN Mei-jie,LI Na,DU Bu-lin,LI Ya-ming
(Nuclear Medicine Department,the First Hospital of China Medical University,Shenyang 110001,China)
Objective:The aim of this study was to investigate whether metabolic tumor volume(MTV)and total lesion glycolysis(TLG)of primary tumor could give a prediction of the sensitivity in non-small cell lung cancer chemotherapy.Method:Eighteen cases with phaseⅢ~Ⅳ non-small cell lung cancer patients were reviewed retrospectively,who received platinumbased first-line chemotherapy and had18F-FDG PET/CT examinations both before and after therapy.MTV and TLG were determined with two thresholds which were 30%SUVmax and 50%SUVmax,using PERCIST criteria to evaluate outcome.Statistical analysis included rank-sum test and ROC curve.Results:The change rates of indicators includingΔTLG30%SUVmax(u=73,P=0.003),ΔMTV30%SUVmax(u=73,P=0.003),ΔTLG50%SUVmax(u=65,P=0.025),ΔMTV50%SUVmax(u=65,P=0.025)andΔSUVmax(u=74,P= 0.003)were statistically significant.According to ROC curve,change rates of TLG and MTV were 62.2%and 56.3%respectively could discriminate sensitivity to chemotherapy with threshold of 30%SUVmax,as well as 68.9%and 63.3%with threshold of 50%SUVmax.Conclusions:The change rates of TLG and MTV of primary tumor in non-small cell lung cancer patients can contribute to filtering out chemotherapy sensitivity.
Carcinoma,non-small-cell lung;Fluorodeoxyglucose F18;Positron-emission tomography
R734.2;R817.4
A
1008-1062(2015)03-0166-04
2014-08-12;
2014-09-20
陈美洁(1989-),女,辽宁沈阳人,医师。
李亚明,中国医科大学附属第一医院核医学科,110001。
