术前膀胱药物灌注降低膀胱癌手术切口种植转移率的实验研究
2015-10-16郑少斌陈响秋张辉见
何 兵, 郑少斌, 陈响秋, 钟 缔, 张辉见
(南方医科大学附属南方医院泌尿外科,广东广州510515)
膀胱癌是我国最常见的泌尿系肿瘤疾病.对于肌层浸润型膀胱癌患者,除部分选择性病例,原则上首先考虑根治性膀胱切除术,但是术后患者的生活质量仍然受到较严重影响,而且即使在技术成熟的医学中心根治性膀胱切除术的术后并发症发生率仍较高.由于根治性膀胱切除术对生活质量的影响,患者可能倾向于选择保留膀胱的手术.因为膀胱部分切除术患者相对根治性手术患者有较好的术后生活质量,且并发症相对较少,大部分病人乐于选择保留膀胱.但是缺点是膀胱部分切除手术治疗后,部分病人会发生切口肿瘤种植转移等[1-4].肿瘤种植的影响是多因素的,临床上已有相应原则用以预防切口肿瘤转移,如无瘤操作,术野冲洗等.其中术前对病人实施膀胱内抗肿瘤药物保留灌注的方法也已经应用于临床,并且通过大量临床病例的观察,发现膀胱癌开放手术前给予患者行一定时间的抗肿瘤药物膀胱保留灌注,可以明显减少术后手术切口肿瘤种植转移率[5-7].但是临床上对于手术切口肿瘤种植转移率有多种影响因素,如无瘤操作原则遵守程度,手术方案的选择等.仅从临床数据观察,不能说明在单因素作用下术前药物保留灌注的有效性.为排除相关因素影响(如无瘤操作原则遵守程度、手术方案的选择等多因素影响),说明单因素(术前抗肿瘤药物灌注)作用的有效性,探究术前药物灌注减少手术切口肿瘤种植转移率的可能作用机制,本实验构建单一因素影响的大鼠切口肿瘤种植转移模型,通过观察种植后切口肿瘤转移率及药物处理后组织细胞凋亡率,证实在单因素(药物处理膀胱癌组织)作用下可以有效降低其种植转移率,探究药物对肿瘤组织的杀伤作用为其潜在作用机制,现报道如下.
1 材料和方法
1.1 材料
(1)实验动物 雌性SD大鼠100只,8~10周龄,体质量220~300 g,购于南方医科大学动物实验中心.实验过程中按照实验动物3R原则对大鼠给予人道的关怀.
(2)主要试剂 诱癌剂 N-甲基-N亚硝酸脲(MNU),美国Sigma公司生产,贮存于-20℃;pH 6.0的磷酸盐缓冲液(PBS);注射用盐酸表柔比星注射液,辉瑞制药有限公司生产;无菌生理盐水;Annexin V-FITC/PI细胞凋亡检测试剂盒100tests,购至泰勒生物技术有限公司.
(3)主要实验器材及仪器 Intima-II密闭式静脉留置针(0.7 mm×19 mm,24 G);手术刀、手术剪刀、镊子、持针器、缝线、各型号手术缝针,组织碾磨器,自制取组织针头.BD LSRFORTESSA流式细胞仪器.
1.2 大鼠膀胱癌模型构建及实验分组
SD雌性大鼠40只用质量分数为3%戊巴比妥钠腹腔注射麻醉(30 mg/kg)后,体积分数为75%酒精消毒尿道外口.自制静脉留置针导尿管插入大鼠膀胱,先用磷酸盐缓冲液(PBS)5 mL灌洗大鼠膀胱两次,然后将配置好的MNU溶液灌入大鼠膀胱0.5 mL,膀胱内保留2 h.每次MNU 2 mg/只,两周1次,共4次,MNU总量为8 mg.灌注后第10周造模形成荷瘤大鼠.
将30只荷瘤大鼠随机平均分为A/B两组.A组大鼠腹腔麻醉后插自制尿管并固定,PBS灌洗并抽净膀胱内液,膀胱内灌注5 mL表柔比星溶液,浓度为10 mg/mL,使其在膀胱内保留30 min.抽出表柔比星溶液,完整切除大鼠膀胱,打开膀胱可见内菜花样增生肿物,小刀片小心刮取表面药物浸润肿物,碾磨后备用.B组大鼠保留灌注液体为生理盐水,其余处理同实验组,取肿物组织备用.
1.3 流式细胞仪(FCM)检测
取等量每组处理后肿瘤组织以PBS漂洗,放在培养皿中.置200目不锈钢筛上研磨过滤,用眼科剪反复剪碎组织,并不断以PBS冲洗,吸取滤过的单细胞悬液置离心管,1 000 r/min离心5 min,弃上清,调整待测细胞浓度为1×105/mL,以细胞凋亡检测试剂盒,按试剂说明书操作,检测凋亡率.本实验重复3次.Cell Quest软件获取细胞,WinMDI软件分析数据.以FITC和PI荧光强度作双参数点图,在二维的FCM分析图上,细胞分为四个亚群:左下象限,Annexin V-FITC-/PI-为活细胞群(V);右下象限,Annexin V-FITC+/PI-为凋亡细胞(AP);右上象限,Annexin V-FITC+/PI+细胞为继发性坏死细胞(N);左上象限,Annexin V-FITC-/PI+为培养操作过程中出现的机械损伤细胞(O).最后,将所得数据行统计学分析,观察组间差异.
1.4 实验分组
取60只健康大鼠随机分为实验组及对照组,实验组大鼠腹壁切口种植3针头(1 mL钢针裁剪剩余0.5 cm长度插入碾磨后组织及取得定量组织)A组处理后膀胱癌组织,然后腹壁切口处逐层缝合.对照组大鼠种植3针头B组处理后膀胱癌组织,然后腹壁切口处逐层缝合.两组腹壁切口种植术后注意大鼠保暖以减少死亡率.大鼠清醒后继续常规饲养,每隔3 d观察大鼠一般情况及腹壁切口种植处肿物生长情况并记录.所有手术器械使用前高压消毒灭菌,处理完成后,大鼠腹部切口皮肤安尔碘消毒.
1.5 标本采集
间断观察两组大鼠一般情况及腹壁切口种植处肿物生长大小情况,记录腹壁切口出现肿物的大鼠例数及各组大鼠腹壁肿物大小,于种植第6周处死所有大鼠,腹壁切开探查肿物,完整切除肿瘤,测量肿物大小,行病理切片检查.
1.6 组织病理学检查
采集的标本统一石蜡包埋,制成组织切片,HE染色,显微镜下观察组织病理学变化.
1.7 统计学分析
实验分组按照完全随机分组,SPSS 13.0完成统计分析,大鼠切口成瘤数及细胞凋亡率数据采用t检验,P<0.05认为差异有统计学意义.
2 结果
2.1 标本的大体观察及病理结果
MNU诱导大鼠膀胱癌模型,造模过程中有3只大鼠由于麻醉不当或尿路感染死亡,2只大鼠由于反复插尿管出现尿道结石,1只出现膀胱内结石,均终止造模.其余大鼠 12周时,均有肿瘤形成(100%)且大多呈多发性,肿瘤大小不一,其他脏器和组织未见肿瘤;病理检查证实均为大鼠膀胱尿路上皮癌(图1;图2).

图1 SD大鼠正常膀胱粘膜组织(A HE×100、B HE×400)Fig.1 Normal bladder tissue of the SD rat(A HE ×100、B HE ×400)

图2 MNU作用12周后的SD大鼠膀胱病理表现(A HE ×100、B HE×400)Fig.2 Histopathological characteristics of the SD rat bladder which was treated with MNU 12 weeks(A HE ×100、B HE ×400)
种植2周后,实验组和对照组大鼠腹壁出现可触摸肿物的例数分别为1只(3.3%)和4只(13.3%),3周后分别为 4只(13.3%)和 10只(33.3%),4周后分别为 5只(16.6%)和 16只(53.3%),观察至第6周,未发现有大鼠再出现腹壁可触摸肿物.种植后实验组及对照组的大鼠切口肿物平均直径大小,2周后分别为0.3 cm和0.45 cm,3周后分别为0.65 cm和1.25 cm,4周后分别为1.05 cm和1.87 cm,6周后分别为1.56 cm和2.45 cm(表1).6周后处死所有大鼠并解剖、病理检查证实所有腹壁肿物为膀胱癌转移瘤(图3).
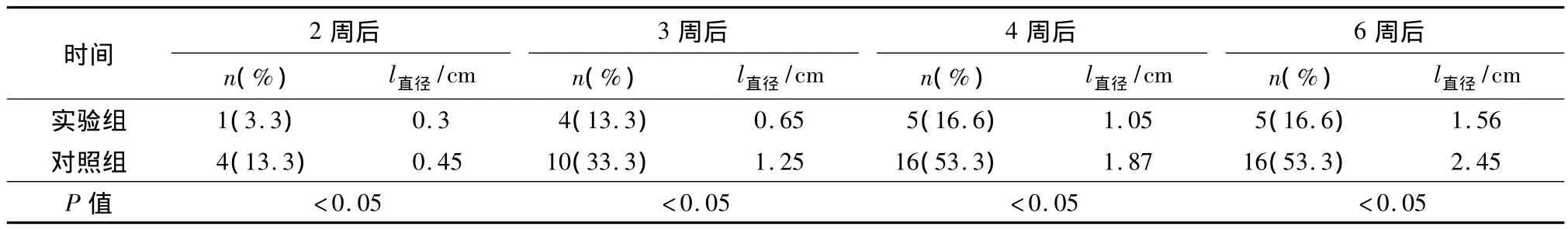
表1 实验组和对照组大鼠腹壁种植后不同时间段出现腹壁肿物的大鼠例数及每组切口肿物平均直径大小Table 1 The mean diameter of incisional mass and the number of abdominal neoplasm in different period in experimental group and control group

图3 实验组肿瘤组织种植5周后SD大鼠切口肿物病理学表现(A HE×100、B HE×400)Fig.3 Histopathological characteristics of the SD rat incision neoplasm 5 weeks after tumor implantation in experimental group(A HE×100、B HE ×400)
2.2 凋亡率比较
实验组和对照组肿瘤组织经Annexin V/PI双染后流式细胞仪进行凋亡细胞计数(图4).检测结果显示,凋亡率分别为:(36.67±1.63)%,(6.23±1.03)%.实验组大鼠膀胱肿瘤的AI大于对照组(P <0.05).

图4 实验组和对照组经Annexin V/P I双染色后流式细胞仪凋亡细胞计数对比(A对照组,B实验组)Fig.4 The numbers of apoptoic cells in experimental group and control group by AV/PI(A control group,B experimental group)
3 讨论
膀胱癌是严重威胁人类健康的疾病,多数患者须行手术治疗,而切口处肿瘤种植转移是术后最严重的并发症之一.临床上对于术后切口肿瘤种植转移的预防已有相应措施.我们通过大量临床病例观察发现,术前给予患者行一定时间的膀胱抗肿瘤药物灌注,有降低术后切口肿瘤种植转移率的可能.查阅文献,也有报道指出通过临床病例观察发现术前灌注预防切口肿瘤种植转移的有效性.目前相关文献报道为临床病例的观察统计,未有动物实验予以证实.由于临床上术后切口肿瘤种植转移是多因素影响,单从临床病例观察不能说明术前灌注的绝对有效性.那么构建动物模型,在单因素影响下说明其有效性则具有一定的意义.
本实验所涉术前处理为“化疗药物单次膀胱灌注”,即临床上对膀胱癌患者术前行膀胱内化疗药物保留灌注30 min.实验选用化疗药物为表柔比星,因为其脂溶性高,有利于在膀胱黏膜局部发挥作用,而全身吸收很少,全身的副反应较少,临床上已广泛应用,预防和治疗膀胱肿瘤疗效肯定.同时有研究认为膀胱灌洗化疗能杀伤脱落的可能种植的癌细胞,基础研究也表明化疗药物对体外培养的瘤细胞作用显著[8-9].肿瘤细胞出现种植的原因主要基于肿瘤的生长特性,因为膀胱肿瘤多为移行细胞癌,而该种癌细胞易于种植成活生长,且膀胱手术创面深,瘤细胞及细小癌组织如随液体流入周围创腔并停留于该处及皮肤切口部位,易发生种植转移[9-11].对于术前药物灌注降低切口肿瘤种植转移的原因,经过分析可能为膀胱内灌注化疗药物后,药物能损伤或杀灭接触的肿瘤细胞和组织,使膀胱癌患者在行手术治疗时因手术操作引起的脱落至切口的肿瘤细胞或组织活性和种植能力降低[12-14],达到减少切口肿瘤种植转移率的目的.
为探究膀胱癌术前安全药物灌注的作用及潜在机制,本实验基于大鼠膀胱癌模型[15-18]构建出大鼠腹壁切口肿瘤种植转移模型,在单因素的作用下说明了药物保留灌注能够降低切口种植转移率,并通过观察处理后肿瘤组织内细胞凋亡率发现其潜在作用机制可能为抗肿瘤药物对肿瘤细胞及组织的损害及杀灭,减少了有活力的肿瘤细胞及组织量.本实验通过动物模型验证,为膀胱癌术前药物灌注的临床应用提供了一定的理论支持及参考.但对于术前药物保留灌注减少切口种植转率的作用机制仍需深入研究.
[1]陈梓甫.表浅膀胱癌的诊断与治疗[J].临床泌尿外科杂志,2003,18(5):257 -258.
[2]KAUFMAN D S,SHIPLRY W U,FELDMAN A S,et al.Bladder cancer[J].Lancet,2009,374(9685):239 -249.
[3]KUCZYK M,MACHTENS S,BOKEMEYER C,et al.Surgical bladder preserving strategies in the treatment of muscle-invasive bladder cancer[J].World J Urol,2002,20(3):183-189.
[4]梁蔚波,苏泽轩,李宇同,等.全膀胱切除-回肠新膀胱术26例报告[J].暨南大学学报:自然科学与医学版,2000,21(6):9 -11.
[5]沈 杰,俞奇伟,沈 俭,等.膀胱癌膀胱部分切除术切口种植的预防[J].河北医药,2003,25(6):412-413.
[6]易丽萍.“无瘤操作”的探讨[J].现代实用医学,2003,15(5):322-322.
[7]徐进华,邓美华,秦 峰,等.膀胱癌手术中无瘤技术的配合[J].华夏医学,2000,13(5):621 -622.
[8]张 超.恶性肿瘤种植转移研究进展[J].国际肿瘤学杂志,2007,34(11):816 -819.
[9]马 莹,白 萍.医源性肿瘤种植[J].中国肿瘤临床,2008,35(2):117 -119.
[10]FADL ELMUL-I,GORUNOVA L,MANDAHL N,et al.Cytogenetic monoclonality in multifocal uroepithelial carcinomas:evidence of intraluminal tumour seeding.[J].The British journal of cancer,1999,81(1):6 -12.
[11]张雨洁,赵 斌,孟元韬,等.恶性肿瘤术后切口种植转移的病因和防治措施[J].山东医药,2008,48(1):111-112.
[12]吴忠标,林国兵,陈柏君,等.不同剂量表柔比星膀胱灌注预防浅表性膀胱癌复发的疗效与安全性[J].中华肿瘤杂志,2005,27(8):507 -509.
[13]ONRUST S V,WISEMAN L R,GOA K L.Epirubicin:a review of its intravesical use in superficial bladder cancer[J].Drugs & aging,1999,15(4):307 -333.
[14]SHIN Y S,KIM J Y,KO O S.The direct anti-cancer effect of a single instillation of epirubicin after transurethral resection of bladder tumor for non-muscle-invasive bladder cancer[J].Korean J Urol,2012,53(2)78 - 81.
[15]钱立新,刘训良,丁鸿,等.N-甲基亚硝基脲诱导大鼠膀胱肿瘤作用的动态观察[J].中华实验外科杂志,2004,21(5):563 -564.
[16]罗春丽,胡宏波,蔡晓钟,等.MNU诱发SD大鼠膀胱肿瘤原位模型[J].重庆医学,2007,36(14):1352-1354.
[17]唐小莹,潘春武,孙俊,等.大鼠原位膀胱癌模型的建立与CT诊断价值[J].中国实验动物学报,2010,18(1):6 -8,彩2.
[18]STEINBERG G D,BRENDLER C B,ICHIKAWA T.Characterization ofan N-methyl-N-nitrosourea-induced autochthonous rat bladder cancer model[J].Cancer Research,1990,50(20):6668 -6674.
