不同时间的乳化氟碳保存液处理对供体肺抗炎抗氧化能力及组织结构的影响
2015-10-16易艳萍杨成林彭雪梅卢春英邹启荣谢娟华李佳阳
易艳萍, 杨成林, 彭雪梅, 卢春英, 邹启荣, 谢娟华, 李佳阳
(1.暨南大学第一附属医院麻醉科,广东广州510630;2.深圳龙华新区人民医院麻醉科,广东深圳518109)
目前肺移植已成为治疗终末期肺病的唯一有效的方法.UW(the University of Wisconsin solution,UWs)液是目前供器官灌注及冷保存的标准保存液,并已广泛应用于临床.乳化氟碳(作为一种新的器官保存液,它以快速而又充分的向组织供氧,加快血流速度,增加器官供血量,改善微循环逐步受到关注[1-3].本研究比较乳化氟碳和 UW液在不同时段对保存肺抗炎、抗氧化能力和组织结构的影响,进一步探讨乳化氟碳保存液对供体肺的保存效果.
1 材料与方法
1.1 实验动物及试剂
(1)实验动物 清洁级健康雄性SD大鼠48只,体质量350~400克,由广东省医学实验动物中心提供.
(2)实验试剂 UW液(Bristol-Myers squibb,美国),乳化氟碳保存液(FCE)(北京双鹤药业股份有限公司),MDA(丙二醛,Malondialdehyde)和 SOD(超氧化物歧化酶,Superoxide Dismutase)检测试剂盒(上海碧云天生物技术研究所),MPO(髓过氧化物酶,Myeloperoxidase)检测试剂盒(南京建成生物工程研究所),IL-1β(白细胞介素-1β,Interleukin-1β)、IL-6(白细胞介素-6,Interleukin-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(上海依科赛生物制品有限公司).
1.2 实验方法
(1)实验分组 将48只350~400克SD雄性大鼠随机分为2组[FCE组(乳化氟碳保存液,Perfluorocarbon Emulsions)与UW组],每组24只,其中FCE组又随机分为FCE-6 h组与FCE-12 h组,UW液组随机分为UW-6 h组与UW-12 h组,每组均为12只.FCE组均采用FCE保存液灌注与保存,分别置于温度为0~4℃中保存6 h和12 h;UW组采用UW液灌注与保存,同样分别置于温度为0~4℃中保存6 h和12 h.在相应的保存时间段后取肺组织检测SOD及MPO活性及MDA、IL-1β、IL-6和TNF-α的含量,并取肺组织制成光镜和电镜切片观察病理改变和超微结构的变化.
(2)离体肺模型的建立与处理 参照Fischer's[4]所述方法建立离体肺模型,大鼠麻醉前30 min用硫酸阿托品0.4 mg/kg行肌肉注射,用质量分数为1%戊巴比妥钠50 mg/kg行腹腔注射进行麻醉,麻醉后行气切置管,呼吸机维持通气,设置潮气量8 mL/kg,通气频率60次/min,正中开胸,游离上、下腔静脉,经下腔静脉500 U/kg肝素对大鼠进行全身肝素化.将灌注管(22号静脉穿刺针)自右心室插入肺总动脉.结扎上下腔静脉,用4℃ UW液(UW组)或乳化氟碳保存液(FCE组)对肺动脉顺行灌注,速率为4 mL/min,并剪开左心耳减压左心,灌注至双肺组织成灰白色,灌注过程中肺持续通气.灌注完毕后在肺中度膨胀时快速结扎气管,切除整块心肺置于4℃ UW液(UW组)或乳化氟碳保存液(FCE组)中分别保存6 h和12 h.
1.3 标本的取样与检测
(1)光镜标本 在保存相应的时间段后取出供肺,取各组相同部位肺组织于体积分数为4%多聚甲醛溶液固定后,行HE染色后切片观察肺组织病理学结果并行病理评分.由同一位实验者在光镜下观察以下项目:肺泡壁完整性、间质充血、肺泡内出血、间质水肿、炎症细胞;并进行病理评分:无病理改变评为1分,病理变化轻微且位置局限为2分,病理变化显著但位置局限或病理变化轻微但病变广泛为3分,广泛显著病理改变为4分.
(2)电镜标本 取各组相同部位肺组织于戊二醛溶液固定后,制备电镜超薄切片,观察超微结构的变化.
(3)炎症及氧化指标标本 取各组相同部位肺组织用无菌冷磷酸盐缓冲液(PBS)漂洗后加入生理盐水,再经匀浆、离心后吸取上清液,采用ELISA法测定 MPO 活性和 IL-1β、IL-6、TNF-α 的含量,TBA法测定MDA含量,WST法测定SOD活性,严格按照试剂盒说明书操作.
1.4 统计学处理
所有数据均采用SPSS 17.0统计软件进行处理及分析,计量资料以均数±标准差()表示,组间比较采用成组t检验,病理评分进行两个独立样本比较的Wilcoxon秩和检验.P<0.05为差异有统计学意义.
2 结果
2.1 UW 组与 FCE 组供肺组织 IL-6、IL-1β、TNF-α的比较
两组供肺组织 IL-6、IL-1β、TNF-α 在 6 h、12 h时间比较无差异无统计学意义(P>0.05),见表1.
表1 UW组与FCE组在不同时间点的IL-6,IL-1β,TNF-α含量的比较Table 1 Comparison of the levels of IL-6,IL-1β,TNF-α at different time point in the two groups± s,n=12)

表1 UW组与FCE组在不同时间点的IL-6,IL-1β,TNF-α含量的比较Table 1 Comparison of the levels of IL-6,IL-1β,TNF-α at different time point in the two groups± s,n=12)
1)各时间,两组各指标比较P>0.05
?
2.2UW组与FCE组供肺组织SOD与MPO活性、MDA含量比较
UW组与FCE组的供肺组织的SOD活性、MDA含量比较无差异(P>0.05);6 h组SOD活性低于相应的12 h组,MDA含量和MPO活性高于相应的12 h组,差异有统计学意义(P<0.05);UW组两时间点的MPO活性低于FCE组,差异有统计学意义(P <0.05),见表2.
2.3 病理积分
病理积分UW液组病理积分高于FCE组(P<0.05);两组6 h病理积分低于12 h,差异有统计学意义(P<0.05),见表3.
表2 UW组与FCE组在不同时间点的SOD和MPO活性、MDA含量的比较Table 2 Comparison of the activity of SOD、MPO and the content of MDA at different time point in the two groups(±s,n=12)
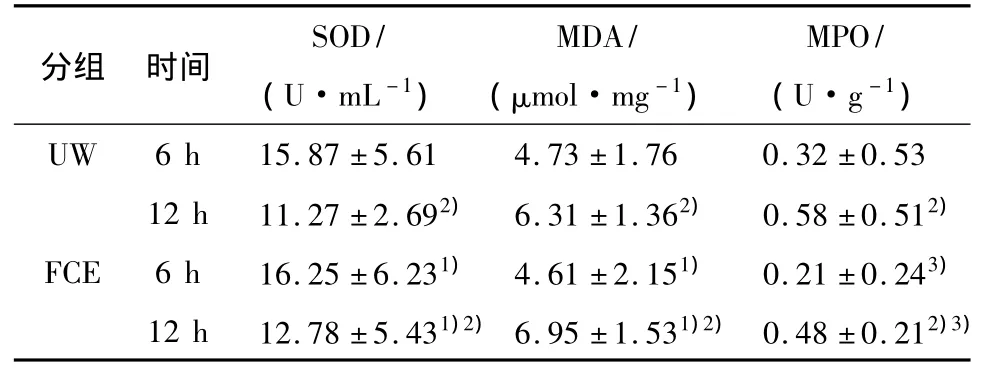
表2 UW组与FCE组在不同时间点的SOD和MPO活性、MDA含量的比较Table 2 Comparison of the activity of SOD、MPO and the content of MDA at different time point in the two groups(±s,n=12)
1)P>0.05 vs.UW group,2)P <0.05 vs.6 h group,3)P <0.05 vs.UW group.
?
表3 两组两时间点的供组织光镜下病理积分比较Table 3 Comparison of the histopathological score at different time point in the two groups(±s,n=12)

表3 两组两时间点的供组织光镜下病理积分比较Table 3 Comparison of the histopathological score at different time point in the two groups(±s,n=12)
1)P <0.05 vs.UW group,2)P <0.05 vs.6 h group.
?
2.4 供肺组织光镜下病理变化
FCG-6 h组、FCE-12 h组肺组织结构清晰较完整、无间质充血和水肿,无肺泡内出血,少量肺泡壁断裂(黑色箭头),少量肺泡隔增厚(蓝色箭头)(见图1 A、B),少量肺泡隔增厚(蓝色箭头)少量炎症细胞(紫色箭头)(见图1 E、F);UW-6 h组、UW-12 h组肺组织结构清晰完整性较差,肺泡壁断裂(黑色箭头)、肺间质及肺泡见少量红细胞渗出(红色箭头),肺泡上皮细胞及内皮细胞见空泡化(绿色箭头)及大量炎症细胞(紫色箭头)(见图1C、D、G、H).
2.5 供肺组织超微结构变化
电镜下UW-6 h组肺泡上皮细胞及血管内皮细胞边界较清楚,线粒体轻度肿胀,Ⅱ型肺泡上皮细胞板层小体模糊不清,FCE-6 h组肺泡上皮细胞及血管内皮细胞结构完整,边界清楚;线粒体嵴较完整,轻度肿胀(图2A、C红色箭头),Ⅱ型肺泡上皮细胞板层小体清晰可见.电镜下UW-12 h组肺泡上皮细胞及血管内皮细胞肿胀明显(图2B红色箭头),线粒体嵴结构不清;基底膜可见中断;Ⅱ型肺泡上皮细胞板层小体模糊,部分已经空泡化(图2B).FCE-12 h组肺泡上皮细胞及血管内皮细胞有轻度肿胀(图2D红色箭头),线粒体嵴较完整;基底膜连续;Ⅱ型肺泡上皮细胞板层小体消失,空泡形成(图2D).
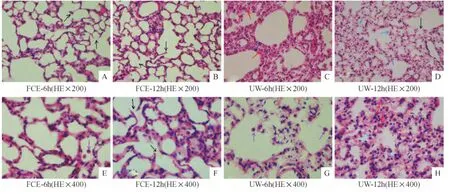
图1 两时间点光镜下两组供肺组织病理变化Fig.1 The pathological changes of lung tissue of the two groups at different times under the light microscopy

图2 两时间点电镜下两组供肺组织超微结构变化Fig.2 The ultrastructure changes of lung tissue of the two groups at different times under the electron microscopy
3 讨论
乳化氟碳保存液因其颗粒小、携氧高、气体交换迅速,是良好人工氧载体,能快速充分向缺血组织供氧,抑制白细胞及血小板的聚集,改善微循环,有利于物质交换和代谢[5-6].乳化氟碳作用于离体肾脏、心脏和肝脏已有大量研究[2,7-8],但在离体肺中的作用研究较少.本研究通过与常用器官移植保存液UW液对比,探索FCE在供肺组织中的作用.肺不同于肝、肾等实体器官,它是一个空腔脏器,安全的冷缺血保存时限短,保存时间仅 4~6 h[9],易发生严重的缺血再灌注损伤,导致早期移植肺水肿和肺功能丧失.一般来说肺发生缺血再灌注损伤的最直接原因是肺在保存过程中所经历的缺血缺氧[10].良好的器官保存液对延长肺的保存时间及提高供肺的质量意义重大.
本研究发现两组保存液在两个时段的抗炎作用无明显差异,两组供肺组织IL-6、IL-1β、TNF-α的比较差异无统计学意义,因IL-6、IL-1β、TNF-α均为早期肺损伤促炎因子,能反映早期肺组织炎症损伤程度.表明FCE保存液能下调炎症因子的表达,减轻促炎反应,与氟碳能在细胞表面形成一种密集但又具有扩散性能的物理屏障有关[11],它屏蔽了各种炎性介质、炎性细胞对靶细胞的接触,起到了对肺的抗炎保护作用;UW液含有的腺苷具有抗炎作用[12-13].也因供肺缺少血液有形成分,不易启动瀑布式炎症级联反应而产生大量炎性因子[14].
MPO其水平及活性变化代表着多形核白细胞(PMN)的功能和活性状态,反映中性粒细胞数量;MDA的含量反映脂质过氧化的程度,而SOD的高低则可以间接反映机体清除氧自由基的能力.FCE与UW液均可减轻供肺保存期氧化损伤并较好的维持供肺抗氧化损伤的能力,FCE与其高效携氧性有关,UW液则与其中所含有的谷胱甘肽能中和氧自由机有关[15].本研究发现:UW液两个时段组MPO活性均高于FCE两组,说明FCE保存液可以更好的抑制中性粒细胞的活化与聚集,稳定中性粒细胞,减少供肺的氧化损伤,FCE可通过减轻PMN的趋化反应进而减少PMN肺内聚集[16].本研究还发现随着保存时间的延长,两组的SOD活性逐渐降低,MDA含量与MPO活性逐渐增高,可能因溶解在FCE中的氧逐渐耗尽,它造成了组织缺氧导致炎症反应的发生,使得其稳定中性粒细胞,抑制其活化与聚集的能力减弱,被激活的中性粒细胞产生大量氧自由基,加重肺损伤[17];UW液可能因高K+使肺组织血管收缩,血液中有形成分不易冲走,导致炎症细胞浸润,产生大量氧自由基[13].此外,本研究供肺组织的病理积分FCE组优于UW组,6 h组优于12 h组,表明FCE能更好的抑制炎症细胞如中性粒细胞的活化,从而降低内皮细胞和上皮细胞及基底膜屏障的通透性,减轻肺间质和肺泡的水肿,达到肺保护的作用[18].
综上所述,乳化氟碳在供体肺中具有抗炎抗氧化能力,且乳化氟碳的抗氧化能力在两个不同时段均强于UW液,对供肺的保存效果优于UW液,而以保存6 h效果最佳.
[1]HOU S,DING H,LV Q,et al.Therapeutic effect of intravenous infusion of perfluorocarbon emulsion on LPS-Induced acute lung injury in Rats[J].PLoS ONE,2014,9(1):e87826.
[2]彭雪梅,刘嘉弈,郑志雄,等.乳化氟碳保存液对离体保存肾脏抗氧化能力及组织结构的影响.[J]暨南大学学报:医学版,2013,34(6):599 -603.
[3]尹晓峰,钱国强,樊毫军,等.全氟化碳乳剂预处理对急性肺损伤大鼠的保护作用[J].中国急救医学.2014,34(1):53 -56
[4]FISCHER S,HOPKINSON D,LIU M Y,et al.Raffinose improves 24-hour lung preservation in low potassium dextran glucose solution:a histologic and ultrastructural analysis[J].Ann Thorac Surg,2001,71(4):1140 -1145.
[5]HOSGOOD S A,NICHOLSON M L.The role of perfluorocarbon in organ preservation[J].Transplantation,2010,89(10):1169-1175.
[6]CABRALES P,CARLOS BRICENO J.Delaying blood transfusion in experimental acute anemia with a perfluorocarbon emulsion[J].Anesthesiology,2011,114(4):901-911.
[7]ISAKA M,SAKUMA I,SHIIYA N,et al.Experimental study of the relationship between perfluoro-octyl bromide emulsion and norepinephrine release in reperfusion arrhythmia:isolated guinea pig heart model[J].Ann Thorac Cardiovasc Surg,2008,14(6):363-368.
[8]KINASIEWICZ A,SMIETANKA A,GAJKOWSKA B,et al.Impact of oxygenation of bioartificial liver using perfluorocarbon emulsion perftoran on metabolism of human heaptoma C3A cells[J].Artif Cells Blood Substit Immobil Biotechnol,2008,36(6):525 -534.
[9]HICKS M,HING A,GAO L,et al.Organ preservation[J].Gen Thorac Cardiovase Surg,2009,57(12):635 -639.
[10]SLIVA C A,CARVAILHO R S,CAGIDO V R,et al.Influence of lung mechanical properties and alveolar architecture on the pathogenesis of ischemia-reperfusion injury[J].Interact Cardiovasc Thorac Surg,2010,11(1):46-51.
[11]NAKATA S,YASUI K,NAKAMURAT,et al.Perfluorocarbon suppresses lipopolysaccharide and alpha-toxin-induced interleukin-8 release from alveolar epithelial cells[J].Neonatology,2007,91(2):127 -133.
[12]MAZZON E,ESPOSITO E,IMPELLIZZERI D,et al.CGS21680,an agonist of the adenosine(A2A)receptor,reduces progression of murine type II collagen-induced arthritis[J].Rheumatol,2011,38(10):2119 -2129.
[13]万 萍,陈 昊,白爱平.腺苷的免疫调节功能[J].世界华人消化杂志,2014,22(17):2378 -2384.
[14]彭雪梅,席 露,王华东,等.乳化氟碳保存液对大鼠供肺的保护作用[J].中华麻醉学杂志,2013,33(9):1082-1084.
[15]刘振威,高风英.还原型谷胱甘肽对失血性休克型急性肺损伤相关炎性因子及抗氧化因子的调控及肺损伤的保护作用研究[J].实用心脑肺血管病杂志,2013,21(4):30 -40.
[16]NAKAHARA H,LEE S,KRAFFT M P,et al.Fluorocarbon-hybrid pulmonary surfactants for replacement therapy—a Langmuir monolayer study.Langmuir,2010,26(23):18256-18265.
[17]ABRAM E.Neutrophils and acute lung injury[J].Critical Care Medicine,2003,(4 Suppl):S195 - S199.
[18]XU-SHUFENG,WANG-PING,WEI-KUN,et al.Cytoprotection of perfluorocarbon on PMVECs in vitro[J].Inflammation,2013,36(2):512 -520.
