耳穴贴压对睡眠剥夺大鼠脾脏TLR4信号通路关键基因mRNA表达的影响
2015-10-16郭尚函林炎龙赵仓焕何华香
郭尚函, 林炎龙, 赵仓焕, 何华香, 王 妤
(暨南大学1.医学院中医系,广东广州510632;2.附属第一医院 针灸科,广东广州510630)
失眠症(Insomnia),主要指以睡眠时间长度和睡眠深度不足为特征的一种病症[1].睡眠和免疫功能关系密切,长时间的失眠可以影响免疫功能而导致疾病的发生,甚至死亡[2].多种和免疫功能相关疾病比如感染、恶性肿瘤、抑郁症等均与睡眠剥夺有关[3].目前耳穴疗法在临床上已被广泛应用于治疗失眠症,对其机制的研究多以调节中枢神经系统[4]、循环系统功能[5]以及恢复重建紊乱的生物钟[6]为主,耳穴治疗失眠症是否能调节失眠患者的免疫功能,其作用机理尚不清楚.
Toll样受体4(Toll-like receptors,TLR4)可识别革兰氏阴性菌的脂多糖(lipopo-lysaccharide,LPS)[7],通过一系列信号传导,最终引起细胞产生炎症因子、I型干扰素、趋化因子和抗菌肽等相关因子[8],激活天然免疫系统,在天然免疫反应中有着关键性的作用.TLR4表达适度时,可启动机体防御功能,但过度表达时,则可引起相关的炎症性疾病,许多临床疾病如肿瘤、动脉粥样硬化、牙周病等与之紧密联系.本研究观察耳穴贴压对睡眠剥夺大鼠脾脏TLR4信号通路关键基因mRNA表达的影响,探讨其治疗作用的机理,为临床使用耳穴贴压治疗失眠症提供实验依据.
1 材料与方法
1.1 材料
(1)动物与分组 SPF级雄性Wistar大鼠32只,体质量(250±20)g,由中山大学(大学城)实验动物中心提供,医学动物合格证号:SCXK<粤 >20011 -0029,NO.44008500002592.
将32只大鼠,按随机数字表法分为对照组、模型组、安定组、耳穴贴压组,每组8只,正常饲养7 d后予以相应处理.实验均在每天上午7:00~11:00之间进行,环境要求安静、通风、室温26℃左右.实验过程中对动物的处理均遵照“关于善待动物的指导性意见”.
(2)主要试剂及仪器 PCPA(para-chlorophenylalanine)购自美国sigma公司;地西伴(安定)注射液购自天津金耀氨基酸有限公司;RnaEx与ddH2O购自上海杰瑞生物工程有限公司;Quant cDNA第一链合成试剂盒与SYBR Green荧光定量PCR试剂盒购自天根生化科技有限公司.
XS-100A耳穴探测仪为南京小松医疗仪器研究所产品;YP601N型电子天平为上海精密科学仪器有限公司产品;超净工作台为苏州净化设备有限公司产品;5840R水平低温离心机为德国Eppendorf公司产品;-80℃低温冰箱、可调式移液器与微量核酸分光光度计ND-1000均为美国Thermo公司产品;PCT-200型梯度PCR仪、48孔CFX Manager实时荧光定量PCR仪、EP管与PCR八连管均为美国BIORAD公司产品.
1.2 方法
(1)造模及处理方法 对照组:不造模,与模型组同期饲养,未进行任何处理的大鼠.实验第8天安静状态下取材.模型组:于实验第l天开始造模,第8天上午8:30~9:00安静状态下取材,将PCPA用弱碱性生理盐水配置成质量浓度为20 g/L的混悬液,按质量分数为45 mg/100 g进行腹腔注射,于实验的第1、2天各注射1次;安定组:于实验第3天开始每天上午8:00~8:30分别用安定注射液腹腔注射,连续7 d,按成人催眠剂量每天10 mg,用人鼠给药剂量体表面积折算公式计算出大鼠给药质量分数为0.92 mg/kg,每日1次,其他同模型组.耳穴贴压组:于实验第3日开始每天上午8:00~8:30及晚上20:00~20:30予两侧耳朵消毒并用磁珠贴压耳穴,预实验发现每次贴压耳穴磁珠保留的时间约为4 h,每日2次,其他同模型组.耳穴取穴及贴压方法:按文献[9],结合动物穴位具有相对特异性的特点[10],以动物比较学方法确定穴位出现可能区域,再借助经穴探测仪器进行辅助定穴,按压力量以大鼠有躲避倾向等痛觉反应为度.
(2)观察指标及检测方法 实验结束后,各组大鼠禁食过夜,用腹腔注射体积分数为2%戊巴比妥钠麻醉大鼠.切取其脾脏,冰上分离脂肪等杂质,称体质量,脾脏迅速放入液氮冷冻,再在-80℃冰箱保存,准备提取RNA.取适量样本组织 50~100 mg,剪碎研磨至粉末,装入无酶 EP管,加 1 mL RnaEx总RNA提取试剂,充分匀浆后,室温静置5 min.4℃,12 000 r/min 离心 10 min.取上清,加入0.2 mL体积的氯仿,震荡混匀,室温静置5 min.4℃,12 000 r/min离心15 min.取上清,加入0.5 mL异丙醇,轻轻上下颠倒几次,混匀,室温静置10 min.4℃,12 000 r/min离心10 min.弃上清,加入1 mL体积分数为75% 的乙醇,轻轻颠倒几次.4℃,7 500 r/min离心5 min.弃上清,室温干燥5 min,加入适量ddH2O溶解RNA沉淀,20 μL反应液分装备用.将提取好的反应液用微量核酸分光光度计测定RNA纯度及浓度,确保OD260/OD280比值在1.8~2.2之间.按反转录试剂盒说明书将20 μL反转录反应体系于37°C 60 min终止反应,合成cDNA.
TLR4上游引物:5'-GACTTTAACTACCAACAGAGAGGAT-3',下游引物:5'-AAATCAGAATAAGAACAGCAACC-3',PCR扩增产物120 bp;MyD88上游引物:5'-ATTGAGAAAAGGTGTCGTCGCAT-3',下游引物:5'-TCGCAGATAGTGATGAACCGTAGG-3',PCR扩增产物 191 bp;IRAK1上游引物:5'-CCAGTGGAGAGTGATGAGAGTGTTC-3',下游引物:5'-TTCTCTGGTAGTGCCTCCTTGTGTA-3',PCR 扩增产物132 bp;TRAF6上游引物:5'-GAGAGATTCTTTCCCTGACGGTA-3',下游引物:5'-TTGGGGACAAATCACTAGAGCG-3',PCR扩增产物 119 bp;NF-κB 上游引物:5'-GGATGGCTTCTATGAGGCTGA-3',下游引物:5'-CTTGAAAGGGGTTATTGTTGGTC-3',PCR扩增产物140 bp;TRIF上游引物:5'-ATTCAGTAAGGAGCAGTAATAGGA-3',下游引物:5'-TTGACTCTTGACATAAGGGACACT-3',PCR 扩增产物120 bp;内参 β-actin上游引物:5'-CTGAACCCTAAGGCCAACCG-3',下游引物:5'-GACCAGAGGCATACAGGGACAA-3',PCR 扩增产物 112 bp.取 2 μL cDNA按一定组份在冰上配制PCR反应液,将引物与反转录产物在20 μL反应体系中进行PCR扩增.PCR扩增条件:起始模板95℃预变性2 min,95℃变性 15 s,58℃退火20 s,68℃延伸30 s,39 个循环.反应结束后,采用Opticon Monitor 3.1软件进行数据处理,公式 2-ΔΔCt进行相对定量.
1.3 统计学处理
2 结果
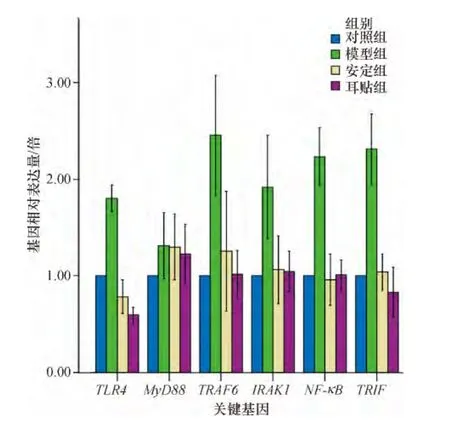
图1 各组大鼠脾脏TLR4信号通路关键基因的表达结果Fig.1 The results of the TLR4 signaling pathway key genes expression in rats'spleen of each group
表1 各组大鼠脾脏TLR4基因的表达结果Table 1 The results of TLR4 gene expression in rats′spleen of each group

表1 各组大鼠脾脏TLR4基因的表达结果Table 1 The results of TLR4 gene expression in rats′spleen of each group
1)与模型组比较,P<0.05.
?
表2 各组大鼠脾脏MyD88基因的表达结果Table 2 The results of MyD88 gene expression in rats′spleen of each group
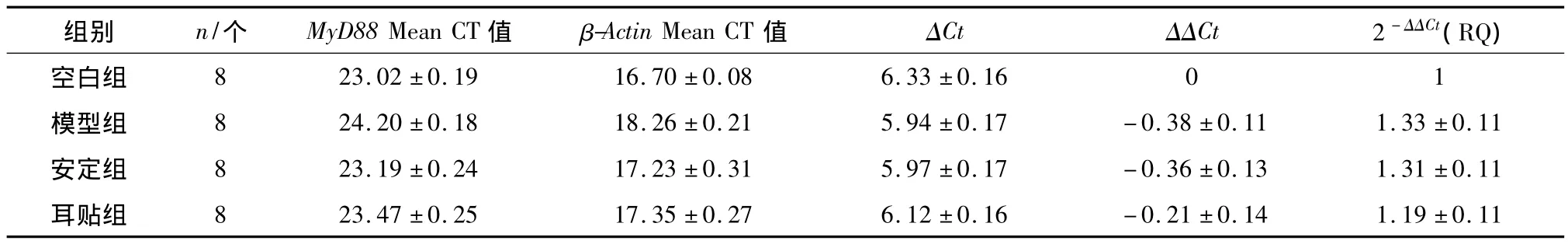
表2 各组大鼠脾脏MyD88基因的表达结果Table 2 The results of MyD88 gene expression in rats′spleen of each group
模型组、安定组和耳贴组两两比较,P>0.05.
?
表3 各组大鼠脾脏IRAK1基因的表达结果)Table 3 The results of IRAK1 gene expression in rats′spleen of each group
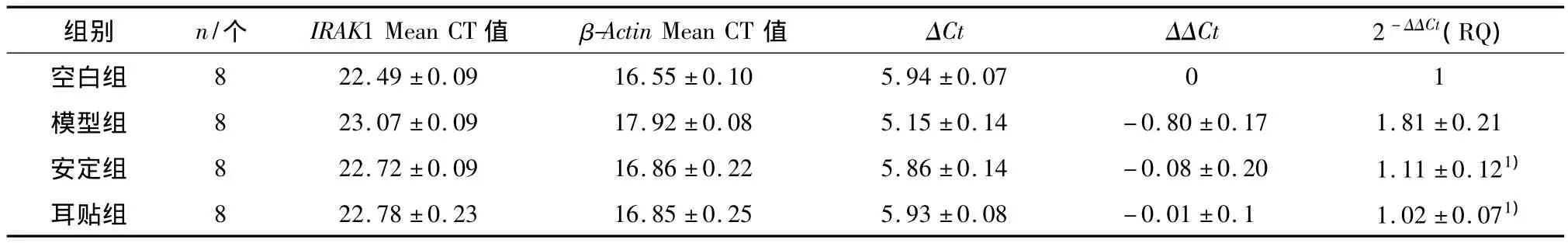
表3 各组大鼠脾脏IRAK1基因的表达结果)Table 3 The results of IRAK1 gene expression in rats′spleen of each group
1)与模型组比较P<0.05.
?
表4 各组大鼠脾脏TRAF6基因的表达结果Table 4 The results of TRAF6 gene expression in rats′spleen of each group

表4 各组大鼠脾脏TRAF6基因的表达结果Table 4 The results of TRAF6 gene expression in rats′spleen of each group
1)与模型组比较,P<0.05.
?
表5 各组大鼠脾脏NF-κB基因的表达结果Table 5 The results of NF-κB gene expression in rats′spleen of each group
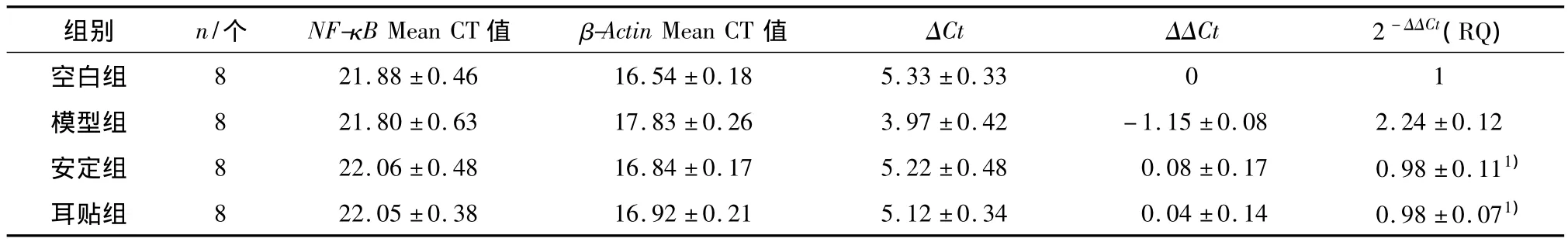
表5 各组大鼠脾脏NF-κB基因的表达结果Table 5 The results of NF-κB gene expression in rats′spleen of each group
1)与模型组比较,P<0.05.
?
表6 各组大鼠脾脏TRIF基因的表达结果Table 6 The results of TRIF gene expression in rats′spleen of each group

表6 各组大鼠脾脏TRIF基因的表达结果Table 6 The results of TRIF gene expression in rats′spleen of each group
1)与模型组比较,P<0.05.
?
与正常对照组比较,模型组大鼠脾组织 TLR4、IRAK1、TRAF6、NF-κB 和 TRIF 的 mRNA 表达水平显著升高(P<0.05);与模型组比较,耳贴组和安定组大鼠TLR4信号通路关键基因表达水平均有不同程度下调(P<0.05),提示睡眠剥夺影响大鼠机体免疫功能与TLR4信号通路关键基因mRNA表达水平上调有关,耳穴贴压可能是通过下调TLR4信号通路关键基因mRNA表达水平,抑制炎症细胞因子如TNF-α、IL-6的释放发挥调整机体免疫功能并间接改善机体睡眠的作用.
与正常对照组比较,模型组大鼠脾组织MyD88 mRNA表达水平未见显著升高(P>0.05);与模型组比较,耳贴组和安定组大鼠MyD88 mRNA表达水平虽有下调趋势,但无统计学差异(P>0.05),提示睡眠剥夺引起的大鼠免疫功能变化与MyD88的表达水平关系不大,可能是通过非MyD88依赖的信号通路起主要作用.
与正常对照组比较,模型组大鼠脾组织TLR4 mRNA表达水平显著升高(P<0.05),耳贴组和安定组大鼠TLR4 mRNA表达水平显著下调,有统计学差异(P<0.05),提示耳穴贴压可能调整且抑制TLR4 mRNA的表达,减少因睡眠剥夺而引起的炎症细胞因子的释放,而发挥治疗失眠症的作用.
大鼠经连续两天腹腔注射PCPA后,昼夜节律消失,白天异常兴奋、攻击性强,几乎达到了完全的睡眠剥夺状态,与未注射PCPA的对照组形成鲜明对比,其行为学表现与以往的文献报道相符,证明造模成功.经耳穴贴压治疗后,其行为、饮食、睡眠等逐渐恢复至正常.
3 讨论
睡眠是机体恢复体力和脑力必不可少的过程.研究表明,睡眠剥夺可引起人的工作能力、认知功能及情绪下降[11].有研究表明,睡眠剥夺可对机体淋巴细胞产生影响.抑制ConA、LPS诱导的脾细胞增殖反应[12];降低外周血淋巴细胞对有丝分裂刺激的增殖[13];减少 T 细胞亚群[14-15]等等.睡眠剥夺可对NK细胞产生影响.Ozturk等[16]实验发现,睡眠剥夺可导致NK细胞数目降低,在睡眠恢复后可逐渐回升至原有水平.睡眠剥夺还有可能对免疫球蛋白产生一定的影响,尽管目前对睡眠剥夺是否能引起免疫球蛋白变化的研究结果不是很明确[13-16].睡眠剥夺可对细胞因子产生影响.吴兴曲等[17-18]相关研究发现,睡眠剥夺后 IL-2、IL-6、TNF-α 和皮质醇等细胞因子水平升高,这可能与应激反应有关.由此,失眠对机体免疫功能存在影响,本实验中,睡眠剥夺造成TLR4信号通路关键基因表达水平上升,反映了睡眠剥夺对机体免疫功能的影响,与相关报道相一致.
本实验结果显示,经过睡眠剥夺,大鼠脾组织TLR4 信号通路关键基因 TLR4、IRAK1、TRAF6、NF-κB和TRIF的mRNA表达水平升高1倍;而经过耳贴和安定干预后的大鼠这些TLR4信号通路关键基因表达水平均有不同程度下调至正常水平上下,说明睡眠剥夺可能通过上调TLR4信号通路关键基因mRNA表达水平影响大鼠机体免疫功能,耳穴贴压治疗失眠症的作用可能与下调TLR4信号通路关键基因mRNA表达水平有关,可能是通过抑制炎症细胞因子如 TNF-α、IL-1、IL-6、IL-8 的释放而发挥调整机体免疫功能[19-21],并间接改善机体睡眠的作用.其中,TLR4的表达水平通过治疗只有正常水平的一半,提示耳穴贴压可能不但可以调整而且还可以抑制TLR4 mRNA的表达.另外,睡眠剥夺大鼠脾组织MyD88的mRNA表达水平未见与其它相关基因的显著升高,耳贴和安定治疗也未对大鼠MyD88的mRNA表达水平有明显影响,可能提示睡眠剥夺引起的大鼠免疫功能变化与MyD88的表达水平关系不大,可能是通过非MyD88依赖的信号通路起主要作用.
结合考虑临床实际情况,耳穴疗法具有简便、廉价、疗效显著、无副作用等优点,又可以调节机体的免疫功能,在失眠症的预防和早期治中可作为首选治疗疗法,对于较严重的失眠症可作为针刺或药物等治疗的辅助手段.
本实验所取的穴位比较单一,睡眠剥夺的时间也比较短,若延长睡眠剥夺及治疗的时间,可能会有更好的效果;可考虑选择其他免疫相关信号通路或其他免疫相关指标TLR7、脾增殖、NK细胞及细胞因子等进行更深入的研究.
[1]周仲瑛.中医内科学[M].北京:中国中医药出版社,2007:146.
[2]RECHTSCHAFFEN A,BERGMANN B M.Sleep deprivation and host de-fense[J].Am J Physiol Regul Integr Comp Physiol,2001,280(2):602.
[3]ROGERS N L,SZUBA M P,STAAB J P,et al.Neuroimmunologic aspects of sleep and sleep loss[J].Semin Clin Neuropsychiatry,2001,6(4):295.
[4]胡卫东,陈更业,鞠光亚.耳穴贴压治疗失眠患者睡眠结构的分析与疗效观察[J].宁夏医学杂志,2003(11):11-13.
[5]陈 峰,戴 晴,杨易平,等.耳穴神门对脑动脉硬化症患者椎─基底动脉血流的即时作用观察[J].中国针灸,1997(12):717-718.
[6]梁 欣,吕明庄,贺志光.耳针、艾灸对D-半乳糖致衰老大鼠血清褪黑素含量及其昼夜节律性的影响[J].中国针灸,2004(8):58 -62.
[7]易世杰,赵礼金.TLR4及其作用的研究进展[J].Journal of SNAKE(Science & Nature),2013,25(2):183 -187.
[8]于莉莉,韩代书.Toll样受体(TLR)介导的天然免疫间的相互调节[J].中国组织化学与细胞化学杂志,2013,21(1):79 -84.
[9]华兴邦,李辞蓉,周皓良,等.大鼠穴位图谱[J].实验动物与动物实验,1999,1(1):1 -4.
[10]张海霞,于建春,韩景献.实验动物腧穴定位探讨[J].吉林中医药,2010,(8):712 -713.
[11]DRUMMOND S P,BROWN G G.The effects of total sleep depriva-tion on cerebral responses to cognitive performance[J].Neuropsychopharmacology,2001,25(5):68.
[12]IRWIN M,MASSCOVICH A,SMITH T L,et al.Partial sleep deprivation reduces natural killer cell activity in humans[J].Psycho-som Med,1994,56(5):493.
[13]袁义强,乔 鹏,章 茜,等.睡眠剥夺对大鼠免疫功能的影响[J].基础医学与临床,2001,21(5):451.
[14]孔庆军,孔令斌,张向阳,等.睡眠剥夺对人体循环免疫细胞的影响[J].济宁医学院学报,2005,28(1):25.
[15]洪 军,裘于容,王升旭,等.睡眠剥夺56小时对正常人血细胞和免疫功能的影响[J].中国临床心理学杂志,2000,11(2):27.
[16]OZTURK L,PELIN Z,KARADENIZ D,et al.Effects of 48 hours sleep deprivation on human immune profile[J].Sleep,1999,2(4):107.
[17]吴兴曲,杨来启,王晓峰,等.睡眠剥夺对大鼠血清细胞因子的影响[J].中国心理卫生杂志,2002,16(6):377.
[18]SHEARER W T,REUBEN H P,DINGES D F.Soluble TNF-alpha receptor 1 and IL-6 plasma levels in humans subjected to the sleep deprivation model of spaceflight[J].J Allergy Clin Im-munol,2001,107(1):165.
[19]TAMAI R,ASAI Y,HASHIMOTO M,et al.Cell activation by monosaccharide lipid a analogues utilizing toll-like receptor 4[J].Immunology,2003,110(1):66 -72.
[20]MACLEOD H,WETZLER L M.T cell activation by TLRs:a role for TLRs in the adaptive immune response[J].Sci STKE,2007,402(2):48.
[21]KELLY M G,ALVERO A B,CHEN R,et al.TLR-4 signaling promotes tumor growth and paclitaxel chemoresistance in ovarian cancer[J].Cancer Res,2006,66(3):3859-3868.
