小鼠精原细胞的分离纯化
2015-10-14李玉华周小羽李润生
李玉华, 段 斐, 周小羽, 李 扬, 李润生
(1. 吉林大学白求恩医学院病理生理学教研室,长春 130021;2. 上海市计划生育科学研究所,上海 200032)
小鼠精原细胞的分离纯化
李玉华1,2, 段斐2, 周小羽2, 李扬1, 李润生2
(1. 吉林大学白求恩医学院病理生理学教研室,长春 130021;2. 上海市计划生育科学研究所,上海 200032)
目的建立一种高效、简便的分离纯化小鼠精原细胞的方法。方法利用胶原酶IV/ 脱氧核糖核酸酶I(DNaseI)/分散酶(dispase)组合酶消化法和差异性贴壁原理,从新生小鼠睾丸中分离、纯化精原细胞。经细胞形态学观察、视黄酸激活基因8(Stra8)免疫化学鉴定精原细胞并进行纯度分析。结果分离到的细胞经Stra8检测呈阳性, 精原细胞纯度可达86%。结论该方法可高效地分离和纯化小鼠精原细胞。
小鼠; 精原细胞; 分离; 纯化
哺乳动物的精子发生从精原细胞有丝分裂成精母细胞,再经减数分裂成圆形精子细胞,经过精子变形阶段形成精子是一个非常复杂的过程。在体外研究精子的发生机制及其影响因素一直是生殖研究领域的一项重要内容,而精原细胞的获取是体外生殖细胞研究的基本条件,因此需要建立一种简单可行的方法,获得较高纯度和活力的精原细胞以满足实验需要。
目前分离和纯化精原细胞的方法主要是组合酶消化法(胶原蛋白酶、透明质酸酶、胰酶等),结合 Percoll 不连续密度梯度离心[1]、免疫磁珠分选法[2]、流式细胞仪分选法[3]等,可以得到高纯度的精原细胞。然而,这些纯化方法较为繁琐,操作时间长,试剂昂贵且需要一定的仪器设备,因而限制了这些方法在实验室常规研究中的使用。
作者根据现行常用方法进行了消化酶组合的优化, 利用差速贴壁法获得纯度和活力较高的精原细胞,为深入研究生精机理以及相关领域的研究建立基础。
1 材料与方法
1.1实验动物
8周龄C57BL/6JSlac雄鼠5只,雌鼠10只,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002],雌雄2:1合笼。选择出生后7~8日龄的小鼠作为实验对象。
1.2主要试剂
胶原酶Ⅳ, 脱氧核糖核酸酶I(DNase I)均购自Sigma公司, 分散酶(dispase)购自Roche公司; 胎牛血清(FBS)购自Biowest公司; 兔抗视黄酸激活基因8(Stra8)抗体购自Abcam公司。
1.3小鼠睾丸HE染色
7~8日龄小鼠的睾丸经Bouin固定,常规技术操作包埋成蜡块、切片,伊红苏木素(HE)染色。
1.4小鼠精原细胞的分离
方法[4,5],应用组合酶法以及差异性贴壁原理分离精原细胞, 经过条件摸索和优化, 采用方法如下。每组10~20只7~8日龄雄性小鼠, 腹腔注射质量分数1%(w/v)戊巴比妥钠进行麻醉。无菌剪取两侧睾丸,放在磷酸盐PBS缓冲液中,小心剥除睾丸的白膜, 用镊子将睾丸小管磨成小段, 松散的小管用移液枪反复吹打直至完全散开。用5 mL PBS 洗涤, 静置沉降, 去除间质细胞,收集曲精小管,重复该步骤2次。质量分数为0.1%(w/v)胶原酶IV+100 μg/mL DNaseⅠ溶液, 37 ℃ 消化20 min,其间每隔5 min轻轻吹打一次,收集单细胞和小管,再用2 U/mL分散酶 + 100 μg/mL DNase I37 ℃消化20 min左右,消化结束后反复吹打形成单细胞悬液,经过200目不锈钢钢筛过滤,1 000 r/min离心5 min收集细胞。
1.5小鼠精原细胞的纯化
单细胞悬液加入到预先用0.1%(w/v)明胶包被过的培养皿中, 用DMEM∶F12 (1∶1)+ 10%(v/v)FBS培养基,5%(v/v)CO2培养箱中培养30 min,可见有大量细胞已经贴壁,小心吸取未贴壁细胞置于新的培养皿中,继续培养2 h,重复贴壁操作,最后吸取悬浮细胞继续培养12 h,离心收集未贴壁的精原细胞。
1.6小鼠精原细胞的鉴定及纯度分析
分离到的精原细胞,采用光学显微镜进行细胞形态观察和Stra8免疫化学方法鉴定。细胞经4% (w/v)多聚甲醛固定后,滴片于防脱玻片上,室温晾干备用。PBS洗涤后,用0.l %(v/v) TritonX-100处理10 min,磷酸盐吐温缓冲液(PBST)洗涤,3% (v/v) H2O2作用10 min。充分洗涤后,正常山羊血清37 ℃封闭30 min; 滴加兔抗Stra8一抗(1∶200)4 ℃过夜,阴性对照用羊IgG代替一抗;PBST洗涤后,加Biotin标记的羊抗兔IgG(1∶200)37 ℃孵育1 h,PBST洗涤,加Streptavidin-HRP(1∶200)37 ℃孵育1 h, 充分洗涤后,DAB显色, 苏木素复染, 0.5%(v/v)HCl分化。常规脱水、二甲苯透明、中性树胶封片。显微镜下观察并计数200个细胞中呈阳性反应的细胞个数, 计算分离到的精原细胞纯度。
2 结果
2.1小鼠精原细胞形态学分析
7~8日龄小鼠睾丸组织经HE染色观察,曲精小管管腔中靠近基底膜的精原细胞体积较大,核卵圆形,多个核仁靠近核膜;近管腔的精原细胞体积略小,呈圆形,有2~3个核仁(图1A)。分离到的细胞在光镜下观察发现,培养皿底有极少量的贴壁细胞,绝大多数为悬浮的呈圆形或近圆形的小鼠精原细胞,胞质少,核大而圆,以单个、成对或串珠状排列,折光性强(图1B)。
2.2Stra-8免疫化学鉴定
分离到的细胞, 经过生殖细胞标志物Stra8免疫化学鉴定, 结果显示绝大部分细胞都呈棕色的阳性反应信号(图1C), 阴性对照组(图1D)没有阳性信号。
2.3精原细胞的纯度分析
显微镜下观察并计数200个细胞中stra-8呈阳性反应的细胞个数,结果显示分离到的精原细胞纯度达86%。
3 讨论
在7~8 日龄小鼠的睾丸曲细精管生精上皮中,主要存在2种类型的细胞,即精原细胞和支持细胞。其中A型精原细胞占17%,B型精原细胞占10%,支持细胞占73%[6]。因此,7~8日龄小鼠睾丸是理想的精原细胞来源。分离小鼠精原细胞的方法, 目前应用最为广泛的是组合酶消化法[7],多数采用胶原蛋白酶、透明质酸酶、胰酶组合消化小鼠睾丸组织,结合机械吹打使得生精小管消化成单个细胞。经过多次条件优化,本实验最终确定酶组合为:胶原酶Ⅳ,DNase I以及分散酶。胶原酶主要用于消化细胞间质和管周肌样细胞,先用机械剥离法分离出曲细精管,由于曲细精管之间的间质细胞连接松散,通过胶原酶消化、机械吹打基本可以去除间质细胞。酶组合中加入DNase I,用于降解分离过程中死细胞所释放的DNA,降低细胞之间的粘附和细胞消化液的粘稠度。最初在摸索条件时,曾使用0.25%的胰蛋白酶,但是胰酶消化的时间和程度较难把握,很容易造成过度消化损伤细胞膜,或者消化不足,从而降低细胞得率和存活率。后改用分散酶替代胰蛋白酶,分散酶是一种非特异性的中性蛋白酶,能很温和地消化细胞外基质,释放出单个细胞,而且不破坏细胞膜结构[8],能明显提高细胞的存活率和细胞得率。
从单细胞悬液中进行精原细胞的纯化, 常用的方法包括差速贴壁法、流式细胞仪分选法[3]、Percoll不连续密度梯度离心法[9]、免疫磁珠分选法[2]等。本文作者最初采用Percoll不连续密度梯度离心法纯化精原细胞,但效果并不理想,一是分层不清,二是细胞损失严重,得率低。因此采用了差速贴壁法,差速贴壁法的原理是支持细胞和成纤维细胞在培养时易于贴壁,而精原细胞单独贴壁困难,利用这一差异性可以进行精原细胞的纯化。分离到的单细胞悬液经反复差速贴壁后,可消除绝大部分支持细胞和管周肌样细胞等,从而提高生精细胞的纯度。差异贴壁法的优点主要是操作简单,有效,而且对精原细胞没有损伤。
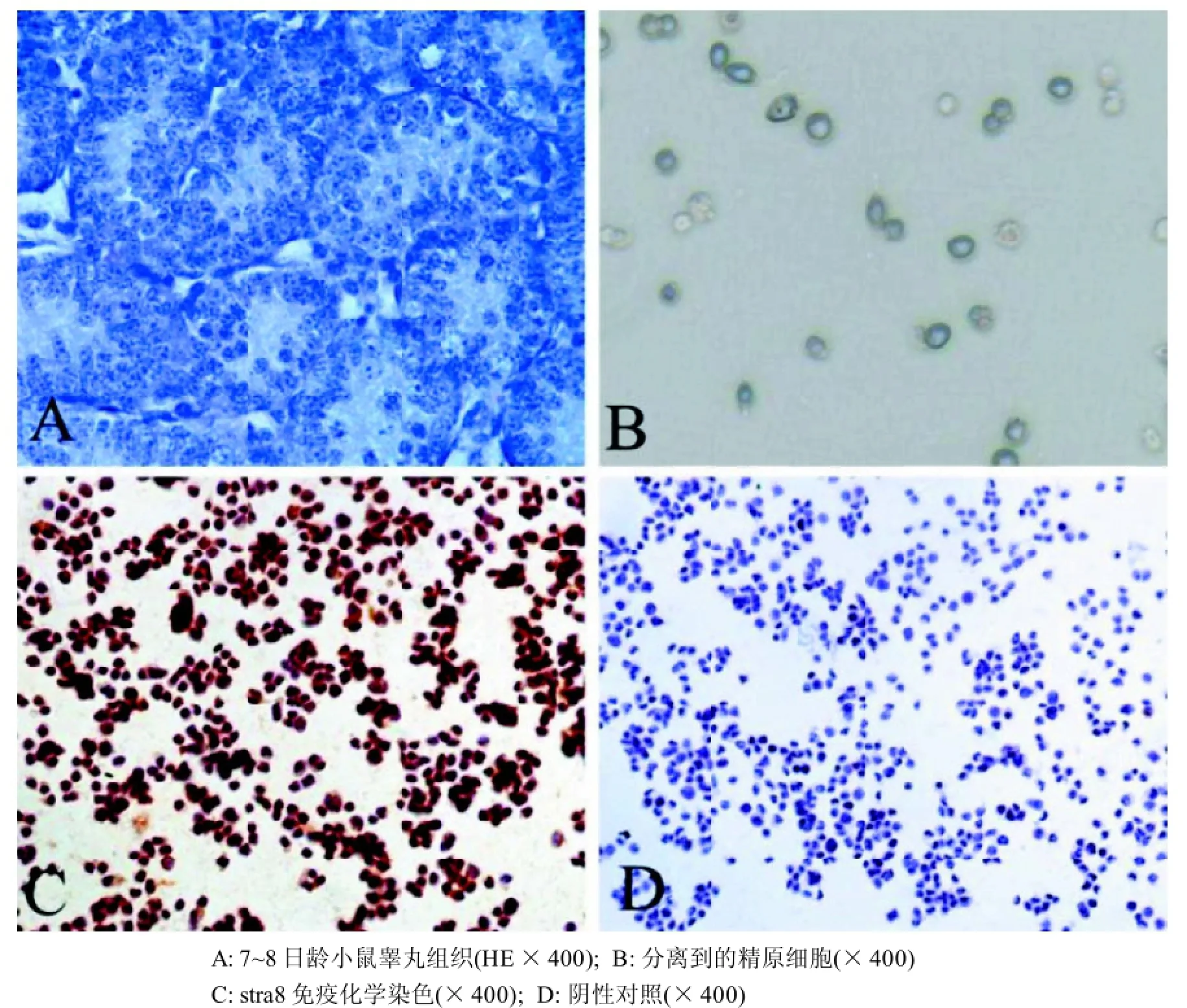
图1 小鼠精原细胞形态学及免疫化学鉴定Figure 1 Identification of isolated mouse spermatogonia by morphology and immunochemistry
Stra8 (stimulated by retinoic acid gene 8)基因是哺乳动物生殖细胞由有丝分裂转变为减数分裂前特异表达的基因,在出生后至成年仅在睾丸减数分裂前的生精细胞上表达,常常用来作为睾丸生殖细胞的标志物[10]。通过检测分离到的细胞中stra8的表达情况来判断精原细胞的特异性和纯度。本实验分离到的小鼠精原细胞经过Stra8免疫化学鉴定分析,纯度可达86%。分离纯化效果优于张晓丽等人报道的胶原酶、透明质酸酶、胰酶组合及Percoll不连续密度梯度离心法[11],也高于王永彬等[12]所使用的胶原酶和胰酶组合法结合Percoll 不连续密度梯度离心纯化得到的精原干细胞。
本实验采用的胶原酶IV/DNase I/Dispase组合酶消化法结合差速贴壁法可以制备出高纯度、高质量的精原细胞,完全能满足体外实验的需要。
参考文献:
[1]Bucci LR, Brock WA, Johnson TS, et al. Isolation and biochemical studies of enriched populations of spermatogonia and early primary spermatocytes from rat testes[J]. Biol Reprod, 1986, 34(1):195-206.
[2]贺亚南, 陈晓丽, 任晓霞, 等. 免疫磁珠纯化小鼠精原干细胞的研究 [J]. 中国生物工程杂志, 2014, 34(7):38-43.
[3]Lassalle B, Ziyyat A, Testart J, et al. Flow cytometric method to isolate round spermatids from mouse testis[J]. Hum Reprod, 1999, 14(2):388-394.
[4]Guan K, Wolf F, Becker A, et al. Isolation and cultivation of stem cells from adult mouse testes[J]. Nat Protoc, 2009, 4 (2):143-154.
[5]刘丹, 夏娟, 刘欢欢, 等. 哺乳动物精原干细胞体外分离培养研究进展[J]. 四川动物, 2014, 33(2):315-320.
[6]Bellve AR, Cavicchia JC, Millette CF, et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization[J]. J Cell Biol, 1977, 74(1):68-85.
[7]Boucheron C and Baxendale V, Isolation and purification of murine male germ cells[J]. Methods Mol Biol, 2012. 825:59-66.
[8]Craviso GL, Generation of functionally competent single bovine adrenal chromaffin cells from cell aggregates using the neutral protease dispase[J]. J Neurosci Methods, 2004. 137 (2) : 275-281.
[9]师如意, 卫恒习, 李莉, 等. 猪精原干细胞体外培养条件的优化[J]. 华南农业大学学报, 2013,34(2):224-229.
[10] Oulad-Abdelghani M, Bouillet P, Decimo D, et al. Characterization of a premeiotic germ cell-specific cytoplasmic protein encoded by Stra8, a novel retinoic acid-responsive gene[J]. J Cell Biol, 1996, 135(2):469-477.
[11] 张晓丽, 高英茂, 赵舒武, 等. 新生小鼠精原细胞分离和纯化的实验研究[J]. 山东大学学报(医学版), 2005, 43(8): 674-677.
[12] 王永彬, 刘凤美, 张军令, 等. 小鼠精原干细胞的分离纯化及初步鉴定[J]. 黑龙江动物繁殖, 2014, 22(4):19-22.
Isolation and Purification of Mouse Spermatogonia
LI Yu-hua1,2, DUAN Fei2, ZHOU Xiao-yu2, Li Yang1, LI Run-sheng2
(1. Department of Pathophysiology, Norman Bethune College of Medical Sciences, Jilin University, Changchun 130021, China; 2. Shanghai Institute of Planned Parenthood Research, Shanghai 200032, China)
ObjectiveTo establish a simple and efficient method for separation and purification of mouse spermatogonia. MethodsSpermatogonia were isolated and purified from neonatal mouse testis using collagenase IV/DNase I/dispase combination enzymatic digestion and differential velocity of cell adherence method. Isolated spermatogonia were analyzed by morphology and stra8 immunochemistry. ResultsThe isolated spermatogonia were stra8 positive and cell purity was as high as 86%. Conclusion This method is efficient for separation and purification of mouse spermatogonia .
Mouse; Spermatogonia; Isolation; Purification
R321.1 Q95-33
A
1674-5817(2015)01-0042-04
10.3969/j.issn.1674-5817.2015.01.009
2015-01-25
国家自然科学基金资助项目(编号81270760)
李玉华(1974-), 女, 在职博士研究生, 从事生殖医学研究工作, E-mail: li_yuhua@163.com
李润生, E-mail: runshengli2007@163.com 李扬, E-mail: lyang@jlu.edu.cn
