一株鸭源新城疫病毒分子特性及对SPF鸡、鸭致病性的比较研究
2015-10-14刘怀然刘胜旺陈洪岩
吴 伟,刘怀然,刘胜旺,,陈洪岩,
(1. 东北农业大学, 哈尔滨 150030; 2. 中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室, 哈尔滨 150001)
一株鸭源新城疫病毒分子特性及对SPF鸡、鸭致病性的比较研究
吴伟1,刘怀然2,刘胜旺1,2,陈洪岩1,2
(1. 东北农业大学, 哈尔滨 150030; 2. 中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室, 哈尔滨 150001)
目的研究一株鸭源新城疫病毒分子的特性,并比较其对SPF鸡和SPF鸭致病性的不同。方法 将分离到的病毒克隆、测序并用SPF鸡和SPF鸭分别评价该毒株的致病性。结果Du/CH/ LGD/358/2011的基因组由15 198个核苷酸序列组成,编码6种结构蛋白。F基因裂解位点的氨基酸序列为112 ERQER/L117。通过全基因组核苷酸序列和F基因高变区核苷酸序列构建遗传进化树,证明该毒株属于class I基因3b型,与香港活禽市场分离到的毒株类似,但略有不同。该毒株对SPF鸡和SPF鸭的致病性基本一致。结论该毒株为弱毒株,使用SPF鸡和SPF鸭均可以对鸭源弱毒株进行致病性评价,为SPF鸭的检测提供理论依据。
新城疫病毒; SPF鸭; SPF鸡; 致病性; 分子特性
新城疫(Newcastle disease,ND)是由新城疫病毒(NDV)引起的一种急性、高度接触性传染病,该病一旦爆发会对养禽业造成巨大的经济损失[1]。NDV 又称为禽I型副黏病毒(Avian Paramyxovirus I)为单股负链、不分节段的RNA 病毒,属于副黏病毒科(Paramyxoviridae)的腮腺炎病毒属(Avulavirus)。NDV主要编码以下6种结构蛋白:核衣壳蛋白(nucleoprotein, NP)、磷蛋白(phosphoprotein, P)、基质蛋白(matrix protein, M)、融合蛋白(fusion protein,F)、血凝素-神经氨酸酶蛋白(hemagglutininneuraminidase,HN)和RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,L)[2]。此外,P基因转录过程中还会出现RNA编辑现象,因而产生两种额外的蛋白质(V蛋白和W蛋白)[3]。虽然NDV只有一个血清型,但根据全基因组序列和F基因高变区的系统发育分析可将所有毒株分为class I 和class II两大类,其中class I分为9个基因型,class II 分为15个基因型[4]。
NDV宿主非常广泛,但NDV对不同宿主的致病性有很大差异[5]。最近一些报道表明,无毒的NDV在从水禽传播给鸡群后, 可能会变成强毒株[6]。因此,为了避免ND的再次爆发,对弱毒株的研究也变得尤为重要。本研究从广东省健康鸭中分离到一株NDV,对其分子特性及对SPF鸡和SPF鸭致病性进行比较研究,有助于正确了解弱毒鸭源NDV对SPF鸡和SPF鸭的致病性,对于科学的防控ND具有重要的指导意义。
鸭等水禽养殖在我国养禽业中占有重要地位,我国已是世界上最大的水禽养殖国,开展水禽疫病研究及相关制品研发十分重要,而SPF鸭则是开展水禽疫病研究、相关制品研发及制品生产、检验必不可少的高品质实验动物。目前我国对SPF鸭的净化培育工作尚在进行中,鸭源NDV是SPF鸭微生物学质量控制标准提出及检测方法建立重要的关注点之一,也正是开展本研究的出发点。
1 材料与方法
1.1病毒来源与实验动物
NDV Du/CH/LGD/358/2011株分离于2011年广东省健康鸭泄殖腔拭子。SPF鸡胚、SPF鸡、SPF鸭胚和SPF鸭由中国农业科学院哈尔滨兽医研究所国家禽类实验动物种子中心提供[SYXK (黑)2006-032]。SPF鸡、SPF鸭NDV感染实验在中国农业科学院哈尔滨兽医研究所动物用生物制品国家工程研究中心动物实验设施进行[SYXK (黑)2006-032]。
1.2主要实验材料
RNAiso Plus、One Step RT-PCR Kit Ver.2、3'-Full RACE Core Set Ver.2、Clontech SMARTerTM RACE cDNA Amplification Kit、DNA Maker、pMD18-T载体均购自宝生物工程(大连)有限公司;DNA纯化回收试剂盒购自Omega公司;Top10感受态细胞由本实验室制备并保存;引物由本实验室设计并保存。
1.3病毒的分离与鉴定
将鸭泄殖腔拭子浸泡在含双抗的PBS中,用旋涡混合器高速震荡,震荡完毕后8 000 r/min离心10 min, 吸取上清液并用0.22 μm的滤器过滤, 取滤液接种9~11日龄的SPF鸡胚, 0.1 mL/枚, 37 ℃培养。72 h收集鸡胚的尿囊液,然后按常规方法进行血凝(HA)试验和血凝抑制(HI)试验,将判定为NDV阳性的病毒命名为 Du/CH/LGD/358/2001。
1.4病毒RNA的提取以及基因组RT-PCR扩增
按照说明从繁殖病毒的尿囊液中直接提取病毒RNA,采用一步法RT-PCR扩增病毒基因组全长。反应程序为: 50 ℃ 30 min,94 ℃ 2min; 94 ℃ 30 s、55 ℃ 30 s、72 ℃ 2 min,30个循环; 72 ℃ 10 min。基因组5'端和3'端的序列分别参照Clontech SMARTerTM RACE cDNA Amplification Kit和3'-Full RACE Core Set Ver.2的使用说明书进行扩增。
1.5PCR产物的克隆和测序分析
将扩增的片段分别克隆于pMD18-T载体中,由北京六合华大基因科技股份有限公司进行测序。测序后用DNAStar软件进行全基因序列的拼接。根据参考毒株的基因组序列,分析并推导出毒株6个蛋白质的氨基酸序列与GenBank中其他参考毒株做同源性分析。并以MEGA5.0软件对该病毒株的全基因组以及F基因高变区序列进行遗传进化分析。
1.6鸡胚、鸭胚半数感染量(EID50)的测定
用PBS倍比稀释病毒尿囊液,取10-5~10-9这5个稀释度分别接种SPF鸡胚、SPF鸭胚,每个稀释度分别接种5枚9日龄SPF鸡胚、SPF鸭胚,0.1 mL/枚,37℃培养5 d,每日观察1次,记录各稀释度接种胚的死亡胚数,5 d后记录被感染的胚数,用Reed-Muench法计算EID50。
1.7鸡胚、鸭胚平均死亡时间(MDT)的测定
用PBS倍比稀释病毒尿囊液,取10-1~10-4这4个稀释度分别接种SPF鸡胚、SPF鸭胚,每个稀释度分别接种5枚9日龄SPF鸡胚、SPF鸭胚,0. 1 mL/枚,37℃培养7 d,每隔8 h照胚观察,记录每个胚的死亡时间。
1.81日龄雏鸡、雏鸭脑内接种致病指数(ICPI)的测定
将病毒尿囊液用PBS做10倍的倍比稀释,稀释后分别接种10只出壳后24~36 h的SPF鸡、SPF鸭,每只脑内接种0.05 mL,同时设立对照组4只,相同剂量接种PBS。每日观察鸡群的健康状况,将正常鸡记为0,发病鸡记为1,死亡鸡记为2,连续观察8 d,最后按公式求出ICPI。
2 结果
2.1病毒的分离鉴定
接种病毒滤液的SPF鸡胚出现NDV典型病变,鸡胚尿囊液的血凝价为1∶256。经血凝抑制试验鉴定为NDV, 与禽流感阳性血清的试验结果为阴性。
2.2Du/CH/LGD/358/2011的全基因组序列扩增、克隆及测序
从Du/CH/LGD/358/2011病毒RNA中扩增出11条与预计大小相符的片段(图1)。将扩增片段分别克隆于pMD18-T载体中,筛选重组阳性质粒,每个片段选择3个以上独立克隆进行测序,保证病毒株序列测定的准确性。
2.3Du/CH/LGD/358/2011全基因组序列的分析
将RT-PCR扩增出的11条目的片段克隆,测序后通过DNAStar软件进行拼接。结果表明,Du/ CH/LGD/358/2011病毒株的基因组全长为15 198 bp,符合NDV基因组长度的“6的倍数”规则[7]。与参考病毒株NDV08-004进行比较,显示该分离株基因组的组成特征为3'-NP-P-M-F-HN-L-5', 符合NDV基因组组成特征。与参考毒株La Sota基因组比较, Du/CH/LGD/358/2011基因组在2 381和2 382位之间有12nt的插入, 插入序列为CGGGAAACGGGG, 符合class I病毒株基因组组成特征。该分离株的F基因ORF共有1 662nt, 编码553个氨基酸,裂解位点为112 ERQER/L117, 属于弱毒株裂解区氨基酸序列特点, 与其生物学特性相符。根据DNAStar软件推导的Du/CH/LGD/358/2011的各个蛋白的氨基酸序列与Genbank中各基因型代表毒株的各个蛋白的氨基酸做同源性比较分析结果见表1。
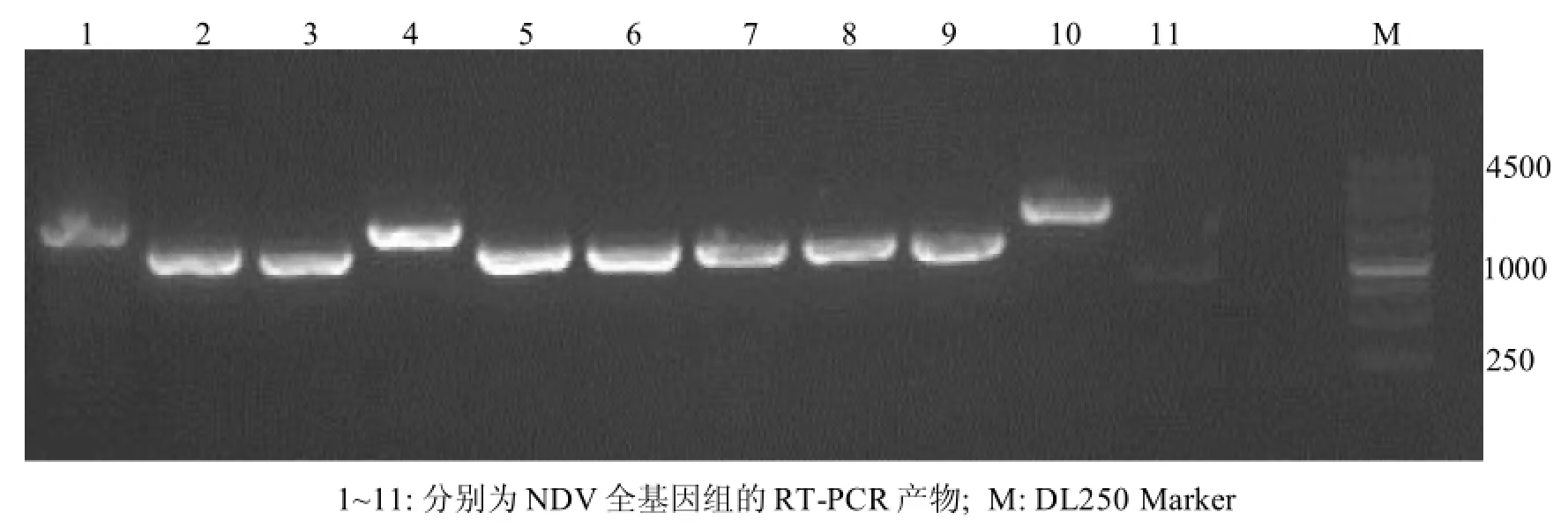
图1 NDV全基因组的RT-PCR扩增的11个重叠片段电泳图谱Figure 1 RT-PCR amplifications of the 11 overlapping fragments covering the whole genome of NDV
2.4系统进化树分析
将Du/CH/LGD/358/2011全基因组序列与已发表的21株全基因组序列进行系统进化树分析,结果表明该毒株为class I 基因3型毒株(图2)。为进一步对该毒株的系统进化关系分析,以该毒株的F基因高变区的序列(47~420 nt)和其他24株class I参考毒株的相应区域绘制进化树。基因分型的结果与全基因组绘制的进化树相一致,并且进一步地将该毒株划分为3b亚型(图3)。
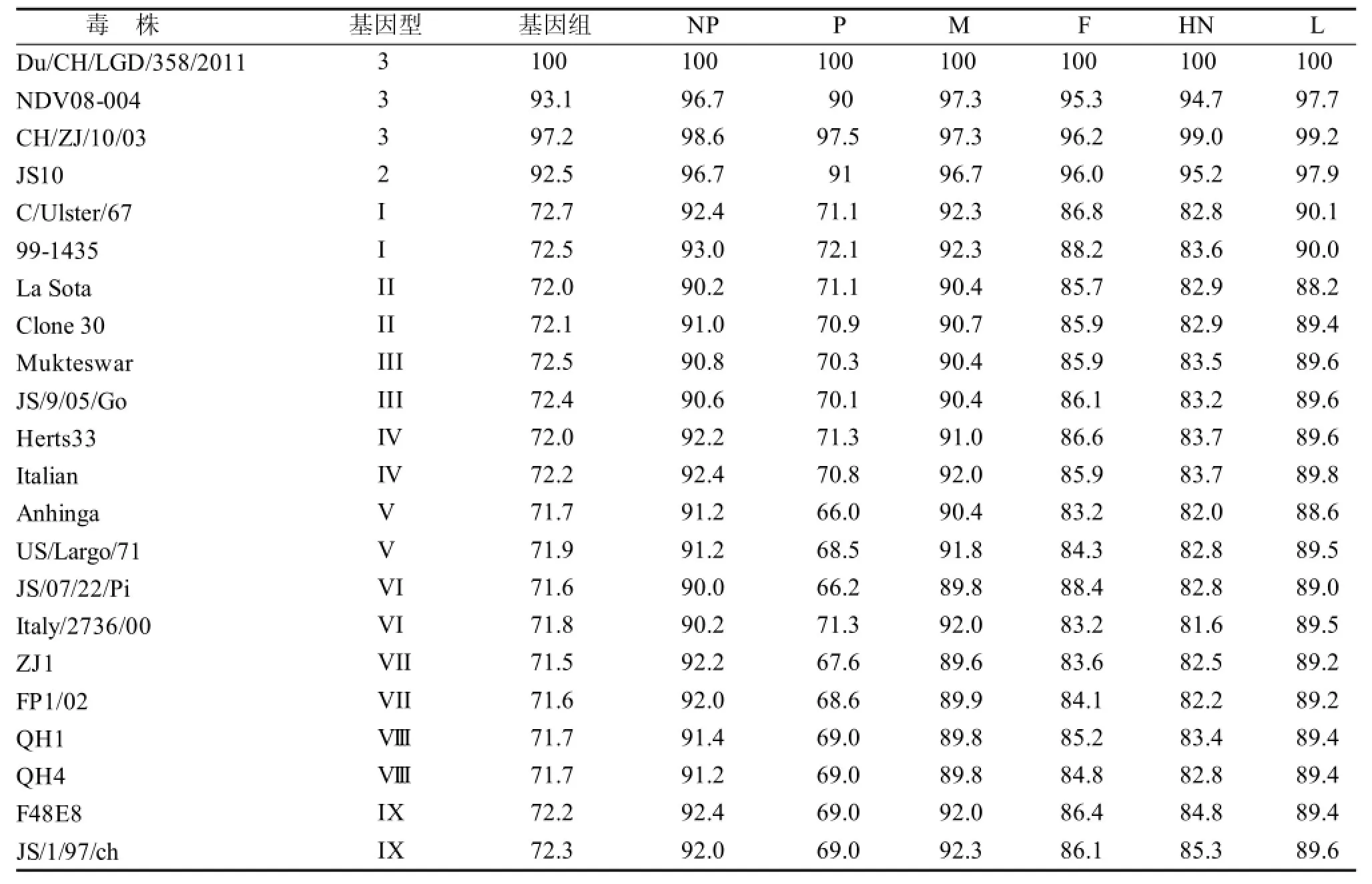
表1 毒株Du/CH/LGD/358/2011与NDV代表毒株基因组与氨基酸的同源性比较Table 1 Similarity comparisons of genome and predicted protein sequences between Du/CH/LGD/358/2011 isolate and other typical NDVs %
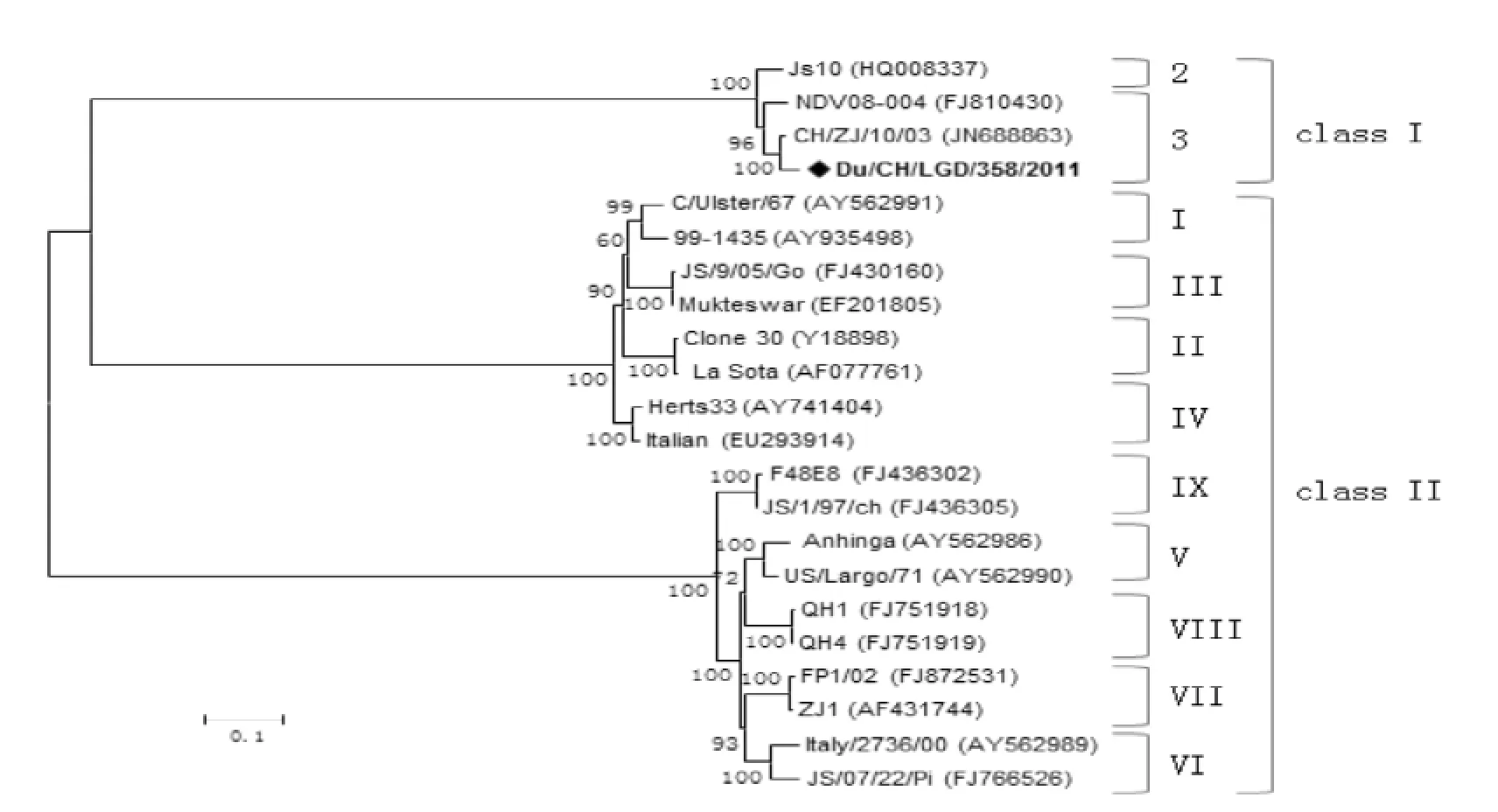
图2 NDV全基因组核苷酸序列系统进化分析Figure 2 Phylogenetic tree constructed on the basis of the complete genomes of NDV
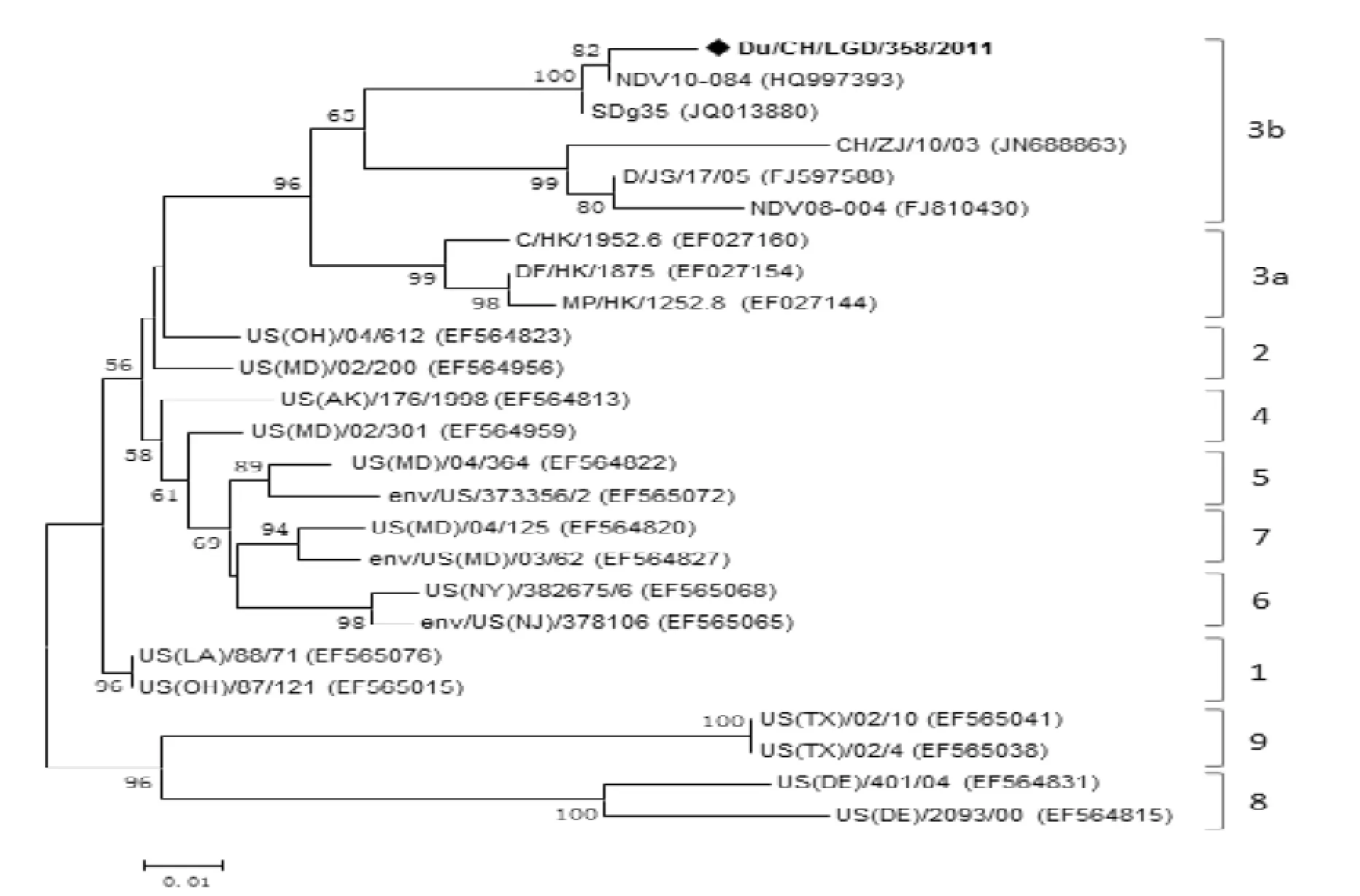
图3 F基因高变区核苷酸序列系统进化分析Figure 3 Phylogenetic tree constructed on the basis of the partial F gene
2.5Du/CH/LGD/358/2011对SPF鸡和SPF鸭的致病性
毒株Du/CH/LGD/358/2011对SPF鸡胚的半数感染量(EID50)为10-8.63/0.1 mL; 对SPF鸭胚的半数感染量(EID50)为10-8.38/0.1 mL。该毒株对SPF鸡的ICPI值为0; 对SPF鸭的ICPI值为0.05。该毒株对SPF鸡胚和SPF鸭胚分别进行MDT试验,从10-1到10-4这四个稀释度均未造成鸡胚和鸭胚全部死亡。综合以上数据表明,弱毒鸭源NDV对SPF鸡和SPF鸭的致病性基本一致。
3 讨论
新城疫是由新城疫病毒引起的一种急性,高度接触性的烈性传染病,世界动物卫生组织(OIE)将其列为法定报告A类疫病。自1926年以来,在全球范围内至少已造成4次大流行,造成了巨大的经济损失。水禽曾被认为是NDV潜在的宿主,即使感染强毒的NDV也通常表现出较少或不表现任何临床症状[8]。但是1997年之后我国陆续出现了鹅和鸭感染新城疫并伴随较高的发病率和死亡率的报道,很多学者开始重视水禽感染NDV的研究。本研究从中国广东省的一只健康鸭中分离得到一株NDV,其基因组长度为15 198nt,编码6种结构蛋白。其裂解位点序列为112ERQER/L117符合弱毒株序列特点,与其生物学特性相一致。根据全基因组核苷酸序列和F基因高变区核苷酸序列构建进化树, 结果表明Du/CH/LGD/358/2011属于class I基因3b型,与香港活禽市场的鸡群中发现的病毒类似[9,10],说明这种类型的弱毒株可以在水禽和陆禽之间传播。由于这种鸭源的class I NDV具有传播到鸡群的可能,且在选择压力下有可能发生毒力增强。因此,应加强对鸭源新城疫病毒的主动监测和预防。
将该毒株与 21个参考毒株的全基因组核苷酸序列进行比对,同源性在71.5%~97.2%,其中与CH/ZJ/10/03同源性最高达到97.2%,与另外两株class I毒株同源性也在90%以上, 而与其他class II毒株的同源性仅在71.2%~72.7%。又将该毒株与21个参考毒株的各个蛋白氨基酸序列进行比对,发现NP、M、L蛋白相对保守,而P蛋白氨基酸序列差异最大,可能是因为class I毒株相比于class II毒株在P蛋白有4个氨基酸序列的插入造成的。由于class I和class II毒株的全基因组核苷酸序列和各结构蛋白氨基酸序列之间存在较大的差异,因此可能导致毒株之间的抗原差异较大。目前我国使用的NDV疫苗主要为La Sota、V4和Mukteswar,均为class II类弱毒株,它们对大部分强毒株起到较好的保护作用,但对class I类毒株保护性可能相对较差。因此,能够对class I类毒株产生良好保护性的新疫苗显得十分重要。该毒株对SPF鸡和SPF鸭的致病性试验结果基本一致,表明对鸭源弱毒NDV致病性的评价,采用SPF鸡和SPF鸭均可。
通过对该毒株的研究表明,在检测SPF鸭是否携带NDV时,可以采用血凝试验和血凝抑制试验来鉴定或设计保守引物进行反转录PCR来鉴定。反转录PCR具有特异、快速、灵敏、简便等优点,还能消除常规血清学检测中非特异性因素的干扰及敏感性的问题。因此,可以作为SPF鸭检测NDV的一种重要方法之一。
[1]孙委委,孙初阳,张晓楠,等. 一株基因 Ⅱ 型新城疫病毒的分离及基因组分析[J]. 中国预防兽医学报, 2010 (3):175-178.
[2]de Leeuw O, Peeters B. Complete nucleotide sequence of Newcastle disease virus: evidence for the existence of a new genus within the subfamily Paramyxovirinae[J]. J Gen Virol,1999, 80(1):131-136.
[3]Steward M, Vipond IB, Millar NS, et al. RNA editing in Newcastle disease virus[J]. J Gen Virol, 1993, 74(12):2539-2548.
[4]Kim LM, King DJ, Curry PE, et al. Phylogenetic diversity among low-virulence Newcastle disease viruses from waterfowl and shorebirds and comparison of genotype distributions to those of poultry-origin isolates[J]. J Virol, 2007, 81 (22):12641-12653.
[5]Kaleta EF, Baldauf C. Newcastle disease in free-living and pet birds[M]. In: Alexander DJ(ed). Newcastle disease. New York: Springer , 1988: 197-246.
[6]Shengqing Y, Kishida N, Ito H, et al. Generation of velogenic Newcastle disease viruses from a nonpathogenic waterfowl isolate by passaging in chickens[J]. Virology, 2002, 301(2): 206-211.
[7]Peeters BPH, Gruijthuijsen YK, De Leeuw OS, et al. Genome replication of Newcastle disease virus: involvement of the rule-of-six[J]. Arch Virol, 2000, 145(9):1829-1845.
[8]石跃, 刘怀然, 刘培欣, 等. 一株野鸭源基因 Ⅲ 型新城疫病毒主要生物学特性及基因组序列测定分析[J]. 中国预防兽医学报, 2011, 33(5):391-394.
[9]Kim LM, King DJ, Curry PE, et al. Phylogenetic diversity among low-virulence Newcastle disease viruses from waterfowl and shorebirds and comparison of genotype distributions to those of poultry-origin isolates[J]. J Virol, 2007, 81 (22):12641-12653.
[10] Kim LM, King DJ, Suarez DL, et al. Characterization of class I Newcastle disease virus isolates from Hong Kong live bird markets and detection using real-time reverse transcription-PCR[J]. J Clin Microbiol, 2007, 45(4):1310-1314.
Molecular Characteristics and Pathogenicity of Newcastle Disease Virus from Domestic Ducks in China
WU Wei1, LIU Huai-ran2, LIU Sheng-wang1,2, CHEN Hong-yan1,2
(1. Northeast Agricultural University, Harbin 150030, China; 2. State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences, Harbin 150001, China)
ObjectiveTo study the molecular characteristics of Newcastle disease virus from domestic ducks, and then compare the pathogenicity in SPF chicken and ducks. MethodsBy cloning and sequencing the complete genomic sequence of Newcastle disease virus (NDV) strain Du/CH/LGD/ 358/2011, and then conducted the pathogenicity test in SPF chicken and ducks. ResultsThe genome was 15 198 nucleotides (nt) in length, followed the “rule of six” that is required for replication of NDV strains, and encoded six structural polypeptides. The cleavage motif of F protein was 112 ERQER/ L117, which was the characteristic of lentogenic strain. Phylogenetic analysis based on complete genomic sequences and partial sequences of F gene revealed that Du/CH/LGD/358/2011 belonged to class I genotype 3b, an independent clade closely related to Hong Kong LBM viruses. In addition, the pathogenic results between SPF chickens and SPF ducks was hardly varied. ConclusionDu/CH/LGD/ 358/2011 belonged to lentogenic strain, both SPF chicken and ducks could estimating be used fpr the pathogenicity. This study provided the theoretical basis for mornitoring on SPF ducks.
Newcastle disease virus; SPF duck; SPF chicken; Pathogenicity; Molecular characteristics
Q95-33
A
1674-5817(2015)01-0065-06
10.3969/j.issn.1674-5817.2015.01.014
2014-12-08
公益性行业(农业)科研专项经费项目(201303033)
吴伟(1988-), 男, 硕士研究生。E-mail: 709558484@qq.com
刘胜旺, 男, E-mail: swliu@hvri.ac.cn。陈洪岩, 男, E-mail: chenhongyan@caas.cn
