乙二胺四乙酸驱镉对慢性镉中毒大鼠、小鼠的肾毒性
2015-10-14李光先钟志勇陈嘉兴余日安唐小江
李光先, 钟志勇, 陈嘉兴, 余日安, 唐小江
(1. 广东药学院公共卫生学院, 广州 510310; 2. 广东省医学实验动物中心, 南海 528248)
乙二胺四乙酸驱镉对慢性镉中毒大鼠、小鼠的肾毒性
李光先1,2, 钟志勇2, 陈嘉兴1,2, 余日安1, 唐小江2
(1. 广东药学院公共卫生学院, 广州 510310; 2. 广东省医学实验动物中心, 南海 528248)
目的探讨乙二胺四乙酸(EDTA)治疗慢性镉中毒动物模型毒副作用。方法将雄性SD大鼠、雄性NIH小鼠分别随机分为空白对照组和模型组。模型组腹腔注射CdCl2+ β-巯基乙醇(ME)的混合液,每日一次,连续5 d,末次染毒50 d及30 d后分别随机分为模型对照组和EDTA治疗组。空白对照组和模型对照组腹腔注射生理盐水; EDTA治疗组按体质量腹腔注射EDTA溶液,实验结束后均采集动物的尿液、血液肾脏及睾丸组织,检测体内Cd和组织病理检查。结果实验结束时,EDTA组大鼠、小鼠的肾脏Cd、尿Cd和血Cd含量明显高于模型对照组(P<0.05),并见肾小管蛋白质沉淀。结论EDTA会引起体内的镉向肾脏富集,不宜用于慢性镉中毒驱镉。
慢性镉中毒; 二胺四乙酸(EDTA); 肾毒性
镉是人类确定致癌物和肾毒物。根据环保部和国土资源部公报, 我国约有7%的土壤存在不同程度的镉污染[1]。镉超标和镉中毒事件频发, 成为社会关注的热点[2,3]。镉进入机体后逐渐在肾小管细胞内富集, 影响钙重吸收, 导致骨质疏松、肾衰竭和癌症等慢性危害[4]。有学者认为, 二硫代氨基甲酸类、氨羧类以及巯基类络合剂有驱镉作用并已用于临床研究, 但大量研究结果表明其对慢性镉中毒无效或存在毒副作用, 因此目前没有特效驱镉解毒药[5,6]。有人主张使用二胺四乙酸(EDTA)进行体内驱镉, 但其安全性与有效性一直有争议[7-9]。为此, 本文旨在通过体内实验探讨EDTA对大、小鼠慢性镉中毒的驱镉效果及其副作用, 为驱镉药物的研发提供理论依据。
1 材料与方法
1.1实验动物
SPF级雄性SD大鼠20只, 体质量180±14 g;SPF级雄性NIH小鼠30只,体质量17±5 g,均购自广东省医学实验动物中心[SYXK(粤)2013-0002],饲养于广东省医学实验动物中心比较医学实验室[SYXK(粤)2013-0002]。饲养条件:温度20~26 ℃,相对湿度40%~70%,10~14 h昼夜间断照明。动物实验经广东省医学实验动物中心实验动物福利和伦理委员会批准。
1.2主要试剂和仪器
氯化镉(CdCl2·2.5H2O)购于天津市福晨化学试剂厂,批号:20081012; β-巯基乙醇(ME),Sigma公司,批号:M6250;EDTA由天津市福晨化学试剂厂提供,批号:130224。 BS224S电子天平(德国Sartorius 公司); SET6040恒温电热板(深圳帆与航电子科技有限公司); 全自动生化分析仪(ECHO,意大利Logotec公司); 石墨炉原子吸收光谱仪(型号: ZEENIT700,德国Analytikjena公司); 轮转切片机(德国LEICA公司 RM2135); 生物组织全自动脱水机、生物组织包埋机及冷冻机和生物组织全自动染色机(湖北孝感医用仪器有限公司 TS-12C、BM-VII、RS-18); 正置显微镜(Olympus BX41),病理图像分析系统(Image-Pro Express 5.1.1.14)。
1.3动物实验方法
1.3.1EDTA对大鼠慢性镉中毒模型的驱镉试验将20只雄性SD大鼠随机分为空白对照组(8只)和模型组(12只)。模型组大鼠腹腔注射3 μmol/kg CdCl2+60 μmol/kg β-巯基乙醇(ME)的混合液[10],每日1次, 连续5 d, 末次染毒50 d后随机分为模型对照组(6只)和EDTA治疗组(6只)。空白对照组和模型对照组腹腔注射生理盐水; EDTA治疗组按体质量腹腔注射187.1 mg/kg的EDTA溶液, 每周5次, 连续3周; 试验期间每周称量体质量1次。按1.4采集尿液、血液及肾脏,检测体内Cd和组织病理检查。
1.3.2EDTA对小鼠慢性镉中毒模型的驱镉试验将30只雄性NIH小鼠随机分成空白组(10只)和模型组(20只)。模型组小鼠腹腔注射6 μmol/kg CdCl2+ 120 μmol/kg ME混合液[11],每日1次,连续5 d,末次染毒30 d后随机分为模型对照组(10只)和EDTA治疗组(10只)。空白对照组和模型对照组腹腔注射生理盐水; EDTA治疗组腹腔注射93.6 mg/kg 的EDTA溶液,每周5次,连续4周; 试验期间每周称量体质量1次。按1.4采集尿液、血液及肾脏,检测体内Cd和组织病理检查。
1.4样品采集与镉含量检测
1.4.1样品采集与处理试验结束前1 d,用代谢笼收集动物24 h尿液,分别取1 mL采用生化分析法测定尿肌酐含量和1 mL用于检测尿镉。随后经动物眼眶静脉丛采血1 mL于加有1%肝素钠30 μL的抗凝管中。用二氧化碳窒息法处死动物, 采集动物的肾脏和睾丸组织取其中一部分称重后, 用5 mL浓硝酸+2 mL过氧化氢+0.5 mL高氯酸进行热消化,定溶于10 mL比色管; 取另一部分肾脏和睾丸组织以质量分数4%甲醛溶液固定做病理学检查。
1.4.2镉含量检测血镉、尿镉和肾、睾丸镉采用石墨炉原子吸收光谱法测定[12,13],

1.5统计分析
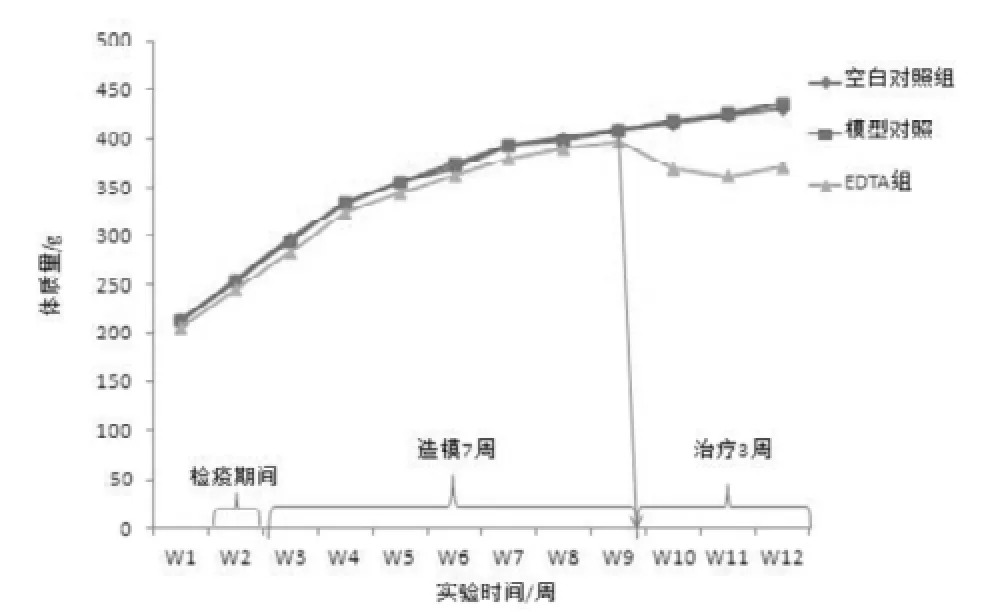
图1 EDTA治疗慢性镉中毒大鼠的体质量变化
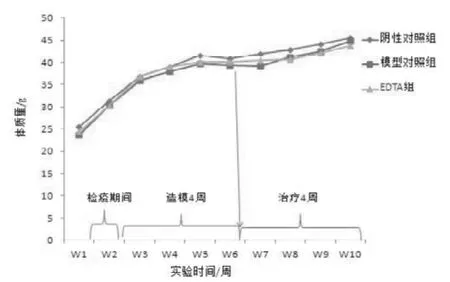
图2 EDTA治疗慢性镉中毒小鼠的体质量变化
2 结果
2.1动物体质量变化
动物按体质量随机分组后,各组间无差异(P>0.05)。试验期间空白对照组和模型对照组体质量稳定增长。SD大鼠经EDTA治疗1周后,EDTA组各周体质量较空白对照组和模型对照组均显著下降(P<0.05)(图1)。但小鼠经EDTA处理后, 各组间体质量差异无统计意义(P>0.05)(图2)。
2.2大鼠血镉浓度、肾镉和睾丸含量
造模结束后,模型组大鼠的肾脏和睾丸Cd含量及血Cd浓度均显著高于空白对照组(P<0.05)。EDTA治疗3周后,EDTA治疗组大鼠的血Cd浓度、肾Cd含量较模型对照组升高(P<0.05)(表1)。
2.3小鼠血镉浓度、肾镉和睾丸含量
造模结束后,模型组小鼠的肾脏和睾丸Cd含量及血Cd浓度较空白对照组上升(P<0.05)。EDTA治疗4周后,治疗组小鼠的血Cd浓度和肾Cd含量显著高于模型对照组(P<0.05)(表2)。
2.4大、小鼠24 h尿镉含量
EDTA治疗慢性镉中毒大鼠3周后,模型对照和EDTA治疗组大鼠24 h尿Cd总量均高于空白对照组(P<0.05); EDTA组24 h尿Cd总量较模型对照组升高(P<0.05)。EDTA治疗慢性镉中毒小鼠4周后,模型对照和EDTA治疗组小鼠24 h尿镉总量均高于空白对照组(P<0.05); EDTA组24 h尿镉总量较模型对照组升高(P<0.05)(表3)。
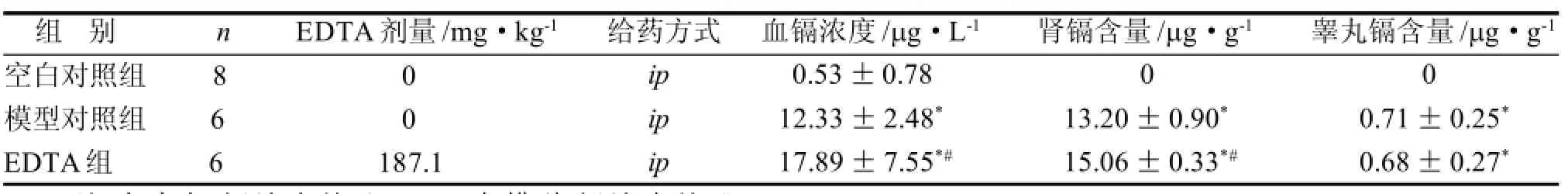
表1 EDTA治疗慢性镉中毒大鼠的血镉肾镉和睾丸镉变化

表2 EDTA治疗慢性镉中毒小鼠的血镉肾镉和睾丸镉变化
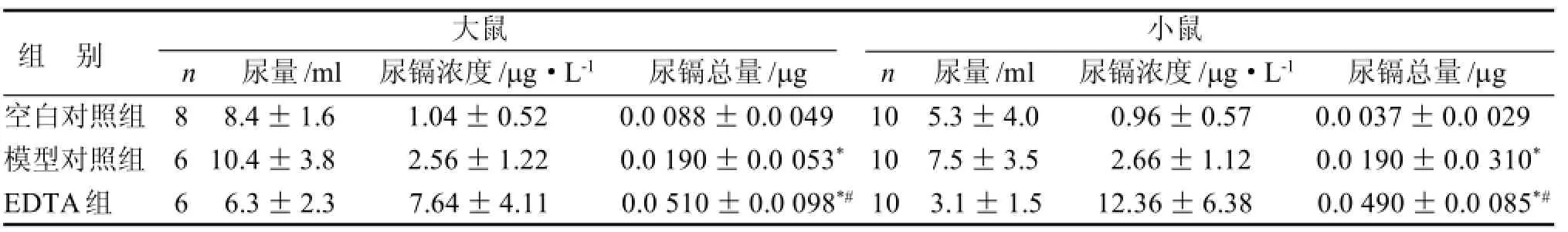
表3 EDTA治疗慢性镉中毒大、小鼠的尿镉变化
2.5大、小鼠肾脏和睾丸组织病理学观察
EDTA治疗SD大鼠3周后,模型对照组33% (2/6)的动物肾脏组出现肾小管内蛋白沉积; 模型对照组和EDTA组个别动物出现睾丸弥漫性曲细精管萎缩(图3)。EDTA治疗NIH小鼠4周后, EDTA组30% (3/10)的动物出现肾脏病理改变, 包括肾小管扩张、肾小管扩张伴管型和肾小管上皮细胞肥大(图4)。
3 讨论
现有研究表明,镉进入体内后,首先蓄积于肝脏,并诱导肝细胞合成金属硫蛋白,并与之结合生成Cd金属硫蛋白复合物(Cd-MT),再经血液循环运送到肾脏,经肾小球滤过后被肾小管细胞重吸收。进入肾小管细胞内的镉不能被排出,随着时间的延长肾镉含量不断升高,导致细胞功能和器质性改变[4,14]。因此,肾脏为慢性镉中毒的靶器官,治疗慢性镉中毒的关键是驱除肾脏细胞内的镉。
本研究采用EDTA腹腔注射治疗慢性镉中毒大鼠模型3周和慢性镉中毒小鼠模型4周后,结果显示; EDTA组实验动物肾脏Cd含量显著高于模型对照; 随着治疗时间的延长肾脏镉蓄积增加,从而导致大量的肾脏实质性病理改变。说明EDTA不能用于驱镉治疗,这与以往文献报道相一致[7,15]。另外, EDTA组的动物尿Cd含量高于模型对照,也高于治疗前水平,说明EDTA增加镉从尿中排出,这正是目前认为可以用EDTA来驱镉的原因。但从用药后的动物体质量看,EDTA有较强的毒副作用,高剂量治疗一周后体质量即显著下降,因此在慢性镉中毒时,不应采用EDTA治疗。
国内外关于EDTA治疗镉中毒的研究均有报道,小剂量的EDTA对慢性镉中毒患者驱镉疗效确切,但对肾脏重吸收功能有一定的影响; EDTA用于临床镉中毒治疗时亦能促使患者尿镉升高,但随后患者肾功能下降,但其机制尚不清楚[7,16]。本课题组认为EDTA驱镉及其毒副作用的机制可能为,因其为大分子络合物,不能进入肾脏及肝脏细胞与胞内Cd2+结合将其带出,但可以螯合血液中的部分Cd并从尿液排出,同时会不断促使血液中部分Cd向肝脏和肾脏转移,从而致使肝脏和肾脏内镉含量上升加重机体损害。另外,睾丸组织是镉暴露的特异敏感性靶器官。镉能引起睾丸变性,生精小管的损害,从而影响大鼠生殖能力[17]。本研究结果表明模型组和EDTA组有的动物睾丸曲精小管萎缩,说明EDTA对镉的睾丸毒性也无保护作用。综上所述,EDTA用于驱镉时,会促使血液中的Cd2+向肝脏、肾脏等脏器转移对机体无保护作用,加之本身具有一定的毒副作用,在慢性镉中毒时,不应采用EDTA治疗。
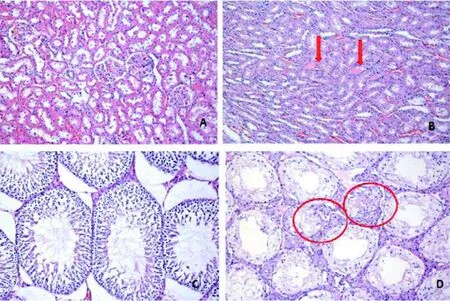
图3 EDTA对慢性镉中毒大鼠肾脏和睾丸病理改变(HE ×200)

图4 EDTA对慢性镉中毒小鼠肾脏病理改变(HE ×200)
[1]环境保护部, 国土资源部. 全国土壤污染状况调查公报[R]. 2014-04-17.
[2]乔实. 镉毒猛于虎-我国镉污染损害人体健康初探 [M]. 北京: 华夏出版社, 2013.
[3]Nawrot TS, Staessen JA, Roels HA. Cadmium exposure in the population: from health risks to strategies of prevention[J]. Biometals, 2010, 23(5):769-782.
[4]Sabath E, Robles-Osorio ML Renal health and the environment: heavy metal nephrotoxicity[J]. Nefrologia, 2012, 32(3):279-286.
[5]王任群, 赵肃, 邱玉鹏, 等. 镉污染区居民肾功能损害的研究[J]. 环境与健康杂志, 2006, 5( 23):202-204.
[6]李光先, 余日安. 镉毒性作用干预方法及其机制研究进展[J]. 中国职业医学, 2014, 41(2):222-226.
[7]陈志强, 梁启荣. 依地酸二钠钙的驱镉效果及对肾脏功能的影响[J]. 医学文选, 2005, 4(3):339-340.
[8]孙贵范. 职业卫生与职业医学[M]. 北京: 人民卫生出版社,2012.
[9]Flora SJ, Mittal M, Mehta A. Heavy metal induced oxidative stress & it’s possible reversal by chelation therapy [J]. Indian J Med Res, 2008, 128(4):501-523.
[10] 蔡婷峰, 董明, 高洪彬, 等. 镉致大鼠慢性肾损伤模型的探讨[J]. 中国职业医学, 2010, 37(3):194-198.
[11] 李颖超, 武昕, 严家荣, 等. 亚慢性镉中毒肾功能性损伤小鼠模型的研究[J]. 山西医科大学学报, 2013, 44(4):267-270.
[12] 中华人民共和国卫生行业标准. WS/T34-1996. 血中镉的石墨炉原子吸收光谱测定方法[S].
[13] 中华人民共和国卫生行业标准. WS/T32-1996. 尿中镉的石墨炉原子吸收光谱测定方法[S].
[14] Nordberg GF. Historical perspectives on cadmium toxicology [J]. Toxicol Appl Pharmacol, 2009, 238(3):192-200.
[15] Crinnion WJ. EDTA redistribution of lead and cadmium into the soft tissues in a human with a high lead burden-should DMSA always be used to follow EDTA in such cases[J]. Altern Med Rev, 2011, 16(2):109-112.
[16] Gil HW, Kang EJ, Lee KH, et al. Effect of glutathione on the cadmium chelation of EDTA in a patient with cadmium intoxication[J]. Hum Exp Toxicol, 2011, 30(1):79-83.
Nephrotoxicity of EDTA Utilized to Treat Chronic Cadmium Poisoning in Rats and Mice
LI Guang-xian1,2, ZHONG Zhi-yong2, CHEN Jia-xing1,2, YU Ri-an1,TANG Xiao-jiang2
(1. School of Public Health, Guangdong Pharmaceutical University, Guangzhou 510310, China;2. Guangdong Medical Laboratory Animal Center, Nanhai 528248, China)
ObjectiveTo investigate the side effects of (EDTA) utilized to treat chronic Cadmium poisoning in animals. MethodsMale SD rats and NIH mice were randomly divided to the control group and model group respectively. The model group animals were daily given CdCl2+ 2-Mercaptoethanol (ME, ip) for 5 days. 50 days or 30 days later, the rats or mice were randomly divided into model control group and EDTA treatment group respectively. The control group and model control group were injected with saline, and the EDTA group animals were treated with EDTA solution .At the end of the experiment,theurine, blood, kidneys and testis were collected for detecting the Cd concentration and pathologic changes. ResultsCompared with the model control group, in the EDTA treated groups (both in rats and mice), the Cd levels of kidney, urine and blood all increased significantly (P<0.05); protein precipitation could be detected in kidney tubules. ConclusionThe EDTA could promote the accumulation of cadmium in the kidney. EDTAis not recommended to treatchronic cadmium poisoning patients.
Chronic cadmium poisoning; EDTA; Nephrotoxicity
Q95-33
A
1674-5817(2015)01-0056-05
10.3969/j.issn.1674-5817.2015.01.012
2014-07-17
广东省重大科技专项(2012A080201011),佛山市院市合作项目(2012A04)
李光先(1987-), 女, 硕士研究生, 主要研究方向: 环境与职业毒理学, E-mail: lig_xian@163.com
唐小江, 博士、主任医师,E-mail: river-t@126.com
