抗坏血酸对Fe2+/H2O2体系氧化NO的促进作用
2015-10-13赵海谦高继慧周伟王忠华吴少华
赵海谦,高继慧,周伟,王忠华,吴少华
抗坏血酸对Fe2+/H2O2体系氧化NO的促进作用
赵海谦1,2,高继慧1,周伟1,王忠华2,吴少华1
(1哈尔滨工业大学能源科学与工程学院,黑龙江哈尔滨150001;2东北石油大学土木建筑工程学院,黑龙江大庆 163318)
采用实验方法研究了低成本环境友好型添加剂抗坏血酸(AA)对Fe2+/H2O2体系氧化NO气体及其对体系内H2O2分解的影响,分析了AA对体系氧化NO能力及H2O2分解的影响机制。研究结果表明:AA通过加速Fe3+向Fe2+的转化而促进Fe2+/H2O2体系对NO的氧化。[AA]0:[Fe2+]0对体系氧化NO的能力及H2O2的分解具有重要影响。综合考虑NO氧化脱除量及H2O2消耗量,合理的[AA]0:[Fe2+]0为1/3~1/2。AA的分次添加方式可大幅度提升体系氧化NO气体的能力。研究结果可望为发展基于H2O2为氧化剂的烟气NO绿色氧化技术提供理论基础。
Fe2+/H2O2体系;抗坏血酸;羟基自由基;氧化;一氧化氮
引 言
在LNB技术基础上,实现脱硫装置的硫氮协同脱除,是符合我国国情的经济深度脱氮方式。实现硫氮协同控制的主要瓶颈是烟气中NO难以被脱硫剂吸收,将NO高效快速氧化为易被吸收的高价N化合物是实现烟气硫氮协同脱除的关键。一些研究单位对KMnO4、NaClO2、NaClO等强氧化剂氧化NO进行了研究[1-6]。然而这些强氧化剂氧化NO的同时会在溶液体系内产生大量杂质(如MnO2、、等),严重影响系统的安全稳定运行,且不利于产物的回收处理。H2O2氧化能力强,无其他杂质产物生成,能很好地克服前述氧化剂的缺点,而被应用到烟气中NO的氧化[7-13]。H2O2对NO的氧化能力主要来自于其分解过程中产生的强氧化性自由基[10,14]。Fe2+/H2O2体系是高级氧化技术最常用的提供强氧化性的方式。
Fe2+/H2O2体系反应过程中不断产生和,这两种自由基均存在与NO的反应。近年,出现了Fe2+/H2O2氧化烟气中NO的研究[15-18]。Guo等[15]采用鼓泡反应器研究了Fenton体系对NO的氧化作用。范春贞等[16]对类Fenton体系氧化NO机理及影响因素进行了探究。Zhao等[17]研究了Fenton体系对NO及SO2的联合脱除效果。研究普遍认为H2O2及Fe2+初始浓度、溶液温度、初始pH等参数对体系氧化NO的能力有重要影响。然而以上研究均未对H2O2利用率问题进行深入研究,而H2O2利用率低是Fe2+/H2O2体系面临的主要问题之一。作者针对Fe2+/H2O2体系氧化NO气体的活性物质开展了研究,并确定了和是体系氧化NO气体的活性物质,但的氧化作用更显著。控制H2O2向着生成的方向反应,是提高系统氧化能力及提高H2O2利用率的关键。
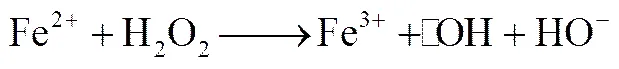
(2)
(3)

Chen等[18]研究发现向Fe2+/H2O2体系添加NH2OH可以大大提高体系的氧化能力。原因是NH2OH大幅度加速了Fe3+向Fe2+的还原[式(5)与式(6)],使体系内Fe2+浓度增加,Fe3+浓度减小,式(1)得到强化而生成更多。该方法证实Fe3+向Fe2+的快速转化是控制H2O2定向生成的有效手段。然而,NH2OH价格较高,且本身具有一定毒性和腐蚀性,有必要探索一种经济且环境友好的还原性添加剂,以提高Fe2+/H2O2体系的产率及H2O2利 用率。
(5)

抗坏血酸(AA)是一种常用的低成本环境友好型还原剂,同时也是高等灵长类动物的必需营养素。在人体内AA能使难以吸收的三价铁还原为易于吸收的二价铁,从而促进铁的吸收。在生物学及医学领域AA亦具有广泛的应用。Stephen[19]通过向含有Cu2+及H2O2的体系内添加AA的方法获得,研究细胞壁对的敏感性。AA首先将Cu2+还原为Cu+[式(7)],Cu+进一步与H2O2反应生成[式(8)]。
(7)

李银等[20]借助Fe3+/H2O2/AA体系提供,分析了对肌原纤维蛋白中敏感氨基酸的氧化效应,实验中AA与Fe3+的初始浓度比为10。研究认为AA可以将Fe3+还原为Fe2+,进一步与H2O2反应生成。Fe2+/H2O2体系反应过程中生成大量Fe3+,一方面会产生铁泥絮凝,影响系统的运行稳定性;另一方面会降低Fe2+浓度及生成速率,影响系统的氧化能力。理论上,向Fe2+/H2O2体系内添加AA可有效解决以上两方面问题。与NH2OH相比,AA具有价格低廉、无毒副作用等优势。然而,通过添加AA提高Fe2+/H2O2体系降解污染物能力方面鲜有报道。本文以NO的氧化为技术背景,考察了环境友好型添加剂AA对Fe2+/H2O2体系氧化低浓度NO气体的促进作用,探究了AA对体系氧化能力及H2O2分解速率的影响,并对相关机制进行了深入分析。本文研究结果可为开发NO绿色氧化技术,提高H2O2高级氧化体系的氧化能力及H2O2利用率提供理论基础。
1 实验部分
1.1 试剂
过氧化氢(30%)、草酸钛钾、七水硫酸亚铁、抗坏血酸(AA)均为国产分析纯。
1.2 分析测试仪器
纯水机,Master-s型,上海和泰;UV-Vis分光光度计,T6型,北京普析通用;滴定仪,ZDJ-5型,上海雷磁;增强型烟气分析仪,VARIO PLUS型,德国MRU;磁力搅拌器,C-MAG HS7,德国IKA。
1.3 实验装置
所有NO气体氧化实验均在气液反应分析实验系统(图1)中进行。系统由双层玻璃反应器、恒温水浴、气体成分分析仪、分光光度计、配气系统、测温系统及气体管路组成。
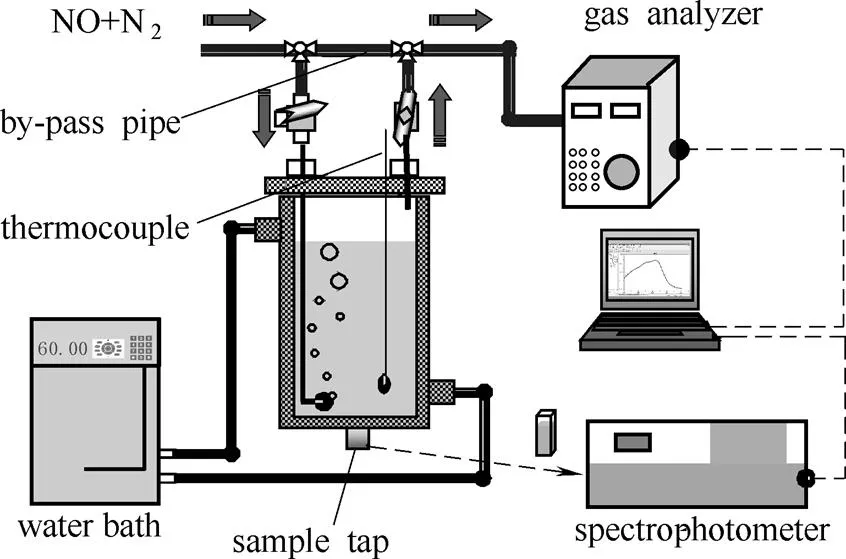
图1 气液反应分析实验系统
1.4 实验方法
研究H2O2/AA溶液对NO气体的氧化作用时,采用60℃去离子水配制浓度为300 mmol·L-1H2O2及10 mmol·L-1AA的混合溶液1000 ml。将配制好的溶液倒入双层玻璃反应器中,通过恒温水浴维持溶液温度60℃不变。反应前,NO(N2作载气)通过旁通管直接进入烟气分析仪,检测NO浓度直至其保持不变,该浓度即为NO的初始浓度。然后将NO气体切入反应器管路,气体以鼓泡方式进入反应器底部,开始与该溶液体系反应,末端通过烟气分析仪记录NO浓度变化。
进行Fe2+/H2O2/AA体系对NO气体的氧化作用实验时,采用60℃去离子水配制浓度为306 mmol·L-1的H2O2溶液980 ml,缓慢滴加稀盐酸(100 mmol·L-1)调节溶液pH4.0。将配制好的H2O2溶液倒入双层玻璃反应器中,并维持溶液温度60℃不变。采用60℃去离子水配制一定浓度的FeSO4/AA混合溶液20 ml待用。记录NO气体初始浓度后,将NO气体通入反应器底部并持续吹扫一段时间,直至NO浓度保持不变。通过注射器将预先配制的FeSO4/AA混合溶液注入H2O2溶液中,开始反应。此时溶液体系总体积为1000 ml,H2O2浓度约为300 mmol·L-1。末端通过烟气分析仪记录NO浓度变化。
实验过程中气体流量为1.5 L·min-1。为避免溶液中残留O2影响测试结果,配液用去离子水均充分加热一段时间,再进行配液。溶液加入反应器后,先经过N2+NO充分吹扫,直至系统中检测不到残留O2气体。H2O2浓度采用钛盐光度法进行检测[21-22]。
2 结果与讨论
2.1 H2O2/AA体系对NO的氧化吸收作用
为辅助说明AA对Fe2+/H2O2体系Fe3+与Fe2+之间的转化的影响是体系氧化NO能力提升的主要原因,本次研究首先进行了未发生快速分解时,H2O2/AA体系直接氧化吸收NO的空白实验。实验条件:H2O2溶液初始浓度为300 mmol·L-1,AA初始浓度为5 mmol·L-1,溶液温度为60℃。图2显示的是H2O2/AA体系氧化吸收NO实验结果。从图中很容易看到,当NO气体通入H2O2/AA溶液体系后浓度变化与通入去离子水时的浓度变化非常接近,因此,本实验条件下H2O2/AA体系直接氧化NO气体的能力较弱,H2O2/AA溶液对NO的氧化吸收作用与去离子水的作用相当。该结果表明,AA引起的Fe2+/H2O2体系对NO气体氧化能力的变化一定与Fe2+有关。

图2 H2O2/AA体系对NO的氧化吸收作用
2.2 AA对Fe2+/H2O2体系氧化NO的促进作用
为考察AA对Fe2+/H2O2体系氧化NO的促进作用,在此将Fe2+/H2O2体系及Fe2+/H2O2/AA体系氧化NO的实验结果进行了对比。实验条件:[H2O2]0300 mmol·L-1,[FeSO4]05 mmol·L-1,[AA]05 mmol·L-1,溶液温度为60℃。AA对Fe2+/H2O2体系氧化NO的促进作用结果如图3所示。
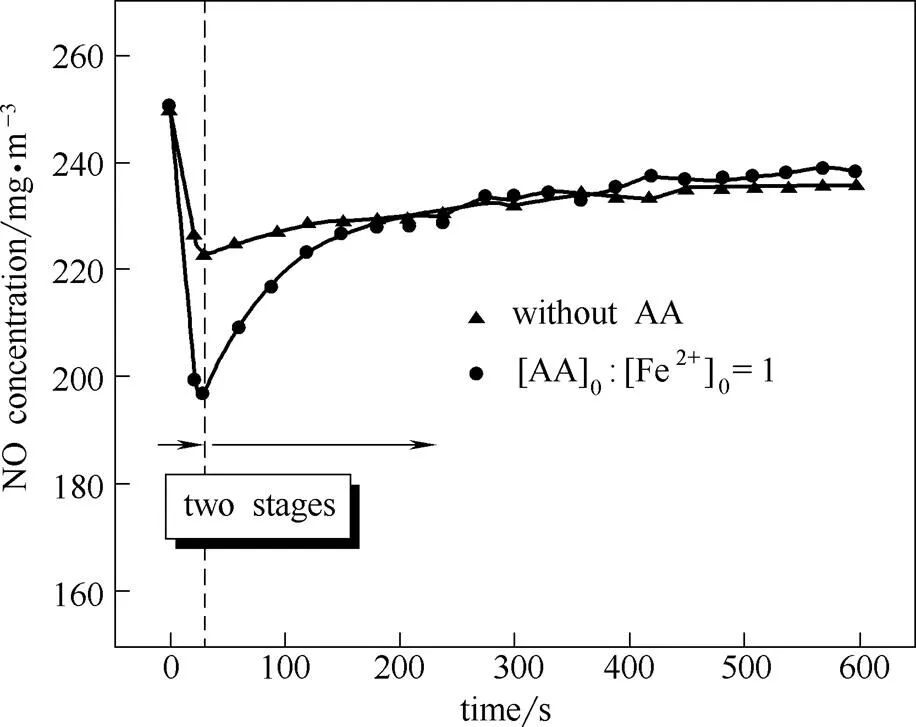
图3 AA对Fe2+/H2O2体系氧化NO的促进作用
由图3可知, Fe2+/H2O2体系氧化NO气体存在两个阶段:短暂的初始加速阶段和缓慢的减速阶段。在初始阶段,NO浓度迅速降低,至30 s左右达到最低值,随后进入缓慢减速阶段。当体系内添加AA后,Fe2+/H2O2/AA体系氧化NO气体同样存在初始阶段和缓慢减速阶段两个阶段。在初始阶段,NO浓度明显低于Fe2+/H2O2体系,NO最低浓度较Fe2+/H2O2体系低得多。在减速阶段,Fe2+/H2O2/AA体系氧化NO时NO浓度上升趋势也比Fe2+/H2O2体系明显。反应后期两个体系氧化NO能力相当。总体而言,添加AA后,体系对NO的氧化能力有所提升,尤其在反应初期,AA的促进效果非常明显。
Fe2+/H2O2体系氧化NO属于典型的气液反应过程。喷淋和鼓泡是该类反应过程最常见的气液接触方式。在喷淋反应器和鼓泡反应器内,气液接触时间均较短(一般为几秒)。考虑现实情况,AA在初始阶段的促进作用尤为重要。由于AA在反应初期对体系氧化NO的促进效果非常明显,因此,向Fe2+/H2O2体系内添加AA促进体系氧化NO气体具有现实意义。
未添加AA时,Fe2+/H2O2体系氧化NO的反应机理如下[8,12,14]
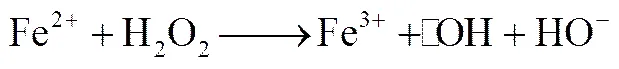
76 L·mol-1·s-1(1)

2.7×107L·mol-1·s-1(9)
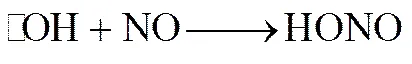
2.0×1010L·mol-1·s-1(3)
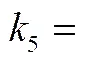
2.1节已经证明H2O2/AA体系对NO无氧化作用,向Fe2+/H2O2体系添加AA后,体系对NO的氧化能力提升一定与Fe2+及Fe3+的价态转化有关系。已有文献表明AA可以大大加速Fe3+向Fe2+的转化[式(10)][20,23],使得Fe2+/H2O2/AA体系内Fe2+浓度远高于Fe2+/H2O2体系。从而大大强化式(1)的进行,体系生成速率大幅度提高,体系氧化能力大大增强。
(10)
2.3 AA添加量对体系氧化NO的影响
为进一步掌握AA在Fe2+/H2O2/AA体系氧化NO过程中的作用,本实验进一步探究了AA添加量对体系氧化NO的影响。本文采用AA与Fe2+的初始摩尔比[AA]0:[Fe2+]0来反映AA添加量。实验条件:[H2O2]0300 mmol·L-1,[FeSO4]05 mmol·L-1,[AA]0:[Fe2+]00~10,溶液温度为 60℃。AA添加量对体系氧化NO的影响实验结果如图4所示。

图4 AA添加量对体系氧化NO的影响
从图中可以看到,AA添加量对体系的氧化能力有重要影响,无论AA添加量多少,NO浓度变化均存在短暂的初始加速阶段和缓慢的减速阶段。体系对NO气体的氧化能力并不是随着AA添加量的增加而单调增加。本实验条件下,当[AA]0:[Fe2+]0<1/2时,体系对NO气体的氧化能力随AA添加量的增加而增强;[AA]0:[Fe2+]0>1/2时,体系对NO气体的氧化能力随AA添加量的增加而减弱。可以分析得到:AA对Fe2+/H2O2/AA体系氧化NO具有双重作用。一方面,AA可以加速Fe3+向Fe2+的还原,通过强化反应(1)而提高体系生成速率与生成量,促进体系对NO的氧化;另一方面,AA本身存在与的直接反应[式(11)][24],当体系内存在高浓度AA时,则会导致生成的部分通过与AA的反应而快速消耗,反而降低了体系对NO气体的氧化能力。

78.2×109L·mol-1·s-1(11)
从以上分析知,合理的[AA]0:[Fe2+]0对提高Fe2+/H2O2/AA体系氧化NO具有重要影响。在本实验中,[AA]0:[Fe2+]01/2时,体系氧化NO能力最强。然而,这并不意味着[AA]0:[Fe2+]01/2是最佳的[AA]0:[Fe2+]0摩尔比。合理的[AA]0:[Fe2+]0需综合考察NO氧化过程中H2O2的消耗情况进行确定。
2.4 AA对体系内H2O2分解速率的影响
通过2.2节研究已知,AA可以加速Fe3+向Fe2+的还原,使体系内Fe2+浓度增加,强化了反应式(1),削弱了反应式(2),从而提高体系的生成速率。由于反应式(1)的速率常数远大于反应式(2),AA在加速生成速率的同时必定会对H2O2消耗速率产生重要影响。另外,Fe2+/H2O2体系的反应速率受pH影响很大,公认的Fe2+/H2O2体系最佳反应pH范围为2~4[25-26]。AA水溶液本身呈酸性,Fe2+/H2O2体系内添加的AA会降低体系pH而影响H2O2反应速率。本节实验研究了AA对体系内H2O2分解速率及pH值的影响规律。实验条件:[H2O2]0300 mmol·L-1,[FeSO4]05 mmol·L-1,[AA]0:[Fe2+]00~10,溶液温度为60℃,pH04.0。AA对体系内H2O2分解速率的影响实验结果如图5所示,AA对体系pH值的影响如图6所示。
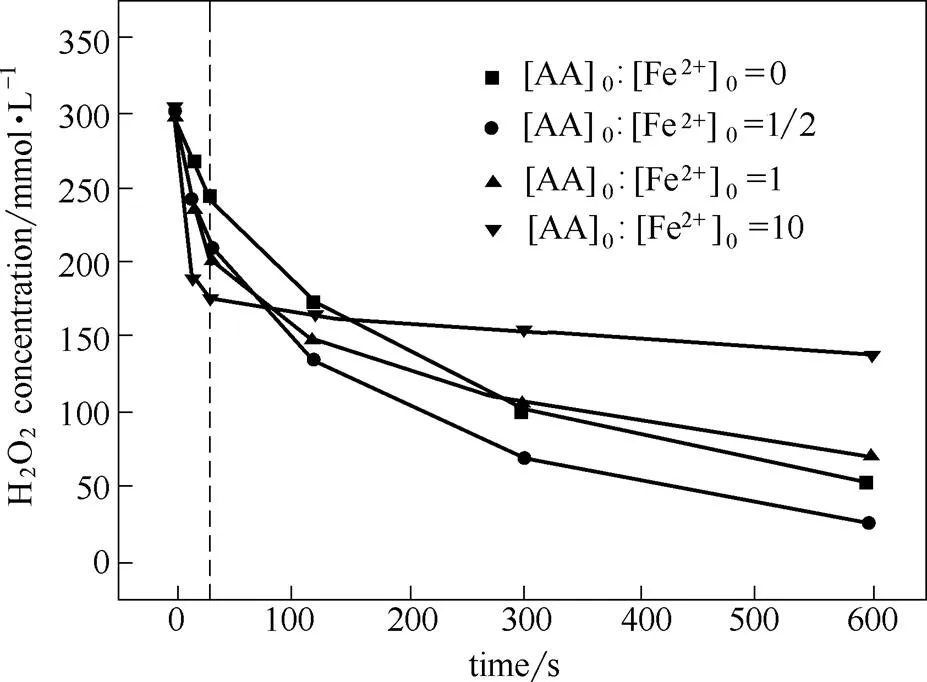
图5 AA对体系H2O2分解的影响
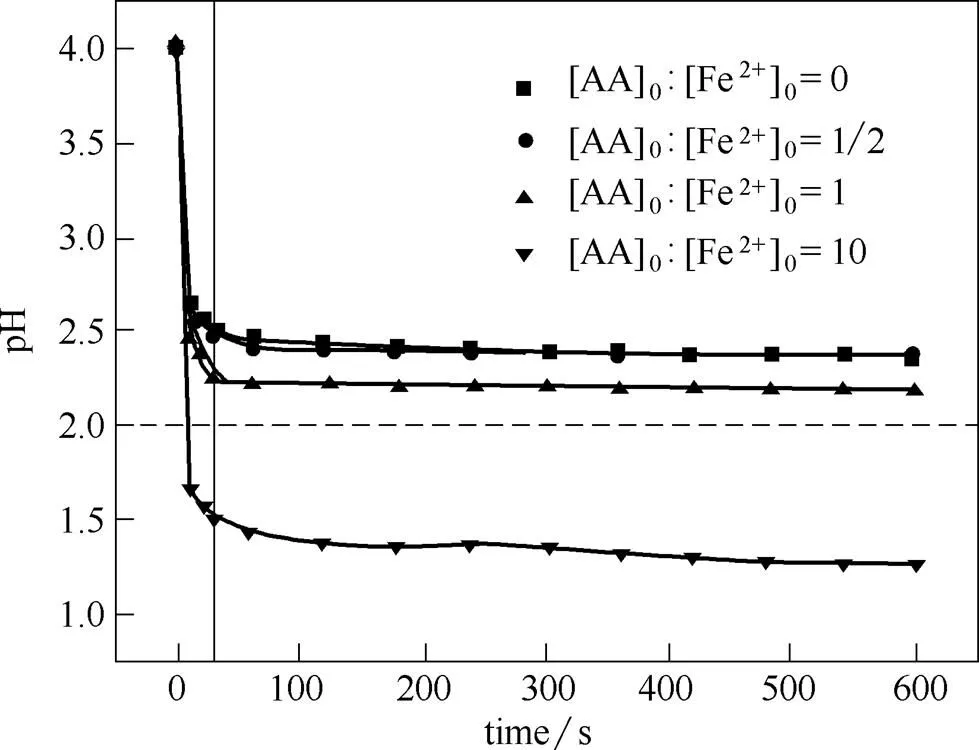
图6 AA对体系pH的影响
由图5可知,AA对体系内H2O2分解速率影响很大。添加AA后,初始阶段的H2O2分解速率明显比未添加AA时快,且AA添加量越大,初始阶段H2O2分解速率越大。这是因为添加AA后,体系内Fe2+浓度增加,而Fe3+浓度降低。因此,反应式(1)得到强化,反应式(2)则被削弱,更多的H2O2通过反应速率更快的而消耗(12)。AA添加量越大,该作用效果越明显。故添加AA后,反应初期H2O2分解速率明显加快,且H2O2分解速率随AA添加量的增加而提高。然而,初始阶段之后,不同AA添加量条件下的H2O2分解速率变化趋势有着较大差异,发现H2O2分解速率的变化与体系pH的变化存在明显的协同。当[AA]0:[Fe2+]010时,由于初始pH较高(pH04),H2O2在初始阶段保持较快的分解速率。然而体系pH随大量AA的溶解与混合而迅速下降并保持在1.4左右。在此pH条件下(pH<2),Fe3+向Fe2+的还原被严重抑制,H2O2分解速率大幅度下降[25-26]。因此,初始阶段过后H2O2分解速率很慢。当[AA]0:[Fe2+]01/2时,Fe2+/H2O2/AA体系整个反应过程的pH与Fe2+/H2O2体系基本一致。因此,在初始阶段AA加速了H2O2分解,随AA的消耗,后续H2O2的浓度变化趋势与不添加AA的情况基本一致。当[AA]0:[Fe2+]01时,H2O2浓度变化趋势介于[AA]0:[Fe2+]01/2与[AA]0:[Fe2+]010两种情况之间。
2.5 合理[AA]0:[Fe2+]0的确定
在以上研究结果基础上,对合理的[AA]0:[Fe2+]0摩尔比进行了探讨。将NO的氧化脱除量记为,H2O2的消耗量记为,通过不同[AA]0:[Fe2+]0条件下,/的大小来确定合理的[AA]0:[Fe2+]0。Fe2+/H2O2体系氧化NO属于气液反应过程,典型气液反应器内气液接触时间均较短。对比整个实验时间范围内(10 min)的/没有实际意义。本研究分别对[AA]0: [Fe2+]0为0、1/5、1/3、1/2、2/3、1、2及10八种工况反应初期30 s内的/进行了测试与计算,计算结果见表1。
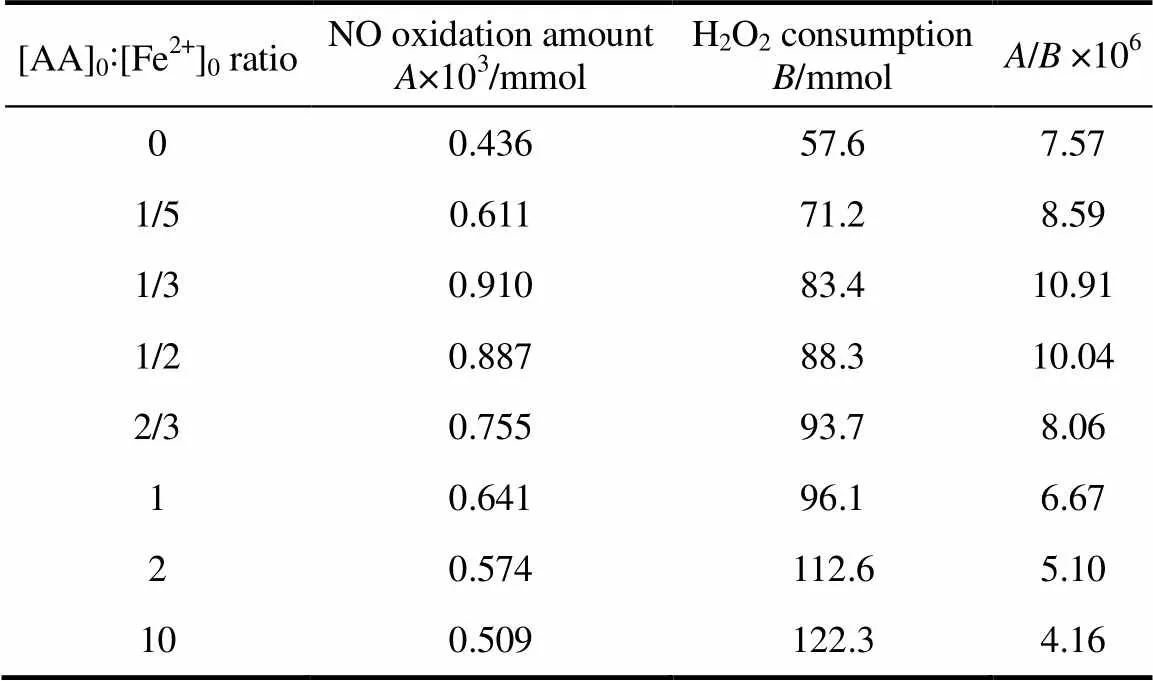
表1 30s内NO氧化脱除量与H2O2消耗量
由表1可知,当[AA]0:[Fe2+]0介于1/3~1/2范围内,/的值较大,其中/的最大值出现在[AA]0:[Fe2+]01/3时。因此,认为合理的[AA]0:[Fe2+]0摩尔比为1/3~1/2。在此范围之外,/分别随[AA]0:[Fe2+]0的减少([AA]0:[Fe2+]0<1/3情况)或[AA]0:[Fe2+]0的增加([AA]0:[Fe2+]0>1/2情况)而不断降低。该结论与2.3节及2.4节中的研究结果相吻合。从图4及图5的实验结果很容易看到,在[AA]0:[Fe2+]0为1/5、1/2、1、10四种条件下,[AA]0:[Fe2+]01/2时反应初始阶段NO浓度降低幅度最大,而H2O2消耗量虽比不添加AA情况大,但比[AA]0:[Fe2+]010时的H2O2消耗量低得多。
另外,从表1中与的数值大小可知,本次实验过程中,NO氧化脱除量远远低于H2O2的消耗量。这是由于受MRU烟气分析仪气量及实验系统密闭性所限,NO+N2总气量为1.5 L·min-1,因此通入反应器中的NO物质的量远远低于反应器中加入的H2O2物质的量。加之气液接触面积有限,绝大多数H2O2分解产生的自由基未参与NO气体的氧化而无效泯灭。加大NO+N2总气量,同时通过扰动等手段增加气液接触面积可有效提高/。然而,本研究的主要目的是探究AA对Fe2+/H2O2体系氧化NO及H2O2分解的影响规律,NO氧化脱除效率的高低对该规律的分析并无影响。
2.6 AA添加方式的改进
上述研究表明,当[AA]0:[Fe2+]01/3~1/2时,反应初始阶段NO氧化脱除量较大,且H2O2消耗量不高。然而,由于AA添加量小,随着AA的不断消耗,促进效果不断减弱。若一次性添加大量AA,则AA消耗·OH的负面作用增大。为充分发挥[AA]0:[Fe2+]0较小时,初始阶段NO氧化脱除量大,且H2O2消耗量不高的优势,同时保证AA长时间发挥作用,提出AA的分次添加方式。实验条件:[H2O2]0300 mmol·L-1,[FeSO4]05 mmol·L-1,AA总添加量达到5 mmol·L-1,分3次添加,添加时间分别为0、200及400 s。图7显示的是分次添加AA时体系氧化NO的实验结果。从图中可以明显得到,采用AA的分次添加方式时,NO氧化脱除效果明显优于一次性添加方式。无论在初始阶段还是缓慢减速阶段,分次添加AA时的NO浓度远低于一次性添加方式。

图7 AA添加方式对NO氧化的影响
本研究分别对10 min反应时间内AA一次性添加及3次添加条件下NO氧化量及H2O2消耗量进行了计算与对比,结果见表2。可见,AA分3次添加的NO氧化量是一次性添加的2倍多,而H2O2消耗量仅上升不到23%,H2O2利用率大幅度提升。

表2 不同AA添加方式时NO氧化脱除量与H2O2消耗量
由于本次研究未对H2O2的量进行补充,因此,随着反应时间进行,H2O2浓度不断降低,NO氧化脱除速率不断下降。若持续补充适量H2O2与AA,整个反应过程必然获得理想的氧化脱除效果。后续研究将重点对H2O2及AA添加方式对NO氧化的影响进行深入探究。
本文首次采用添加环境友好型添加剂AA来提高Fe2+/H2O2体系对NO气体的氧化能力。分析了AA对体系氧化NO及H2O2分解速率的影响规律与相关机理。研究发现,[AA]0:[Fe2+]0较小时,初始阶段NO氧化脱除量大,且H2O2消耗量不高。在此基础上,本文发现分次添加适量的AA可大幅度提高体系对NO气体的氧化能力。本文可为发展新型高效烟气NO氧化技术提供技术基础,研究结果可望为解决Fe2+/H2O2体系利用过程中H2O2利用率低,Fe3+产物沉积等问题提供理论依据。
3 结 论
本文采用实验方法研究了低成本环境友好型添加剂AA对Fe2+/H2O2体系氧化NO气体的促进作用。得到如下结论。
(1)AA通过加速Fe3+向Fe2+的转化,提高体系生成速率及体系对NO的氧化能力。
(2)Fe2+/H2O2/AA体系氧化NO存在短暂的初始阶段和缓慢的减速阶段。[AA]0:[Fe2+]0摩尔比对体系氧化NO气体能力的提升有重要影响。
(3)添加AA后,体系初始阶段H2O2分解速率加快。AA添加量越大,初始阶段H2O2分解速率越快,但减速阶段分解速率越慢。H2O2分解速率与体系pH存在协同。
(4)同时考虑NO氧化脱除量及H2O2消耗量,最佳[AA]0:[Fe2+]0范围为1/3~1/2。
(5)采用AA的分次添加方式时,NO氧化脱除效果明显优于一次性添加方式。
References
[1] Brogren C, Karlsson H T, Bjerle I. Absorption of NO in an alkaline solution of KMnO4[J]., 1997, 20: 396-402.
[2] Chu H, Chien T W, Li S Y. Simultaneous absorption of SO2and NO from flue gas with KMnO4/NaOH solutions [J]., 2001, 275 (1/3): 127-135.
[3] Brogren C, Karlsson H T, Bjerle I. Absorption of NO in an aqueous solution of NaClO2[J]., 1998, 21 (1): 61-70.
[4] Deshwal B R, Lee S H, Jung J H, Shon B H, Lee H K. Study on the removal of NOfrom simulated flue gas using acidic NaClO2solution [J]., 2008, 20 (1): 33-38.
[5] Guo R T, Pan W G, Zhang X B, Xu H J, Jin Q, Ding C G, Guo S Y. The absorption kinetics of NO into weakly acidic NaClO solution [J]., 2013, 48 (18): 2871-2875.
[6] Mondal M K, Chelluboyana V R. New experimental results of combined SO2and NO removal from simulated gas stream by NaClO as low-cost absorbent [J]., 2013, 217: 48-53.
[7] Liu Yangxian (刘杨先), Pan Jianfeng (潘剑锋), Liu Yong (刘勇). Mass transfer-reaction kinetics for NO removal by process of UV/H2O2oxidation and CaO absorption [J].(化工学报), 2013, 64 (3): 1062-1068.
[8] Cooper C D, Clausen Ⅲ C A, Pettey L, Collins M, Pozo de Fernandez M. Investigation of ultraviolet light-enhanced H2O2oxidation of NOemissions [J]., 2002, 128 (1): 68-72.
[9] Kim H H, Tsunoda K, Katsura S. A novel plasma reactor for NO control using photocatalyst and hydrogen peroxide injection [J]., 1999, 35 (6): 1306-1310.
[10] Collins M M, Cooper C D, Dietz J D, Clausen Ⅲ C A, Tazi L M. Pilot-scale evaluation of H2O2injection to control NOemissions [J]., 2001, 127 (4): 329-336.
[11] Han Fennü (韩粉女), Zhong Qin (钟秦). Experimental study on simultaneous removal of SO2and NO by H2O2solution [J].(环境工程学报), 2011, 5 (12): 2830-2834.
[12] Limvoranusorn P, Cooper C D, Dietz J D, Clausen C A, Pettey L, Collins M M . Kinetic modeling of the gas-phase oxidation of nitric oxide using hydrogen peroxide [J]., 2005, 131 (4): 518-525.
[13] Liu Yangxian (刘杨先), Zhang Jun (张军), Wang Zhuliang (王助良). Simultaneous desulfurization and denitrification by using combination of UV/H2O2oxidation with Ca(OH)2absorption [J].(化工学报), 2012, 63 (10): 3277-3283.
[14] Walling C. Fenton's reagent revisited [J]., 1975, 8 (4): 125-131.
[15] Guo R T, Pan W G, Zhang X B, Ren J X, Jin Q, Xu H J, Wu J. Removal of NO by using Fenton reagent solution in a lab-scale bubbling reactor [J]., 2011, 90 (11): 3295-3298.
[16] Fan Chunzhen (范春贞), Li Caiting (李彩亭), Lu Pei (路培), Zhang Xing (张星), Zhao Weiwei (赵伟伟), Tao Shasha (陶沙沙). Experimental research of purification NO-containing gas by aqueous oxidation with Fenton-like agent [J].(中国环境科学), 2012, 32 (6): 988-993.
[17] Zhao Y, Wen X, Guo T, Zhou J. Desulfurization and denitrogenation from flue gas using Fenton reagent [J]., 2014, 128: 54-60.
[18] Chen L W, Ma J, Li X C, Zhang J, Fang J Y, Guan Y H, Xie P C. Strong enhancement on Fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles [J].,2011, 45 (9): 3925-3930.
[19] Fry S C. Oxidative scission of plant cell wall polysaccharides by ascorbate-induced hydroxyl radicals [J]., 1998, 332 (2): 507-515.
[20] Li Yin (李银), Zhang Chunhui (张春晖), Li Xia (李侠), Sun Hongmei (孙红梅), Dong Xianbing (董宪兵), Xie Xiaolei (谢小雷), Wang Chunqing (王春青). Analysis of oxidation effect of ·OH on sensitive amino acids in myofibrillar protein [J].(分析测试学报), 2013, 32 (9): 1038-1043.
[21] Jiang Chengchun (姜成春), Pang Suyan (庞素艳), Ma Jun (马军), Xie Weiping (谢炜平), Zou Yuan (邹原). Spectrophotometric determination of hydrogen peroxide in Fenton reaction with titanium oxalate [J].(中国给水排水), 2006, 22 (4): 88-91.
[22] Sun Chu (孙楚),Li Shaofeng (李绍峰),Craig Williams, Tao Huchun (陶虎春). Spectrophotometric determination of hydrogen peroxide in O3/H2O2advanced oxidation system with titanium oxalate [J].(化学工程师), 2011, 189 (6): 27-37.
[23] Hsieh Y H P, Hsieh Y P. Kinetics of Fe3+reduction by ascorbic acid in aqueous solutions [J]., 2000, 48 (5): 1569-1573.
[24] Schoeneshoefer M. Pulsradiolytische untersuchung zur oxidation der ascorbinsaeure durch OH-radikale und halogen-radikal-komplexe in waessriger Loesung [J]..., 1972, 27: 649-659.
[25] Kavitha V, Palanivelu K. Destruction of cresols by Fenton oxidation process [J]., 2005, 39 (13): 3062-3072.
[26] Kang S F, Chang C P. Coagulation of textile secondary effluents with Fenton’s reagent [J]., 1997, 36 (12): 215-222.
Promotion of ascorbic acid on oxidation of NO by Fe2+/H2O2system
ZHAO Haiqian1,2, GAO Jihui1, ZHOU Wei1, WANG Zhonghua2, WU Shaohua1
(1College of Energy Science and Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang, China;2Institute of Civil Engineering & Architecture, Northeast Petroleum University, Daqing 163318, Heilongjiang, China)
The influences of ascorbic acid (AA), which is a low cost and eco-friendly additive agent, on NO oxidation and H2O2decomposition in Fe2+/H2O2system were experimentally studied and their reaction mechanisms analyzed. The results demonstrated that AA can improve oxidation of Fe2+/H2O2system for NO through accelerating the reduction from Fe3+to Fe2+. [AA]0:[Fe2+]0ratio has important effect on oxidization ability and H2O2decomposition of the system. Taken together the amounts of NO oxidized and H2O2decomposition, the appropriate ratio of [AA]0:[Fe2+]0should be between 1/3 to 1/2. Batch add of AA can greatly enhance the oxidation ability of Fe2+/H2O2system for NO. These results would be a theoretical basis for the development of NO oxidation technology by H2O2.
Fe2+/H2O2system; ascorbic acid; hydroxyl radical; oxidation; nitric oxide
10.11949/j.issn.0438-1157.20141920
X 511
国家自然科学基金项目(51176043,91434134);黑龙江省青年科学基金项目(QC2014C047)。
2014-12-26.
Prof. GAO Jihui, gaojh@hit.edu.cn
supported by the National Natural Science Foundation of China (51176043, 91434134) and the Heilongjiang Province Science Funds for Youths (QC2014C047).
A
0438—1157(2015)07—2636—07
2014-12-26收到初稿,2015-04-08收到修改稿。
联系人:高继慧。第一作者:赵海谦(1981—),男,博士研究生,讲师。
