伊犁黑蜂蜂胶对口腔主要致龋细菌生物膜作用的实验研究
2015-10-13于倩林静祖力卡尔江阿合买提赵今
于倩 林静 祖力卡尔江·阿合买提 赵今
新疆医科大学第一附属医院牙体牙髓病科·新疆维吾尔自治区口腔医学研究所,乌鲁木齐 830054
龋病是被世界卫生组织列为人类重点防治的非传染性疾病。牙菌斑生物膜与龋病的发生有密切的关系,它是存在于牙面的一个细菌生态环境,细菌在其中生长、发育、衰亡又不断新生,并进行着复杂的物质代谢,在一定条件下,细菌及其代谢产物会对牙齿产生破坏[1]。单纯使用机械的方法并不能完全清除覆盖于牙面的所有菌斑,因此使用药物控制菌斑是必不可少的补充。蜂胶是一种天然的抗菌剂,安全无毒副作用,由于地域、季节和植物的不同,蜂胶的成分具有多样性和差异性[2-3]。本研究采用新疆伊犁黑蜂蜂胶,通过其对口腔常见致龋菌单菌生物膜生长及代谢的影响,探讨伊犁黑蜂蜂胶抗菌防龋的效果及可能的防龋机制。
1 材料和方法
1.1 黑蜂蜂胶醇粗提物的制备
蜂胶采自新疆伊犁尼勒克县种蜂场。将粗蜂胶置于-20 ℃冰箱中过夜后在研钵内粉碎,使用水浴法(m︰v=1︰8)在70 ℃下水浴除蜡,再用冷浸法提纯蜂胶。称取15 g除蜡蜂胶粉碎后按照固液比1︰5的比例,加70%乙醇75 mL(虽然70%的乙醇具有一定的抑菌能力,但是蜂胶醇溶液在梯度稀释过程中乙醇的浓度也被稀释得极低,蜂胶醇溶液中所含乙醇的浓度早已不具备抑菌的能力),封口后浸泡2周。滤去沉渣,蜂胶原重量减去沉渣干燥后的重量,配制成100 mg·mL-1蜂胶醇溶液,用1 mol·L-1NaOH调整pH=7.0后经0.22 μm的无菌滤器过滤备用[4-5]。
1.2 实验试剂和仪器
脑心浸液培养基(brain heart infusion,BHI)、厌氧发生剂、厌氧指示剂(梅里埃公司,法国),无菌脱纤维蛋白羊血(新疆医科大学动物实验中心提供),95%乙醇分析纯(天津富宇精细化工有限公司),氯化血红素(上海源叶生物科技有限公司),蒽酮试剂(天津市福晨化学试剂厂),葡聚糖T-40(北京索莱宝科技有限公司),浓硫酸(北京化工厂)。
垂直流超净工作台(苏州安泰空气技术有限公司),隔水式恒温培养箱(上海博讯实业有限公司),厌氧罐(三菱株式会社,日本),pH计(上海雷磁仪器厂)。
1.3 实验菌株与菌液制备
变异链球菌(Streptococcus mutans ATCC 25175)、表兄链球菌(Streptococcus sobrinus ATCC 6715)、血链球菌(Streptococcus sanguis ATCC 10556)、黏性放线菌(Actinomyces viscosus ATCC 19246)、内氏放线菌(Actinomyces naeslundii ATCC 12104)均购买于美国模式培养物集存库(American Type Culture Collection)。
将冻存菌株接种于BHI血琼脂培养基中,80%N2、20%CO2、37 ℃厌氧培养48 h,观察菌落生长形态。随机取单个菌落涂片镜检无污染,生化鉴定确定纯培养后,再次接于血琼脂培养基,80%N2、20%CO2、37 ℃下厌氧培养48 h后,取形态一致的菌落溶于BHI液体培养基中,采用麦氏比浊法测定细菌悬液浓度至3×106CFU·mL-1备用。
1.4 方法
1.4.1 黑蜂蜂胶对单菌最小生物膜清除浓度(minimum bio fi lm eradication concentration,MBEC)的测定 在96孔板中分别加入菌悬液50 μL和含1%蔗糖的BHI液体培养基150 μL,置于37 ℃下厌氧培养24 h形成生物膜。吸出96孔板中上清液,PBS洗去浮游菌,加入200 μL已梯度稀释后的含药BHI液体培养基,37 ℃下厌氧培养24 h。去上清液,PBS清洗3次以去浮游菌,室温下干燥30 min,每孔加入0.1%结晶紫200 μL振荡培养20 min后吸出,PBS清洗3次,室温下干燥。每孔加入95%乙醇200 μL,振荡培养1 h后将乙醇吸出至另一96孔板中,酶标仪在OD570处读数,MBEC为OD值突然升高前的临界值[6-7]。实验重复3次。
1.4.2 黑蜂蜂胶对单菌生物膜产酸水平影响的测定将24 mm×24 mm无菌盖玻片置于6孔板中,加入菌悬液1 mL和含1%蔗糖的BHI液体培养基5 mL,调定初始pH=7.0,放入厌氧箱中37 ℃下培养24 h形成生物膜。根据各测试菌MBEC的测定结果,选取MBEC值及以下的3个蜂胶粗提物浓度梯度配置成BHI液体培养基,吸出6孔板中BHI液体培养基,分别加入已梯度稀释的含药培养基5 mL,放入厌氧箱中37 ℃下培养24 h。吸出6孔板内培养基放入离心管内离心(8 000 r·min-1,4 ℃下离心30 min),测定离心后的上清测pH值,并计算pH值的变化值(ΔpH值),ΔpH值=初始pH值(7.0)-终末pH值。
1.4.3 黑蜂蜂胶对单菌生物膜合成水不溶性胞外多糖影响的测定 选择主要产糖菌变异链球菌来研究蜂胶对其产水不溶性胞外多糖的影响。生物膜形成同上。根据各测试菌MBEC的测定结果,选取MBEC值及以下的3个蜂胶粗提物浓度梯度配置成含药BHI液体培养基分别加入到6孔板中,置厌氧箱中37 ℃下培养24 h。去上清,PBS冲洗盖玻片3次,用无菌刀片将菌膜轻轻刮至15 mL离心管中,加5 mL蒸馏水洗涤、离心2次(10 000 r·min-1,15 min),水洗后的沉淀加0.4 mol·L-1NaOH 5 mL洗涤、离心2次(10 000 r·min-1,15 min),合并上清作为样本,使用蒽酮法检测水不溶性胞外多糖含量。
1.5 统计学分析
采用SPSS 17.0统计软件对实验数据进行分析,对各组数据先行方差齐性检验,若方差齐选用单因素方差分析LSD法;若方差不齐,先行秩和检验,各组有差异后用单因素方差分析Dunnett法。检验水准α=0.05。
2 结果
2.1 黑蜂蜂胶对单菌生物膜MBEC的测定结果
黑蜂蜂胶对变异链球菌、表兄链球菌、血链球菌、黏性放线菌、内氏放线菌单菌生物膜MBEC的测定结果分别为6.25、1.56、3.13、0.78、0.78 mg·mL-1。结果表明,黑蜂蜂胶对所有测试菌株单菌生物膜均具有不同程度的清除作用。
2.2 黑蜂蜂胶对单菌生物膜产酸水平的影响
黑蜂蜂胶对单菌生物膜产酸水平的影响见表1。在各自MBEC以下4个浓度(包括MBEC浓度)时均可抑制测试菌的产酸,并呈现剂量依赖趋势。各组与对照组间差异具有统计学意义(P<0.05)。
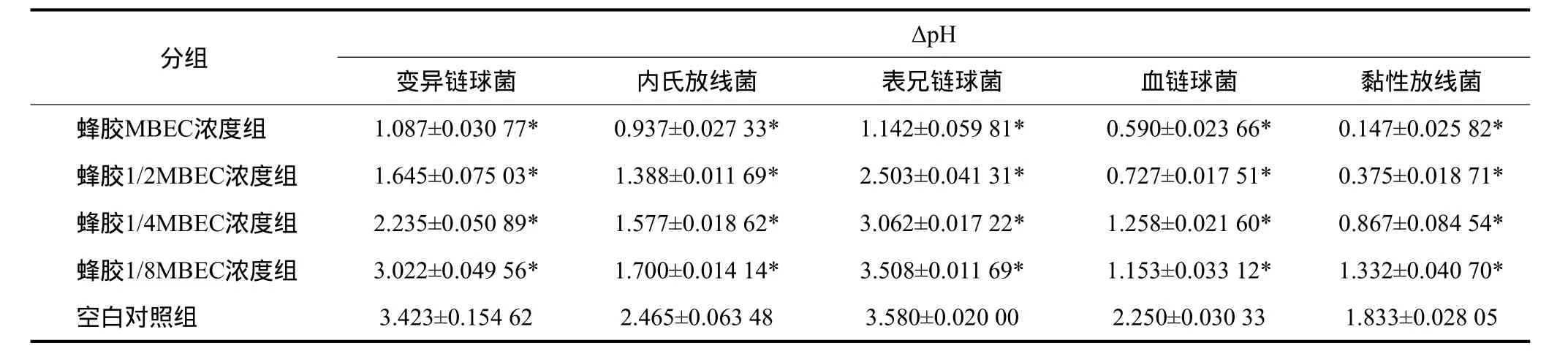
表1 蜂胶对测试菌单菌生物膜ΔpH值的影响Tab 1 ΔpH values of the bio fi lm in different concentration of propolis
2.3 黑蜂蜂胶对变异链球菌单菌生物膜合成水不溶性胞外多糖的影响
蜂胶MBEC浓度组、蜂胶1/2MBEC浓度组、蜂胶1/4MBEC浓度组、蜂胶1/8MBEC浓度组、空白对照组变异链球菌单菌生物膜合成水不溶性胞外多糖的测量结果分别为(0.036 5±0.000 65)、(0.057 1±0.002 42)、(0.065 9±0.003 21)、(0.073 4±0.003 86)、(0.083 8±0.014 83) mg·mL-1。蜂胶在MBEC及1/2MBEC浓度时对变异链球菌单菌生物膜状态下合成胞外多糖有抑制作用,与对照组相比较差异具有统计学意义(P<0.05)。
3 讨论
菌斑生物膜是龋病发生的始动因素,与浮游菌相比,菌斑生物膜内细菌的毒力、耐药性和抵抗宿主免疫防御的能力更强[8]。而且在自然状态下,细菌鲜少能以游离纯培养的状态存在,因此仅仅针对游离状态致龋细菌的研究并不能作为其对菌斑生物膜内细菌抑制作用效果的评价,为了更全面地评价药物的防龋效果,对生物膜状态下致龋细菌的研究必不可少。本课题组前期已完成黑蜂蜂胶对主要致龋细菌游离状态下的相关实验研究,结果显示其对游离状态下细菌的生长、产酸、产糖均有不同程度的抑制作用,现关于黑蜂蜂胶对口腔主要致龋细菌单菌生物膜的作用进行一系列实验研究。
生物膜MBEC的实验结果表明,黑蜂蜂胶能渗透单菌生物膜并杀死膜内细菌,并有效清除口腔主要致龋菌的单菌生物膜,但对于不同的菌株其作用效果具有一定差异。根据课题组前期研究结果提示伊犁黑蜂蜂胶对变异链球菌、表兄链球菌、血链球菌、黏性放线菌、内氏放线菌的最低抑菌浓度(minimum inhibitory concentration,MIC)分别为0.78、0.39、0.39、0.20、0.20 mg·mL-1。MBEC浓度和相应MIC浓度相比高出4~8倍,但抗生素对细菌生物膜生长抑制的剂量比浮游状态下同种细菌抑菌剂量高100~1 000倍[9-10]。相比之下,蜂胶对菌斑生物膜和对浮游菌的抑制作用的浓度相差并不十分明显,其对菌斑生物膜的抑制作用机制虽待进一步的研究,但可以肯定的是蜂胶同抗生素相比,毒副作用小,安全性高。
同时,通过检测单菌生物膜ΔpH的变化,发现蜂胶在MBEC以下的浓度时即可抑制生物膜内细菌的产酸能力,并且随着蜂胶剂量的增加,抑制效果随之增加。细菌的致龋性与其产酸、耐酸性相关,牙菌斑生物膜中产酸性最强的为链球菌,其中变异链球菌群尤胜。变异链球菌群的产酸力与主要毒力因子乳酸脱氢酶活性密切相关,而耐酸性则由质子移位膜ATP酶和最适pH决定[1],阻断任意途径即可达到抑制效果。Duarte等[11]研究表明,巴西6型蜂胶可减少变异链球菌、表兄链球菌生物膜的产酸量,并抑制质子移位膜ATP酶的活性。Jeon等[12]研究表明蜂胶提取物反金合欢醇可通过增加胞膜的质子通透性影响变异链球菌在游离和生物膜状态下的产酸耐酸的能力。而本实验中黑蜂蜂胶抑制生物膜产酸的机制是否与上述相似,可否抑制乳酸脱氢酶活性,还待进一步研究。
此外,实验以变异链球菌为对象,研究了伊犁黑蜂蜂胶对其单菌生物膜状态下合成水不溶性胞外多糖能力的影响。水不溶性胞外多糖能促进菌斑生物膜的形成,参与生物膜基质的组成,既能将细菌黏附于牙面又对生物膜起支撑和屏障作用。本实验结果表明伊犁黑蜂蜂胶可抑制生物膜状态下水不溶性胞外多糖的产生,推测由此可减少生物膜内基质,降低生物膜密度,增加其渗透性,从而影响生物膜正常结构。有相关研究[13]表明,蜂胶可对变异链球菌游离状态及生物膜状态中的葡糖基转移酶(glucosyltransferase,GTFs)B、C活性产生抑制作用;蜂胶中不同成分在不同程度上均可抑制包括游离和生物膜状态下的GTFB、C、D的活性[14]。可推测黑蜂蜂胶作用机制与上述相似。
综上所述,伊犁黑蜂蜂胶能够有效清除口腔主要致龋细菌单菌生物膜,对其生物膜产酸均有明显抑制作用,并且能有效抑制变异链球菌生物膜合成水不溶性胞外多糖的能力。推测伊犁黑蜂蜂胶对致龋过程的多个环节均有作用,可对不同致龋毒力因子产生不同程度的影响。在本研究中以单菌生物膜状态为对象,但自然条件下牙菌斑生物膜为多菌混合生长,因此对多菌生物膜的研究势在必行,且评估蜂胶对致龋细菌的主要毒力因子相关的酶和基因的影响亦十分重要。本课题组将进一步研究,探讨其防龋机制,为开发具有防龋潜能的天然药物奠定实验基础。
[1]周学东. 实用口腔微生物学与技术[M]. 北京: 人民卫生出版社, 2009:193-205, 212.
[2]Seidel V, Peyfoon E, Watson DG, et al. Comparative study of the antibacterial activity of propolis from different geographical and climatic zones[J]. Phytother Res, 2008, 22(9):1256-1263.
[3]李艳. 蜂胶提取物的体外抑菌和安全性评价的初步研究[D]. 南京: 南京农业大学, 2011:1-67.
[4]魏强华, 张继平, 刘润好, 等. 蜂胶水提除蜡工艺的研究[J]. 食品研究与开发, 2007, 28(5):72-74.
[5]高秋爽, 广洁. 防龋中药的研究概况[J]. 中国中药杂志,2011, 36(5):650-653.
[6]林静. 没食子鞣质对变形链球菌致龋机制作用的研究[D].乌鲁木齐: 新疆医科大学第一临床医学院, 2011:1-54.
[7]谢倩, 唐蓓, 李继遥, 等. 原花色素对口腔细菌及牙菌斑生物膜影响的实验研究[J/OL]. 中国科技论文在线, [2012-02-22]. http://www.paper.edu.cn/releasepaper/content/201202-824.
[8]梁景平. 牙菌斑生物膜特性研究进展[J]. 上海交通大学学报: 医学版, 2007, 27(2):123-127.
[9]Saye DE. Recurring and antimicrobial-resistant infections:considering the potential role of bio fi lms in clinical practice[J]. Ostomy Wound Manage, 2007, 53(4):46-48, 50, 52.
[10]Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofi lms: from the natural environment to infectious diseases[J].Nat Rev Microbiol, 2004, 2(2):95-108.
[11]Duarte S, Rosalen PL, Hayacibara MF, et al. The in fl uence of a novel propolis on mutans streptococci biofilms and caries development in rats[J]. Arch Oral Biol, 2006, 51(1):15-22.
[12]Jeon JG, Pandit S, Xiao J, et al. In fl uences of trans-trans farnesol, a membrane-targeting sesquiterpenoid, on Streptococcus mutans physiology and survival within mixedspecies oral bio fi lms[J]. Int J Oral Sci, 2011, 3(2):98-106.
[13]Duarte S, Koo H, Bowen WH, et al. Effect of a novel type of propolis and its chemical fractions on glucosyltransferases and on growth and adherence of mutans streptococci[J]. Biol Pharm Bull, 2003, 26(4):527-531.
[14]Koo H, Rosalen PL, Cury JA, et al. Effects of compounds found in propolis on Streptococcus mutans growth and on glucosyltransferase activity[J]. Antimicrob Agents Chemother, 2002, 46(5):1302-1309.
