细胞间隙连接蛋白43基因在斑马鱼牙齿早期发育中的表达
2015-10-13徐智云刘鑫黄兴杨德琴
徐智云 刘鑫 黄兴 杨德琴
重庆医科大学附属口腔医院牙体牙髓科·口腔疾病与生物医学重庆市重点实验室,重庆 400017
牙齿发育是一种复杂的生理过程,主要通过上皮和间充质间的相互作用完成,期间涉及多种生长因子和信号途径,在特定的时空调控下共同作用最终成形。细胞间隙连接蛋白43(connexin 43,cx43)直接调控细胞间的连接通讯,进行信息和能量的传递,进而调控细胞的新陈代谢和增殖分化等一系列生理过程[1],在脊椎动物早期的心血管发育[2]、神经系统传导[3]、骨骼形成和矿化[4]中发挥重要作用,同时与心血管系统、泌尿生殖系统、神经系统等疾病的发生发展密切相关[5-6]。研究[7]发现,cx43基因在小鼠牙齿发育成形过程中高表达,参与牙齿发育,并且在牙齿矿化过程中发挥重要作用。cx43基因缺陷与人类常染色体显性遗传病眼-牙-指综合征(oculoden-todigital dysplasia,ODDD)相关,呈现并指、釉质发育不全和(或)颅面部畸形等表型[8]。目前cx43基因在牙齿发育和矿化过程中的具体功能尚不清楚。
斑马鱼是一种公认的用于研究器官形成和发育相关分子生物学机制的理想模式生物,因其同哺乳动物高度的基因同源性而被广泛运用于发育生物学的研究[9]。斑马鱼牙齿的发育和替换很大程度上反映了有牙脊椎动物的原始状态[10]。本研究旨在探索cx43基因在斑马鱼牙齿发育和形成中的作用,为探究牙齿内源性再生奠定基础。
1 材料和方法
1.1 实验动物
野生型(wild type)斑马鱼,由西南大学分子发育实验室购进。
1.2 主要试剂及设备
聚合酶链反应(polymerase chain reaction,PCR)引物由上海生工生物工程技术服务有限公司合成。限制性内切酶(NEB公司,美国),PCR puri fi cation Kit检测试剂盒(Qiagen公司,美国),逆转录试剂盒(Roche公司,美国),RNA提取试剂盒(Life Technologies公司,美国),T4连接酶(Invitrogen公司,美国)。体视解剖显微镜(Leica公司,德国),台式离心机(Eppendorf公司,德国)。
1.3 动物饲养
参照Wester fi eld[11]的方法于28.5 ℃水温、14 h光照、10 h黑暗的条件下进行饲养,按雌雄比例1︰1或1︰2放入交配缸内,次日清晨收集斑马鱼受精卵并清洗,置于28.5 ℃恒温孵育箱中培养和胚胎孵育。用于整胚原位杂交的胚胎培养液中需添加0.04%的1-苯基-2-硫脲(phenylthiourea,PTU)孵育。
1.4 cx43反义探针的制备
收集野生型斑马鱼受精后72 h的胚胎,用Trizol法提取总RNA,运用琼脂糖凝胶电泳及紫外分光光度计检测完整性及纯度,逆转录合成cDNA,-20 ℃储存备用。根据斑马鱼cDNA文库中cx43基因序列设计引物,探针正向引物:5’-ACTCCCTCAAGAXXXXXGACT-3’,反向引物:5’-CTAGCGTTGGGXXXXXGCAT-3’,以cDNA为模板进行PCR扩增。连接PCR产物于PGEMT载体上,转化到DH5α感受态菌株中进行克隆,筛选氨苄抗性阳性质粒。用EcoRⅠ酶或NotⅠ酶对重组质粒进行酶切验证,通过测序鉴定判断插入片段连接方向。取正确的重组质粒单一酶切位点线性化,电泳鉴定线性化彻底后回收。电泳判断浓度,用SP6或T7 RNA聚合酶体外转录体系转录模板,同时加入地高辛标记的寡核苷酸,转录后用DnaseⅠ酶消化多余的DNA骨架,产物经LiCl纯化后得到地高辛标记的cx43基因反义mRNA探针,1%琼脂糖凝胶电泳鉴定RNA质量并测量浓度,-20 ℃保存。
1.5 斑马鱼全时相胚胎原位杂交
运用整胚原位杂交技术检测斑马鱼胚胎发育早期cx43基因在牙齿发育部位的表达分布。收集受精后48 h、60 h、72 h、84 h、96 h、108 h、120 h、132 h、6 d、7 d、8 d、9 d不同发育时期的斑马鱼胚胎,4%多聚甲醛4 ℃过夜固定,甲醇梯度脱水至胚胎透明,-20 ℃、100%甲醇溶液中保存备用。第1天,1×PBST梯度孵育复水,用5 μg·mL-1蛋白酶K消化[12]并4%多聚甲醛再固定后移入68 ℃杂交炉中预杂交2~5 h,地高辛标记的cx43 RNA探针预变性处理后,加入胚胎中65 ℃杂交过夜。第2天,首先2×SSCT梯度逐步洗去多余非特异性结合探针,然后室温下梯度过度到马来酸缓冲液(Maleic acid buffer,MABT),用1×封闭缓冲液(1×blocking)胚胎封闭2 h。最后加入1︰2 000稀释的anti-DIG-AP封闭液与cx43基因反义mRNA探针在4 ℃下结合过夜。第3天,室温下用MABT清洗直至洗净,严格避光,NTMT平衡液中按1︰50加入显色液5-溴-4-氯-3-吲哚基-磷酸(5-bromo-4-chloro-3-indolyl phosphate,BCIP)/硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)溶液显色20 min,显微镜下观察显色成功(出现棕褐色杂交信号)后终止染色,记录结果并进行分析。
1.6 茜素红染色
取受精后9 d斑马鱼适量,放置于MS-222溶液(100 mg·L-1)中麻醉致死,用4%多聚甲醛固定2 h后50%乙醇脱水10 min;去除乙醇加入0.5%茜素红染液染色过夜;纯水漂洗后用现配的1.5%双氧水和1%氢氧化钾混合液漂白20 min,经0.5%KOH和甘油混合液梯度透明,保存于纯甘油中[13],比较cx43原位杂交表达区域与咽齿解剖部位的关系。
2 结果
2.1 cx43反义探针的制备
通过PCR扩增获得的特异性条带,片段大小约1 179 bp(图1),长度符合预期。将PCR片段连接于PGEMT载体上,对重组质粒用EcoRⅠ酶切验证(图2),正确的重组质粒可在EcoRⅠ酶的作用下切出3 kb骨架和1 179 bp插入片段。7个待验证质粒中除1个外余皆可切出相应片段,为正确的重组质粒。质粒PGEMT-cx43构建成功。取正确的重组质粒,判断片段连接方向为反向,用SalⅠ在SP6方向切开线性化重组质粒,选用T7 RNA聚合酶反转录获得cx43基因反义mRNA探针。
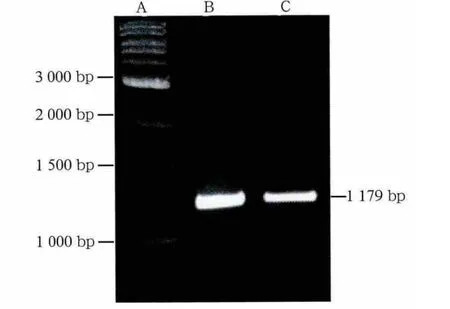
图1 PCR结果Fig 1 PCR results
2.2 茜素红染色结果
茜素红染色结果表明,受精后9 d时cx43原位杂交表达部位与咽齿解剖部位基本重叠一致(图3),说明cx43基因表达于发育中的咽齿,而对已经矿化完全的咽齿不发挥作用。
2.3 斑马鱼全时相胚胎原位杂交结果
原位杂交结果表明,cx43基因在斑马鱼受精后各个时期咽弓牙齿相应部位均可见到强棕褐色阳性信号,除此以外中枢神经系统、头部、眼睛以及胰腺等部位也可检测到阳性信号(图4)。
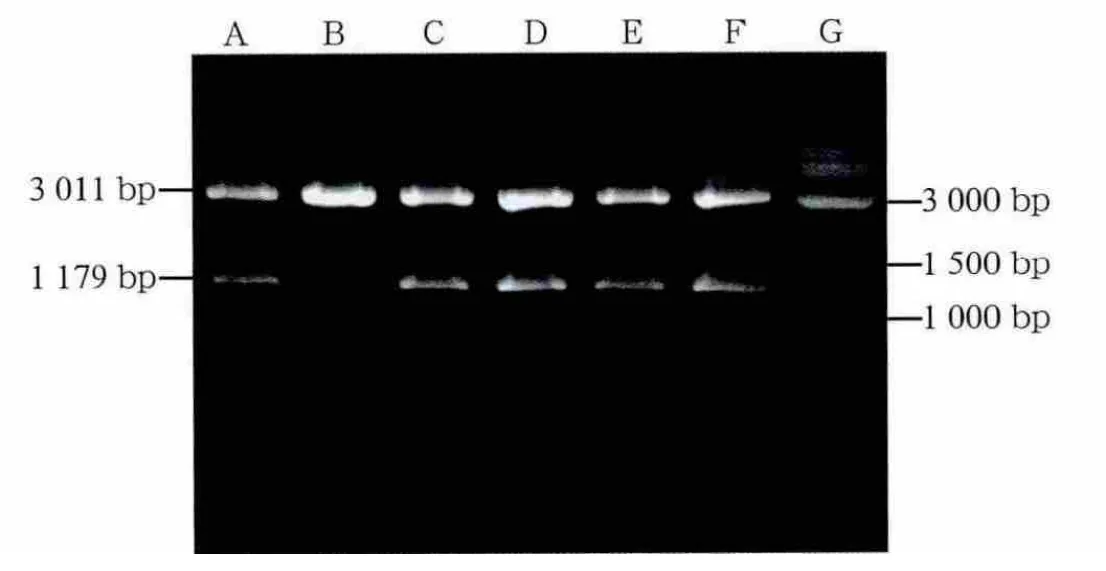
图2 重组质粒EcoRⅠ酶切验证Fig 2 Restriction enzyme digestion of recombination plasmid with EcoRⅠ
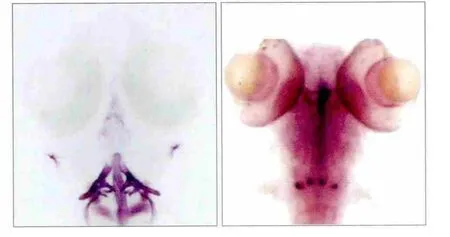
图3 cx43基因表达部位与咽齿解剖部位 茜素红染色 × 50Fig 3 cx43 gene expression and anatomical of pharyngeal teeth ali-zarin red stain × 50
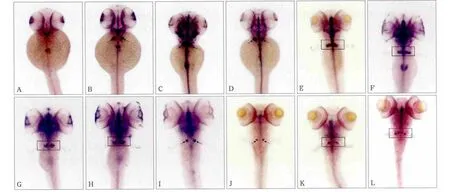
图4 cx43基因48 h~9 d的斑马鱼胚胎 原位杂交 × 50Fig 4 cx43 gene from 48 h to 9 d embryo of Zebra fi sh in situ hybridization × 50
在斑马鱼牙齿发育起始点受精后48 h,cx43少量表达于眼睛、前肾以及神经中枢(图4A);60 h时检测到cx43在牙齿相应部位开始表达,同时神经中枢表达增强,背侧观棕褐色信号以中线为轴左右对称,位于头部稍下最后咽弓处(图4B),左侧位观表达位于心脏斜上方,部位与咽齿的解剖部位相重叠。72 h时可见cx43信号表达量较之前明显上升,背侧观信号增强明显(图4C);84 h时出现回落,表达量逐渐降低(图4D);96 h时开始一侧由一整个信号点逐渐分为2个,部分两信号间区分不明显(图4E);108 h单侧2个等大信号较前一时相更为独立清晰(图4F);120 h时单侧信号点由2个向3个转换(图4G);132 h时呈现单侧3个清晰的信号点且左右表型不对称(图4H);6 d时表达量明显减弱(图4I);7 d时维持一个较弱的表达(图4J);8 d时表达略增强,呈中间大两边小3个点(图4K)或一大一小2个点;9 d时单侧出现两个等大的弱信号(图4L)。
3 讨论
目前国内外学者多以小鼠、小型猪等作为研究牙发育的首选,然而这些模式生物由于自身的局限性,对于基因表达的动态追踪定位、信号间相互传导的级联网络分析等相关研究存在极大困难,不能够准确获得基因表达时间、空间与具体发育过程之间的相互联系。斑马鱼虽为原始脊椎动物,但与人类具有高度的基因同源性和相似的分子机制,具有研究的前瞻价值[14]。斑马鱼的优势除了体积小、易于饲养与繁殖、成熟周期短,能够快速获得大量个体以外,同时具有体外发育、早期胚体透明等特点,借助一些特殊的实验技术和实验手段,易于追踪观察,获取直观信息,为研究分子机制提供了可操作性。这是本研究选用斑马鱼为模式生物的原因。
斑马鱼缺乏口齿但存在发育矿化良好的咽齿,咽齿局限于第五鳃弓处,其牙为端生牙、同形牙、多牙列。咽齿无论在基本组成结构还是发育过程上都与哺乳动物具有极强的相似性[15]。矿化程度和Ca、P比例亦与哺乳动物具有一定程度的相似性[16]。咽齿的特异性在于存在部位特殊和缺乏牙根[17],但这不影响早期牙胚发育过程的研究。斑马鱼是研究人类牙齿形态特征、组织结构和生物矿化过程的理想模式动物。斑马鱼牙齿分为腹(V)、中(MD)、背(D)侧3组,最早发育的牙齿4V1在胚胎受精后48 h即开始形成,在4 d时完全矿化及附着于牙槽骨上[18]。3V1和5V1在受精后56 h时同时出现在4V1两侧,并在6 d时发育完善及附着于牙槽骨上[20]。最早替换的牙齿4V2形成于受精后80 h,3V2、5V2随后出现于144 h。4V2、3V2和5V2在受精后12 d完全发育及附着于牙槽骨上[19]。
本研究整胚原位杂交结果表明,cx43在斑马鱼牙齿发育过程中发挥作用。初代牙齿期:虽然4V1在受精后48 h开始形成,但cx43无表达,此时牙处于钟状期尚未矿化。60 h时4V1进入晚期细胞分化期,cx43基因参与其中并开始表达于牙齿发育部位。72 h时3V1和5V1由早期细胞向晚期细胞分化,cx43表达量上升迅速,84 h时可见cx43表达量有所减低。由此可推测cx43在细胞分化晚期至附着初期发挥作用,即在矿化阶段发挥功能。3V1、5V1从72 h到120 h一直处于晚期细胞分化阶段,从96 h开始随着3V1、5V1发育的进行,单侧逐渐出现两个高表达点(3V1,5V1),两个表达信号之间起初较为接近,至108 h时逐渐独立清晰,表达信号左右对称等大。发育替换期:最早的替换牙齿4V2形成于80 h,而3V2、5V2形成于6 d。既往的研究发现,斑马鱼替换牙齿与初代牙齿发育分子信号机制存在差异,发育时间有所延长。初代牙齿一般2~4 d即可完成发育,而替换的牙齿发育时间多延长到8 d左右[20]。因此可以推论,替换的牙齿发育矿化的时间也相应推后。从cx43在相应部位的表达检测可以发现,120 h时4V2开始矿化,此时两个信号点(3V1、5V1)向3个信号点(4V2、3V1、5V1)转化,132 h时基本两侧呈现3个信号点(4V2、3V1、5V1)且两边稍大,中间略小。6 d时3V1、5V1矿化完成,cx43相应部位表达结束,原位杂交结果符合预期。6、7 d时cx43表达呈单侧单一信号(4V2),8 d时4V2、3V2及5V2同时处于细胞分化矿化期,呈现中间大两边小3个信号点(4V2、3V2、5V2)。9 d时4V2矿化完成,3V2、5V2继续直至12 d完成附着。cx43表达模式同牙齿矿化阶段吻合,且主要表达于矿化晚期。这可初步认为cx43在牙齿细胞分化晚期发挥作用,参与矿化。此外从cx43信号的表达量上,亦可以看出初代牙齿与替换牙齿之间存在差异。这种差异可能与干细胞在初代牙齿形成过程中的集聚现象有关。
关于cx43在牙齿发育中的作用,最早Pinero等[21]用受精后1 d的小鼠进行免疫组织化学染色方法发现cx43在新生鼠的口腔成釉上皮层、成牙本质细胞层及牙槽骨处均有表达,且表达广泛存在于内釉上皮、中间层和成牙本质细胞区域。这说明cx43与牙的形成相关。João等[7]运用激光共聚焦技术发现cx43基因参与成釉细胞和成牙本质细胞的早期分化。Toth等[22]运用ODDD小鼠模型证明了cx43表达水平的降低是成釉细胞发育失常、釉质发育不全的主要原因。这说明cx43同时参与了釉质的形成。本实验运用斑马鱼整胚原位杂交技术对基因表达部位进行连续动态检测,证实了cx43参与牙齿的矿化过程,并且主要作用于矿化晚期阶段。
牙的发育和形成过程涉及多种基因共同参与形成复杂的网络调节系统,根据原位杂交数据可发现,cx43在斑马鱼牙齿发生部位和矿化阶段高表达,说明cx43参与牙齿发育矿化的过程,然而cx43基因调控牙齿发育的机制及与牙本质细胞矿化相关性的研究尚属探索阶段,因此本实验运用斑马鱼为模式生物,通过原位杂交技术探究cx43基因在斑马鱼早期胚胎发育过程中的表达,结果表明cx43基因参与了牙齿的发育和分化,且主要作用于矿化晚期阶段。
[1]Bloor DJ, Wilson Y, Kibschull M, et al. Expression of connexins in human preimplantation embryos in vitro[J]. Reprod Biol Endocrinol, 2004, 2:25.
[2]Song YN, Zhang H, Zhao JY, et al. Connexin 43, a new therapeutic target for cardiovascular diseases[J]. Pharmazie,2009, 64(5):291-295.
[3]Salmina AB, Morgun AV, Kuvacheva NV, et al. Establishment of neurogenic microenvironment in the neurovascular unit: the connexin 43 story[J]. Rev Neurosci, 2014, 25(1):97-111.
[4]Plotkin LI, Bellido T. Beyond gap junctions: connexin43 and bone cell signaling[J]. Bone, 2013, 52(1):157-166.
[5]Nishii K, Shibata Y, Kobayashi Y. Connexin mutant embryonic stem cells and human diseases[J]. World J Stem Cells, 2014, 6(5):571-578.
[6]林山力, 文欢, 邓红. 连接子蛋白43在肿瘤中的作用及其机制的研究进展[J]. 中华病理学杂志, 2014, 43(1):62-64.
[7]João SM, Arana-Chavez VE. Expression of connexin 43 and ZO-1 in differentiating ameloblasts and odontoblasts from rat molar tooth germs[J]. Histochem Cell Biol, 2003,119(1):21-26.
[8]Laird DW. Syndromic and non-syndromic disease-linked Cx43 mutations[J]. FEBS Lett, 2014, 588(8):1339-1348.
[9]Verstraeten B, van Hengel J, Sanders E, et al. N-cadherin is required for cytodifferentiation during zebra fi sh odontogenesis[J]. J Dent Res, 2013, 92(4):365-370.
[10]Stock DW. Zebra fi sh dentition in comparative context[J].J Exp Zool B Mol Dev Evol, 2007, 308(5):523-549.
[11]Wester fi eld M. The zebra fi sh book. A guide for the laboratory use of zebra fi sh (Danio Rerio)[M]. 5th ed. Eugene:University of Oregon Press, 2007:231-236.
[12]Verstraeten B, Sanders E, Huysseune A. Whole mount immunohistochemistry and in situ hybridization of larval and adult zebra fi sh dental tissues[J]. Methods Mol Biol, 2012,887:179-191.
[13]Walker MB, Kimmel CB. A two-color acid-free cartilage and bone stain for zebra fi sh larvae[J]. Biotech Histochem,2007, 82(1):23-28.
[14]Tsang M. Zebra fi sh: a tool for chemical screens[J]. Birth Defects Res C Embryo Today, 2010, 90(3):185-192.
[15]Jernvall J, Thesleff I. Tooth shape formation and tooth renewal: evolving with the same signals[J]. Development,2012, 139(19):3487-3497.
[16]Arnold WH, Naumova KI, Naumova EA, et al. Comparative qualitative and quantitative assessment of biomineralization of tooth development in man and zebra fi sh (Danio rerio)[J].Anat Rec: Hoboken, 2008, 291(5):571-576.
[17]Huysseune A, Thesleff I. Continuous tooth replacement: the possible involvement of epithelial stem cells[J]. Bioessays,2004, 26(6):665-671.
[18]Jackman WR, Stock DW. Transgenic analysis of Dlx regulation in fi sh tooth development reveals evolutionary retention of enhancer function despite organ loss[J]. Proc Natl Acad Sci USA, 2006, 103(51):19390-19395.
[19]Borday-Birraux V, Van der Heyden C, Debiais-Thibaud M, et al. Expression of Dlx genes during the development of the zebra fi sh pharyngeal dentition: evolutionary implications[J]. Evol Dev, 2006, 8(2):130-141.
[20]Van der Heyden C, Huysseune A. Dynamics of tooth formation and replacement in the zebra fi sh (Danio rerio)(Teleostei, Cyprinidae)[J]. Dev Dyn, 2000, 219(4):486-496.
[21]Pinero GJ, Parker S, Rundus V, et al. Immunolocalization of connexin 43 in the tooth germ of the neonatal rat[J]. Histochem J, 1994, 26(10):765-770.
[22]Toth K, Shao Q, Lorentz R, et al. Decreased levels of Cx43 gap junctions result in ameloblast dysregulation and enamel hypoplasia in Gja1Jrt/+ mice[J]. J Cell Physiol, 2010, 223(3):601-609.
