山羊颞下颌关节盘细胞的表面形貌和力学特性研究
2015-10-13包广洁孔楠楠郭曼丽苏雪莲康宏
包广洁 孔楠楠 郭曼丽 苏雪莲 康宏
1.西北民族大学口腔医学国家民族事务委员会重点实验室,兰州 730030;2.兰州大学口腔医学研究所,兰州 730000
颞下颌关节盘是位于颞骨关节窝和下颌骨髁突之间的纤维软骨样组织,在颞下颌关节行使功能过程中起到缓冲应力的作用[1]。随着年龄和颞下颌关节功能位置、负荷大小的改变,颞下颌关节盘也会发生相应的组织改建[2]。据报道[3],有20%~50%的人由于关节盘变性、变薄、穿孔等原因罹患关节盘功能障碍性疾病;而目前的治疗方法除了手术摘除之外,仍缺乏其他有效的措施。
细胞替代疗法是迄今最有前景的治疗关节软骨缺损的方法[4],该方法中种子细胞的选择非常关键。自体或异体的颞下颌关节盘细胞是重要的种子细胞来源,目前对其分类和分型已取得了初步进展,从组织学上可分为软骨细胞样细胞和成纤维细胞样细胞[5-7],但两种类型的细胞在生物力学方面的反应特性尚不清楚。
生物原子力显微镜(atomic force microscopy,AFM)[8]具有纳米级分辨率,且易于操作,便于定量测定生物样本的结构和力学性能,因而广泛用于细胞形态和生物力学研究中[9]。AFM通过高度灵敏的悬臂获取细胞的形态结构、刚度和黏附力[10],这些特征可以揭示细胞的表面结构和力学性能以及与细胞功能之间的关系。本研究通过AFM接触模式获取颞下颌关节盘软骨细胞样细胞和成纤维细胞样细胞的超微形貌特征,通过AFM力学模式获取相关数据,对比细胞弹性和黏附力,探索颞下颌关节盘细胞的生物力学特性,为工程化颞下颌关节盘组织的后续研究提供依据。
1 材料和方法
1.1 关节盘细胞的分离与培养
分批购置新鲜屠宰的1月龄山羊头,充分清洁,75%乙醇中浸泡30 min。在无菌条件下取出双侧颞下颌关节盘,修剪周围组织,用含100 U·mL-1青霉素和0.1 g·L-1链霉素双抗的PBS充分冲洗3次,移入50 mL小烧杯中,将其剪碎至约1 mm3大小;加10 mL 0.2%Ⅰ型胶原酶(Sigma公司,美国),于37 ℃、86 r·min-1摇床上消化15 h。H-DMEM培养液(Hyclone公司,美国)重悬离心,收集细胞。一部分细胞以每毫升1×105个的密度接种于培养皿(无锡耐思生物科技有限公司)中,另一部分按每毫升2×105个的密度接种于50 mL培养瓶;加5 mL完全培养液,其中含有15%胎牛血清(杭州四季青生物科技有限公司)、1%维生素C(Sigma公司,美国)、2 mmoL·L-1谷氨酰胺(Sigma公司,美国)和1%青霉素-链霉素(上海碧云天生物技术有限公司),于37 ℃、5%CO2及饱和湿度恒温箱(HF90 Heal Force型二氧化碳培养箱,上海力申科学仪器有限公司)内培养,待细胞融合至85%~90%后以胰酶(Sigma公司,美国)消化,然后传代。
1.2 关节盘细胞的鉴定
收集第1代关节盘细胞,制作细胞爬片,培养72 h,PBS液冲洗3 次;4%多聚甲醛固定,按照免疫组织化学试剂盒(SP-9002型,北京中杉金桥生物技术有限公司)的SP法进行Ⅰ型胶原鼠单克隆抗体(Abcam公司,英国)免疫组织化学鉴定,另外采用甲苯胺蓝染色法进行酸性糖氨多糖(glycosaminoglycan,GAG)鉴定。
1.3 AFM形貌测定
1.3.1 关节盘细胞表面形貌成像 接种到培养皿中的原代细胞培养2 d,待细胞充分伸展,更换不含胎牛血清的高糖DMEM培养液培养,然后进行Bio-AFM成像。使用安装在Axiovert200 型倒置显微镜(卡尔蔡司公司,德国)上的JPK Nano Wizard 3型AFM(JPK公司,德国)进行关节盘细胞成像。光镜下分别挑选三角形的软骨细胞样细胞和长梭形的成纤维细胞样细胞,使用80 μm×80 μm大范围扫描器和PNP-TR三角形悬臂硅探针(Nanoworld公司,美国)探头进行接触模式扫描,扫描速度为0.1~0.25 Hz·s-1,接触模式下采用的恒定的经验侧向力值(Setpoint)为0.533 nN,单次扫描持续和形貌复原时间为15 min。将扫描获得的细胞表面形貌图像用AFM系统的JPK Data Processing软件进行分析,从细胞纳米分辨率水平上比较两种类型的关节盘细胞在生物力学特性上的差异。
1.3.2 细胞膜表面粗糙度分析 平均表面粗糙度Ra是细胞表面高度平均值的算术平均偏差,Rq为其均方根。在AFM细胞形貌图上随机选择20个2 μm×2 μm的区域,通过JPK Data Processing软件获取Ra和Rq(单位:nm)。运用SPSS 17.0统计软件对结果进行t检验,检验水准为双侧α=0.05。
1.4 关节盘细胞生物力学特性分析
在倒置显微镜下分别随机选取20个软骨细胞样细胞和成纤维细胞样细胞,分别在细胞的细胞核区和细胞质区测定细胞的生物力学特性。扫描获得细胞的力-位移曲线,通过JPK Data Processing软件进行数据拟合,分析两种细胞的杨氏模量和黏附力。通过SPSS 17.0软件进行单因素方差分析和t检验分析,检验水准为双侧α=0.05。
2 结果
2.1 关节盘细胞的形态学观察
光学显微镜下,软骨细胞样细胞呈三角形,成纤维细胞样细胞呈长梭形,二者形态完全不同。原代细胞多以长梭形的成纤维细胞样细胞为主,部分呈圆形及多角形(软骨细胞样细胞),折光性强;第1代后,细胞逐渐不规则,多角形增多(图1A)。甲苯胺蓝染色细胞质呈紫蓝色(图1B),说明关节盘细胞具有成软骨的特性。Ⅰ型胶原免疫组织化学染色可见细胞质内有棕黄色的阳性染色颗粒(图1C),说明关节盘细胞有成纤维特性。

图1 颞下颌关节盘细胞的形态学观察 光学显微镜 × 100Fig 1 Morphological observation of temporomandibular joint disc cells optical microscope × 100
2.2 两种类型关节盘细胞AFM形貌观察
单细胞的AFM图像能够显示出细胞表面的超微结构,软骨细胞样细胞和成纤维细胞样细胞的形貌特征见图2。观察AFM高度图可见,软骨细胞样细胞的细胞体高亮,边缘部分略暗,比较图中黑色横截线所对应的曲线图发现,细胞质和细胞核过渡不明显(图2E)。成纤维细胞样细胞的细胞核部分高亮,呈椭圆形,向细胞质部分逐渐变暗,相应的曲线剖面图显示,从细胞核到细胞质区呈一个平缓的斜坡状过渡(图2G)。二者的三维重建图(图2B、D)同样可以看出这种趋势。AFM偏转图能够观察到软骨细胞样细胞边缘伸出许多伪足,紧密贴合于培养皿基底,细胞连结部分的伪足相互交错,结合紧密,细胞体可见纵横交错呈树枝状的骨架结构,黑色横截线所对应的曲线图发现细胞表面轮廓凹凸不平,骨架结构明显凸起,支撑细胞的整体形态(图2F)。成纤维细胞样细胞边缘光滑,极少有伪足伸出,骨架结构在细胞质区规则排列(图2H)。
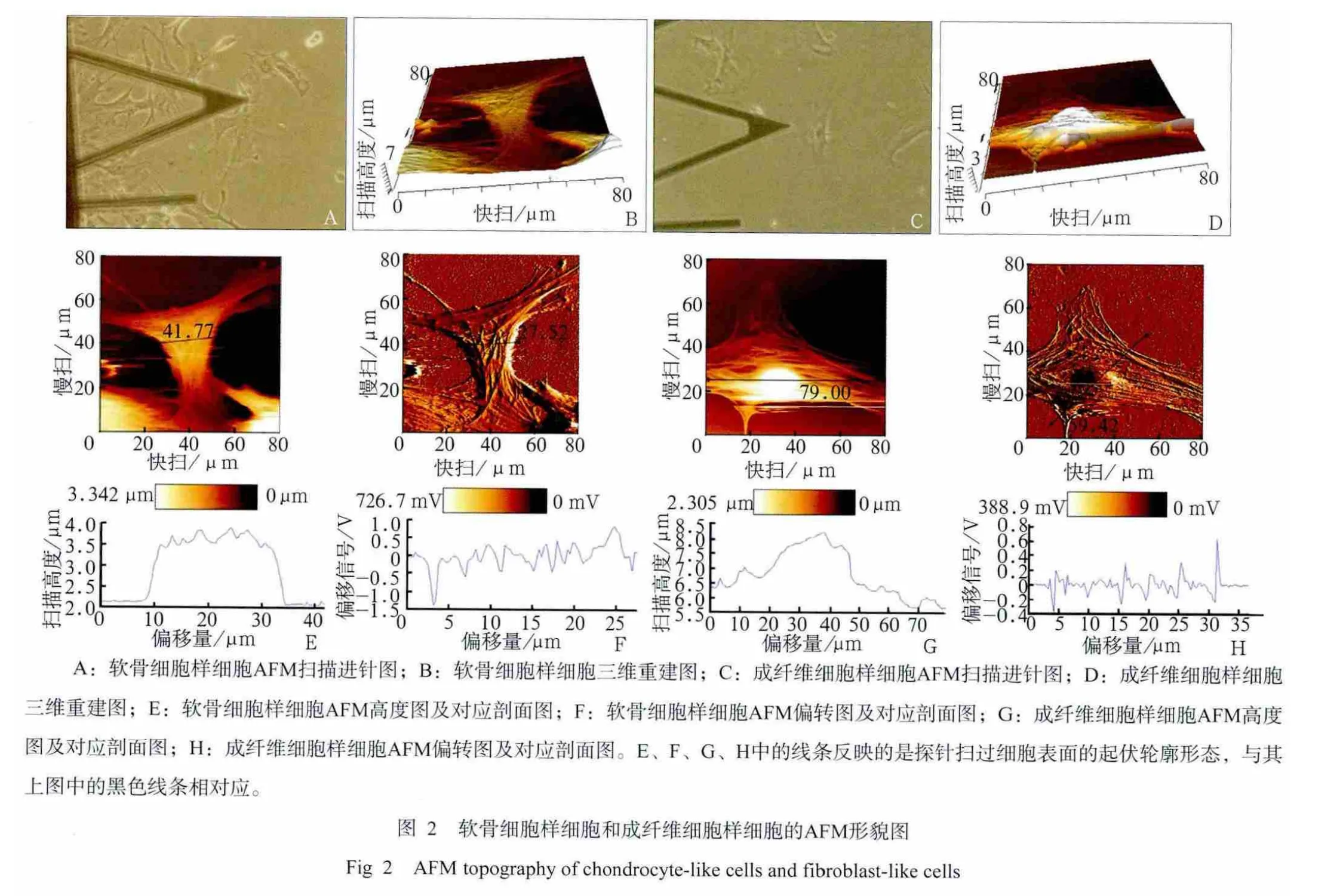
2.3 表面粗糙度分析
软骨细胞样细胞表面的Ra和Rq分别为(55.07±24.65) nm和(63.65±33.11) nm,成纤维细胞样细胞的Ra和Rq分别为(60.37±29.41) nm和(66.52±37.79) nm;经t检验,两种类型细胞的表面粗糙度的差异没有统计学意义(Ra:P=0.587;Rq:P=0.769),说明二者表面粗糙度接近,可能没有区域性差异或者需要进一步加大样本量进行分析。
2.4 两种细胞力学特性分析
通过JPK Data Processing软件计算得到软骨细胞样细胞和成纤维细胞样细胞的细胞核区和细胞质区的杨氏模量及黏附力见表1。经t检验,两种细胞的细胞核区杨氏模量的差异无统计学意义(P>0.05),但是在细胞质区的差异有统计学意义(P=0.047);两种细胞表面的黏附力无论是细胞核区还是细胞质区,差异均无统计学意义(P>0.05)。
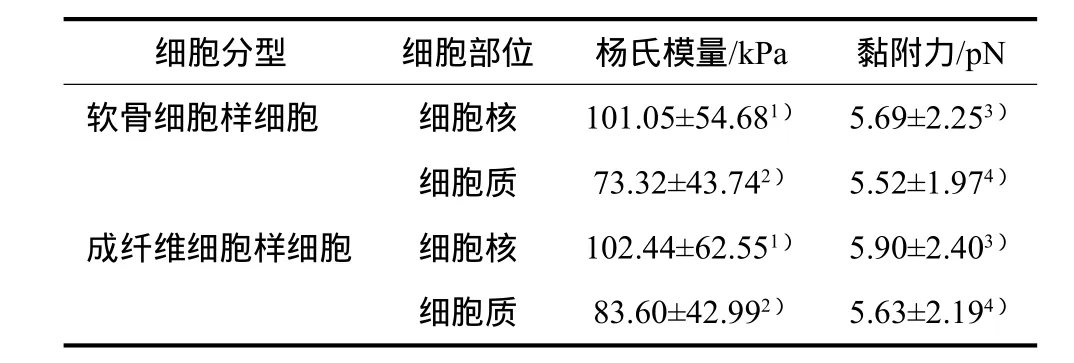
表1 软骨细胞样细胞和成纤维细胞样细胞的杨氏模量和黏附力比较Tab 1 Comparison of Young’s modulus and adhesion of chondrocyte-like cells and fi broblast-like cells
3 讨论
颞下颌关节盘细胞的分型一直存在争议,通常将两种类型的关节盘细胞称为软骨细胞样细胞和成纤维细胞样细胞[11-12]。光镜和电子显微镜观察显示,软骨细胞样细胞具有软骨细胞典型的短小的细胞突起,具有成软骨性;成纤维细胞样细胞呈长梭形,是关节盘细胞的优势细胞[5-6,13],但是两种细胞的生物学功能目前尚不十分清楚。
AFM扫描的细胞表面形貌是对电镜和荧光显微镜观察的有效补充,它能够对处于培养液中细胞的表面形貌及生理状态下的力学特性作实时观察[14]。本实验利用AFM对两种类型的关节盘细胞的表面超微结构作成像对比,结果可见:软骨细胞样细胞较成纤维细胞样细胞体积略小,细胞核占细胞体的大部分,细胞边缘伸出许多伪足,骨架结构纵横交错,覆盖整个细胞体;成纤维细胞样细胞呈长梭形,细胞核部分明显高出细胞质,细胞质均匀平铺在基底上,骨架结构规则排列在整个细胞质部分。细胞表面粗糙度是用来监测细胞信号转导分子之间的反应并能够反映细胞表面组成成分的一项指标[15],本研究两种细胞的表面粗糙度没有明显差异,说明两种类型细胞的表面组成成分可能是相近的。
AFM不仅可以观察细胞形貌[16],也可以通过力学曲线模式测定细胞的力学性能[17],力-位移曲线能够反映所加载的负荷和细胞形变之间的关系,例如细胞弹性,探针与细胞表面小分子相互作用的差异等[18]。AFM是从纳米微观尺度对组织不同区域的特殊位点刚性检测的有效方法。AFM有两种加载模式:轻敲和接触模式。轻敲模式采用垂直向加载,接触模式主要为水平向加载,两种模式都可以复原细胞形貌,本实验采用后者。AFM在轻敲模式下的加载力为0.1~1 nN,在接触模式下为10~40 nN,不会对细胞造成不可逆的形变,对细胞复原无影响;但是需要说明的是,多数实验中采用的探针加载力值为经验值。本实验采用恒定侧向加载的方式,经验值(Setpoint)为0.533 nN,说明JPK Nano Wizard 3 型生物AFM用于细胞形貌观察的力值精度较以前的AFM更为理想。有研究[19]发现,软骨细胞的细胞核和细胞质的刚性比为1.4。本研究分别测定了细胞核区和细胞质区的刚性和黏附力,发现细胞核区的刚性比细胞质区要大。成纤维细胞样细胞骨架结构大部分分布在细胞质区,而软骨细胞样细胞骨架结构相对集中于细胞核区,两种细胞细胞核区的刚性相近,而细胞质区略有差异,成纤维细胞样细胞的刚性略大于软骨细胞样细胞;黏附力在两种细胞的细胞核区和细胞质区的差异均不明显,说明黏附性跟细胞整体特性相关,不是由局部部位决定。
细胞力学性能对细胞与细胞之间的黏附性能(黏弹性变性)有重要的影响[20],杨氏模量、细胞表面粗糙度和细胞黏附性之间存在正相关关系[21],黏附事件的发生与细胞表面蛋白解聚和受体-配体、细胞骨架蛋白有关[22]。黏附性通常反映细胞表面小分子物质的情况,单个黏附分子可以反映整体细胞的黏附特性[23];本研究中关节盘两种类型细胞的黏附力没有明显差异,表明细胞表面的小分子物质是相近的。两种类型的细胞虽然在形态学和分布上存在一定的差异,但是从目前的实验结果看,关节盘细胞在生物力学特性上的差异并不明显。这可能有两方面的原因:一方面是两种类型的细胞在发育和成熟阶段所起的力学作用没有差异;另一方面可能是不同细胞在特定阶段的力学效应表现一致,可以相互转化。这还需要今后对细胞受力后的内部和外部反应进行深入研究。
本实验利用AFM从纳米尺度对软骨细胞样细胞和成纤维细胞样细胞的表面结构进行描述,并对比其生物力学特性,结果发现:两种类型的细胞在形态结构上的差异较大,但其生物力学特性相近。通过黏附力对比分析和黏附相关蛋白的检测可以阐明细胞去分化的机制[24],这为以后颞下颌关节盘组织工程研究中种子细胞的选择提供了思路。
致谢:感谢兰州大学土木工程与力学学院生物力学与医学工程研究所张宝平博士在本课题AFM观察部分给予的大力协助!
[1]Murphy MK, MacBarb RF, Wong ME, et al. Temporomandibular disorders: a review of etiology, clinical management,and tissue engineering strategies[J]. Int J Oral Maxillofac Implants, 2013, 28(6):e393-e414.
[2]康宏, 包广洁, 董玙, 等. 下颌髁突软骨拉伸力学实验研究[J]. 华西口腔医学杂志, 2000, 18(2):85-87.
[3]Allen KD, Athanasiou KA. Tissue engineering of the TMJ disc: a review[J]. Tissue Eng, 2006, 12(5):1183-1196.
[4]Jiang YZ, Zhang SF, Qi YY, et al. Cell transplantation for articular cartilage defects: principles of past, present, and future practice[J]. Cell Transplant, 2011, 20(5):593-607.
[5]舒维娜, 康宏, 张卫平, 等. 山羊颞下颌关节盘细胞类型及分布表征在组织构建中的设计意义[J]. 中国组织工程研究与临床康复, 2009, 13(46):9022-9026.
[6]舒维娜, 康宏. 山羊颞下颌关节盘细胞透射电镜观察[J].现代口腔医学杂志, 2008, 22(6):612-614.
[7]舒维娜, 康宏, 张卫平, 等. 山羊颞下颌关节盘细胞体外培养研究[J]. 实用口腔医学杂志, 2010, 26(2):165-168.
[8]Du Y, Zhang J, Zheng Q, et al. Heavy ion and X-ray irradiation alter the cytoskeleton and cytomechanics of cortical neurons[J]. Neural Regen Res, 2014, 9(11):1129-1137.
[9]Plodinec M, Loparic M, Aebi U. Atomic force microscopy for biological imaging and mechanical testing across length scales[J]. Cold Spring Harb Protoc, 2010(10):pdb.top86.
[10]Liu S, Wang Y. Application of AFM in microbiology: a review[J]. Scanning, 2010, 32(2):61-73.
[11]Mah J. Histochemistry of the foetal human temporomandibular joint articular disc[J]. Eur J Orthod, 2004, 26(4):359-365.
[12]Leonardi R, Lo Muzio L, Bernasconi G, et al. Expression of vascular endothelial growth factor in human dysfunctional temporomandibular joint discs[J]. Arch Oral Biol, 2003, 48(3):185-192.
[13]Detamore MS, Hegde JN, Wagle RR, et al. Cell type and distribution in the porcine temporomandibular joint disc[J].J Oral Maxillofac Surg, 2006, 64(2):243-248.
[14]Le Grimellec C, Lesniewska E, Cachia C, et al. Imaging of the membrane surface of MDCK cells by atomic force microscopy[J]. Biophys J, 1994, 67(1):36-41.
[15]Francis LW, Lewis PD, Wright CJ, et al. Atomic force microscopy comes of age[J]. Biol Cell, 2010, 102(2):133-143.
[16]Lesniewska E, Milhiet PE, Giocondi MC, et al. Atomic force microscope imaging of cells and membranes[J]. Methods Cell Biol, 2002, 68:51-65.
[17]Radmacher M. Measuring the elastic properties of living cells by the atomic force microscope[J]. Methods Cell Biol, 2002,68:67-90.
[18]Hsieh CH, Lin YH, Lin S, et al. Surface ultrastructure and mechanical property of human chondrocyte revealed by atomic force microscopy[J]. Osteoarthr Cartil, 2008, 16(4):480-488.
[19]Ofek G, Natoli RM, Athanasiou KA. In situ mechanical properties of the chondrocyte cytoplasm and nucleus[J]. J Biomech, 2009, 42(7):873-877.
[20]Siamantouras E, Hills CE, Younis MY, et al. Quantitative investigation of calcimimetic R568 on beta cell adhesion and mechanics using AFM single-cell force spectroscopy[J]. FEBS Lett, 2014, 588(7):1178-1183.
[21]Preedy E, Perni S, Nipiĉ D, et al. Surface roughness mediated adhesion forces between borosilicate glass and gram-positive bacteria[J]. Langmuir, 2014, 30(31):9466-9476.
[22]Codan B, Del Favero G, Martinelli V, et al. Exploring the elasticity and adhesion behavior of cardiac fi broblasts by atomic force microscopy indentation[J]. Mater Sci Eng C Mater Biol Appl, 2014, 40:427-434.
[23]Dao L, Gonnermann C, Franz CM. Investigating differential cell-matrix adhesion by directly comparative single-cell force spectroscopy[J]. J Mol Recognit, 2013, 26(11):578-589.
[24]Luo S, Shi Q, Zha Z, et al. Morphology and mechanics of chondroid cells from human adipose-derived stem cells detected by atomic force microscopy[J]. Mol Cell Biochem,2012, 365(1/2):223-231.
