程序性死亡配体1负性调控慢性牙周炎的炎症反应
2015-10-13袁雯雯王晓茜张杰华周闻捷冯云陈娇张平
袁雯雯 王晓茜 张杰华 周闻捷 冯云 陈娇 张平
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
牙周病是一种全球流行的多种致病微生物引起的口腔疾病,可以影响到全世界90%的人口[1]。其中较为常见的慢性牙周炎是由位于龈下菌斑的革兰阴性致病菌启动和发展的,最终导致结缔组织的附着丧失、牙槽骨的吸收及成人牙齿的丧失。此外,还与牙周病和一些威胁生命的系统性疾病的发生呈正相关,如动脉粥样硬化以及糖尿病等[2-3]。
程序性死亡分子1(programmed death 1,PD-1)是B7基因家族的一员,是T细胞活化过程中的负性调节分子[4]。程序性死亡配体1(programmed death ligand 1,PD-L1)是PD-1的配体,文献[5]报道PD-L1诱导性表达于体内多种细胞,包括抗原提呈细胞(antigen presenting cells,APCs)、γ-干扰素(in-terferon-γ,IFN-γ)诱导的人外周血单个核细胞、激活的树突细胞等。还有文献[6]称PD-L1广泛表达于各种肿瘤细胞表面,如乳腺癌、卵巢癌、口腔癌等。PD-1/PD-L1是一对重要的负性协同刺激分子[4],PD-1与PD-L1结合后会抑制T细胞受体介导的淋巴细胞增殖和细胞因子的分泌[5],从而在免疫调控中发挥负性调节作用。PD-1/PD-Ls途径对维持外周免疫耐受有重要作用。此外,PD-1/PD-Ls和T细胞介导的多种疾病相关,如自身免疫性疾病、肿瘤免疫等[7-8]。
PD-L1与慢性炎症的关系目前还不清楚。本课题旨在探讨慢性牙周炎组织细胞表面PD-L1的表达与牙周炎症程度的相关性,为阐明慢性牙周炎免疫调控机制,建立慢性牙周炎的实验诊断、临床预防和治疗新方法奠定基础。
1 材料和方法
1.1 主要试剂和仪器
兔抗人PD-L1抗体(Abcam公司,美国),Immobilon Western化学发光HRP底物(Millipore公司,美国),Trizol(Invitrogen公司,美国),TaKaRa逆转录试剂盒(TaKaRa公司,日本),QuantiTect-SYBR Green PCR试剂盒(Qiagen公司,美国),HRP山羊抗兔IgG抗体、山羊抗兔IgG免疫组化试剂盒(北京中杉金桥生物技术有限公司),十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)仪、快速转印仪、荧光化学发光成像仪(BIO-RAD公司,美国),Varioskan Flash多功能读数仪(Thermo公司,美国),ABI7300荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(ABI公司,美国)。
1.2 样本收集
本实验分为3组,分别为正常对照组、轻度牙周炎组和重度牙周炎组。纳入标准如下。1)正常对照:探诊牙龈基本无出血,探诊深度<3 mm,无牙周袋,无附着丧失,X线片显示牙槽骨无吸收。2)轻度牙周炎:探诊有出血,牙周袋≤4 mm,附着丧失1~2 mm,X线片显示牙槽骨吸收不超过根长的1/3,缺失牙不超过3颗。3)重度牙周炎:牙周袋>6 mm,附着丧失≥5 mm,X线片显示牙槽骨吸收超过根长的1/2甚至达根长的2/3,多根牙有根分叉病变,牙多有松动,缺失牙不超过14颗。排除标准:有糖尿病、甲亢、心脏病、高血压等全身系统疾病的患者。牙龈组织块大小约为2 mm×2 mm×2 mm,所有样本均取自四川大学华西口腔医院牙周科和口腔颌面外科门诊。其中,正常牙龈4例(男性2例,女性2例),取自因正畸需要进行开窗牵引术的患者。轻度牙周炎牙龈4例(男性2例,女性2例),取自牙齿纵折需拔除的患者(纵折不超过3 d,全口检查符合轻度牙周炎确诊标准并且未进行牙周治疗)。重度牙周炎牙龈4例(男性2例,女性2例),取自因牙松动需做翻瓣术的患者。正常牙齿牙周膜16例(男性8例,女性8例),取自因正畸需要拔除的前磨牙。轻度牙周炎牙周膜16例(男性8例,女性8例),取自残根无法保留需拔除的牙齿。重度牙周炎牙周膜16例(男性8例,女性8例),取自因松动无法保留需拔除的牙齿。牙龈组织立即浸泡在4%多聚甲醛中4 ℃固定,牙周膜立即转移至-80 ℃冰箱备用。牙周组织样本的收集经过四川大学华西口腔医院医学伦理部门的严格审查和批准,并征得了患者或其家属的同意。
1.3 荧光定量PCR
取-80 ℃冻存的50~100 mg各组牙周膜组织(各8例),冰上解冻,分别加入1 mL Trizol,用匀浆器匀浆处理,按照Trizol说明书提取总RNA。以提取的总RNA为模板进行逆转录,得到cDNA第一链,以cDNA为模板,分别加入PD-L1引物(上游和下游引物序列分别为5’-GAACTACCTCTGGCACATCCTCC-3’和5’-TAAACGGAAGATGAATGTCAGTGC-3’)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物(上游和下游引物序列分别为5’-AAGAAGGTGGTGAAGCAGGC-3’和5’-TCCACCACCCTGTTGCTGTA-3’)进行PCR扩增。通过溶解曲线反映扩增的特异性。2-ΔΔCt方法计算组间的mRNA相对表达量(倍数)[9]。
1.4 免疫印迹(Western blot)检测
根据凯基全蛋白提取试剂盒说明书提取各组牙周膜的全蛋白(各8例),-80 ℃冻存备用。将蛋白样品上样加入10%的SDS-PAGE胶加样孔内分离蛋白质。将电泳分离的蛋白质转移到聚偏氟乙烯(polyvinylidene fl uoride,PVDF)膜上(200 mA,7 min)。5%脱脂奶粉室温封闭1 h。分别加入PD-L1抗体(1︰200)和GAPDH抗体(1︰1 000),4 ℃过夜,TBST洗涤3次,每次10 min。加入HRP山羊抗兔二抗(1︰5 000),37 ℃ 1 h,TBST洗涤3次,每次10 min。用化学发光检测系统采集图像。
1.5 免疫组织化学方法
将各组牙龈组织放置于ASP-200S自动脱水机脱水,石蜡包埋,切片(4 μm),二甲苯脱蜡,乙醇梯度脱水;3%H2O2室温15 min灭活内源性过氧化物酶,蒸馏水洗2次;高压锅抗原修复,PBS洗3次;山羊血清封闭30 min;向不同组切片中分别加入PD-L1抗体(1︰40),阴性对照加入PBS,4 ℃湿盒过夜,PBS洗涤3次;加入HRP山羊抗兔二抗,37 ℃ 1 h,PBS洗3次;DAB显色,苏木素复染,氨水返蓝,脱水透明,封片,显微镜观察。
1.6 统计学处理
mRNA的平均相对表达量用平均值±标准误表示,采用GraphPad Prism 5行统计分析,根据资料类型用ANOVA检验,取P<0.05为差异有统计学意义。
2 结果
2.1 各组牙齿牙槽骨的吸收情况
对收集的牙齿的影像学资料进行整理,牙槽骨吸收的高度用X线片中釉牙骨质界到牙槽骨水平最低点的距离表示,正常对照组、轻度牙周炎组、重度牙周炎组牙槽骨的平均吸收高度分别为(0.09±0.03)、(1.71±0.04)、(7.26±0.10) mm。
2.2 总RNA的纯度
采用多功能读数仪测定吸光度,所有样本RNA的OD260/OD280均为1.8~2.0,说明提取的总RNA纯度较高。
2.3 各组患者牙周膜中PD-L1 mRNA的相对表达量
在不同组的牙周膜样本中,PD-L1均有表达。正常对照组、轻度牙周炎组、重度牙周炎组PD-L1 mRNA的平均相对表达量分别为1.01±0.02、5.00±0.15、1.57±0.05。轻度牙周炎组牙周膜中PD-L1的表达量最高。轻度牙周炎组和重度牙周炎组间差异有统计学意义(P<0.01);重度牙周炎组和正常对照组间差异无统计学意义(P>0.05)。
2.4 Western blot结果
采用Western blot检测不同组PD-L1的表达,结果表明3组牙周膜组织中均有PD-L1表达(图1)。正常对照组、轻度牙周炎组、重度牙周炎组中PD-L1表达的平均灰度值分别为0.46±0.02、2.30±0.06、0.23±0.02。轻度牙周炎组和重度牙周炎组间差异有统计学意义(P<0.01);重度牙周炎组和正常对照组间差异无统计学意义(P>0.05)。
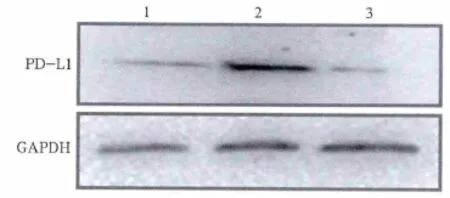
图1 Western blot检测不同组牙周膜中PD-L1的表达Fig 1 The expression of PD-L1 in different groups of parodontiumby Western blot
2.5 免疫组织化学结果
收集不同组牙龈组织做石蜡切片,免疫组织化学染色结果见图2。由图2可见,阴性对照组中无PDL1表达,其他各组牙龈中均有PD-L1的表达,轻度牙周炎患者牙龈中PD-L1的表达高于重度牙周炎。
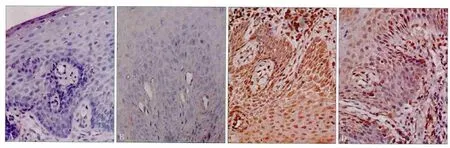
图2 不同组牙龈PD-L1的表达 免疫组织化学 × 400Fig 2 The expression of PD-L1 in different groups of gingival immunohistochemistry × 400
3 讨论
既往研究[6,10]表明,肿瘤细胞表面的PD-L1与T细胞表面的PD-1结合后,形成共抑制分子,减少细胞因子如白细胞介素(interleukin,IL)-2、IFN-γ、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的产生,抑制T细胞的增殖分化,损害T细胞的新陈代谢,抑制抗凋亡蛋白Bcl-X2的分泌,导致T细胞衰竭或凋亡,造成肿瘤的免疫逃逸。同时,PD-L1在肿瘤的转移和发展中起到关键作用,PD-L1表达高者癌症患者预后差[4]。
慢性牙周炎牙周组织的破坏,除了病原微生物及其分泌物直接损伤外,炎症细胞及其分泌的炎症因子发挥至关重要的作用[1]。炎症细胞不仅可以分泌基质金属蛋白酶等直接破坏组织,还可以分泌IL-1、核因子-κB受体活化因子配体等炎症因子活化破骨细胞促进牙槽骨吸收。本课题的研究结果显示:在轻度牙周炎组织中PD-L1高表达,而重度牙周炎组织中PD-L1表达显著减少。PD-L1作为一种保护性配体在慢性牙周炎中发挥重要作用。PD-L1抑制牙周组织炎症的机制可能是减少TNF-α的表达以及刺激CD11c+CD11b+固有层细胞分泌IL-22。TNF-α刺激T细胞产生多种炎症因子,促进炎症反应的发生,是加速炎症反应的一个重要细胞因子,而PD-L1可能是抑制TNF-α产生的一个重要因素。在黏膜感染的过程中,IL-22启动固有免疫并且促进上皮细胞的修复,PD-L1可能刺激IL-22的分泌,从而加速黏膜上皮细胞的自我修复和生长,最终在控制牙周组织的炎症反应中起至关重要的作用。组织受到感染后,PD-L1本身并不能影响组织修复,但可能有抑制上皮细胞凋亡和坏死的作用。此外,在牙周组织的炎症反应过程中,PD-L1可能有维持黏膜上皮完整性以及抑制共生菌过度繁殖的作用[11]。总之,PD-L1的高表达,抑制了炎症细胞活化、增殖和分泌炎症因子,减少了炎症因子对组织的破坏。在重度牙周炎组中,发现PD-L1表达减少,不排除实验中存在个体差异,推测信号通路的多样性及分子之间多元性的相互交错最终产生了这一现象,但是究竟是PD-L1的减少加重了炎症程度还是炎症的继续发展导致了PD-L1的减少还不明确,还亟需针对这一现象的研究。
新近研究[12]表明,牙周炎组外周血CD4+、CD8+T淋巴细胞表面PD-L1的阳性表达率显著高于健康对照组,可能是因为PD-L1在外周血淋巴细胞表面和薄壁组织细胞表面发挥不同的作用。在慢性感染过程中,外周血淋巴细胞表面PD-L1的表达受到刺激后上调,抑制CD8+T的免疫反应,负性调节T细胞功能。然而,薄壁组织细胞表面PD-L1表达的上调对控制组织的炎症反应有重要作用[13]。
综上所述,PD-L1在牙周组织的表达对牙周炎症反应发挥重要的负性调控作用,对牙周组织起保护性效应。这提示,特异性靶向增强PD-L1的活性可能对慢性牙周炎的治疗和控制有有利作用。本实验的结果为牙周炎的预后和治疗提供了潜在的研究价值,同时也拓宽了PD-L1在免疫学中的重要作用,为以后研究PD-L1与慢性牙周炎的关系奠定了基础。
[1]Pihlstrom BL, Michalowicz BS, Johnson NW. Periodontal diseases[J]. Lancet, 2005, 366(9499):1809-1820.
[2]Choi JI, Seymour GJ. Vaccines against periodontitis: a forward-looking review[J]. J Periodontal Implant Sci, 2010,40(4):153-163.
[3]Zhu C, Yang J, Sun J, et al. Induction of immune response and prevention of alveolar bone loss with recombinant Porphyromonas gingivalis peptidylarginine deiminase[J]. Arch Oral Biol, 2013, 58(12):1777-1783.
[4]Ohigashi Y, Sho M, Yamada Y, et al. Clinical signi fi cance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer[J]. Clin Cancer Res, 2005, 11(8):2947-2953.
[5]Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J]. J Exp Med, 2000, 192(7):1027-1034.
[6]Afreen S, Dermime S. The immunoinhibitory B7-H1 molecule as a potential target in cancer: killing many birds with one stone[J]. Hematol Oncol Stem Cell Ther, 2014, 7(1):1-17.
[7]Dai S, Jia R, Zhang X, et al. The PD-1/PD-Ls pathway and autoimmune diseases[J]. Cell Immunol, 2014, 290(1):72-79.
[8]Dong H, Chen X. Immunoregulatory role of B7-H1 in chronicity of in fl ammatory responses[J]. Cell Mol Immunol, 2006,3(3):179-187.
[9]Wu YY, Cao HH, Kang N, et al. Expression of cellular fi bronectin mRNA in adult periodontitis and peri-implantitis:a real-time polymerase chain reaction study[J]. Int J Oral Sci, 2013, 5(4):212-216.
[10]Blank C, Mackensen A. Contribution of the PD-L1/PD-1 pathway to T-cell exhaustion: an update on implications for chronic infections and tumor evasion[J]. Cancer Immunol Immunother, 2007, 56(5):739-745.
[11]Scandiuzzi L, Ghosh K, Hofmeyer KA, et al. Tissue-expressed B7-H1 critically controls intestinal in fl ammation[J]. Cell Rep,2014, 6(4):625-632.
[12]朱德星, 刘汾, 戴芳, 等. 慢性牙周炎患者外周血T淋巴细胞表面程序性死亡分子1及其配体的表达[J]. 中华口腔医学杂志, 2014, 49(4):216-219.
[13]Mueller SN, Vanguri VK, Ha SJ, et al. PD-L1 has distinct functions in hematopoietic and nonhematopoietic cells in regulating T cell responses during chronic infection in mice[J]. J Clin Invest, 2010, 120(7):2508-2515.
