RAGE-ROS信号轴在糖尿病性牙周炎牙龈上皮凋亡中的作用
2015-10-13黄盛斌戴盼盼毛亦欣李旭敏麻健丰
黄盛斌,戴盼盼,毛亦欣,李旭敏,麻健丰
(温州医科大学附属口腔医院 口腔修复科,浙江 温州 325027)
RAGE-ROS信号轴在糖尿病性牙周炎牙龈上皮凋亡中的作用
黄盛斌,戴盼盼,毛亦欣,李旭敏,麻健丰
(温州医科大学附属口腔医院口腔修复科,浙江温州325027)
目的:研究RAGE-ROS信号轴在糖尿病性牙周炎牙龈上皮细胞凋亡发生中的作用。方法:选用6周龄雄性Wistar大鼠30只,随机分为正常对照组(N组)及糖尿病组(D组)。采用一次性腹腔注射链脲佐菌素(STZ)的方法诱导糖尿病大鼠模型。4周后分批处死,检测牙槽骨丧失、牙龈上皮细胞凋亡水平,晚期糖基化终末产物受体(RAGE)及活性氧(ROS)水平。结果:D组牙槽骨丧失明显高于N组,且牙龈上皮细胞凋亡发生明显增加(P<0.05);D组牙龈组织RAGE及ROS表达水平也高于N组(P<0.05)。结论:RAGE-ROS信号轴在糖尿病性牙周炎牙龈上皮细胞的凋亡中发挥着重要作用,为认识糖尿病性牙周炎的发病机制提供了线索。[关键词] 糖尿病;牙周炎;细胞凋亡;活性氧簇;糖基化终末产物受体
糖尿病性牙周炎是一种易造成牙周组织显著破坏的难治性疾病[1]。牙龈上皮细胞作为牙周组织的第一道屏障,其凋亡的发生贯穿糖尿病性牙周炎的发生、发展[2]。糖基化终末产物(advance glycation ends products,AGEs)-糖基化终末产物受体(receptor of advanced glycation end products,RAGE)在糖尿病并发症的发生、发展中起着关键作用,而体外细胞实验证实,AGEs与RAGE结合,增加细胞内活性氧簇(reactive oxidative stress,ROS)的生成,诱导细胞损伤[3-4],这提示RAGE-ROS信号轴可能参与糖尿病性牙周炎牙龈上皮细胞凋亡的发生。因此,本研究构建I型糖尿病大鼠模型,观察糖尿病对牙槽骨吸收及牙龈上皮细胞凋亡变化的影响,同时检测牙龈组织RAGE及氧化应激水平,为糖尿病性牙周炎软组织病理改变阐释机制。
1 材料和方法
1.1材料 链脲佐菌素(Streptozotocin,STZ,美国Sigma公司),Nikon体式显微镜(SMZ1500),罗氏活力型血糖仪及试纸(瑞士Roche公司),Mitosox Red(美国Invitrogen Life Techonlogy公司),RAGE抗体(英国Abcam公司),DAB试剂盒,TUNEL试剂盒(瑞士Roche公司),磷酸盐缓冲液(PBS),DMSO(美国Sigma公司),4%多聚甲醛(美国Sigma公司),苏木素(北京中杉金桥生物技术有限公司)。
1.2实验动物分组 清洁级雄性Wistar大鼠30只,6周龄,体质量180~220 g,由温州医科大学实验动物中心提供。将实验动物随机分为2组:糖尿病组(D组,n=15)、正常对照组(N组,n=15),动物分笼饲养,自由摄水摄食(标准大鼠饲料)。
1.3糖尿病模型建立 实验动物适应性喂养1周后,禁食12 h,D组大鼠按55 mg/kg体质量腹腔一次性注射STZ(10 mg/mL)。STZ用枸橼酸钠缓冲液(0.1 mol/L,pH4.4)配成1%溶液,N组予以枸橼酸钠缓冲液空白注射。注射后1周检测随机血糖,血糖高于16.65 mmol/L者确定为糖尿病大鼠。注射STZ前及注射后1周、2周、3周及4周检测各组大鼠随机血糖。
1.4标本采集 4周后采用断头法处死大鼠,迅速分离大鼠下颌骨,小心切取完整的下颌舌侧牙龈,放置于PBS溶液中备用;下颌骨浸泡于4%多聚甲醛固定,用于后续检测。
1.5体视显微镜观察下颌后牙牙槽骨的附着丧失面积 采用体视显微镜(×20)检查各组大鼠下颌骨第一磨牙牙槽骨附着丧失(alveolar bone loss,ABL)。每颗牙分别测量近颊、中颊、远颊、近腭、中腭、远腭6个位点,取6个位点测量值的均值作为此牙的ABL值。
1.6牙龈线粒体活性氧荧光探针检测 按产品说明,配置Mitosox Red工作液(5 μmol/L),将右侧下颌牙龈组织浸泡于该工作液,室温下避光平缓摇动孵育30 min,PBS漂洗5 min×3次。4%多聚甲醛固定过夜,30%蔗糖置换后,冰冻切片包埋、切片,激光共聚焦显微镜(Nikon A1)观察并拍照。Mitosox red荧光探针可以直接反映组织中的线粒体ROS的生成情况。荧光染色强度越高,则表示氧化应激状态越高。
1.7免疫组织化学染色 左下颌舌侧牙龈4%多聚甲醛固定过夜后,30%蔗糖置换,冰冻切片包埋、切片,按免疫组织化学染色步骤,常规去除内源性过氧化酶、封闭、滴加I抗(RAGE,1∶300)过夜,漂洗,滴加I I抗(辣根过氧化物酶标记的,1∶500稀释),室温1 h,PBS漂洗5 min×3次,DAB显色,苏木素复染,脱水、透明、封片、镜检。
1.8牙龈组织细胞凋亡检测 左下颌舌侧牙龈组织切片采用TUNEL凋亡试剂盒检测牙龈组织细胞凋亡情况(按试剂盒说明书操作);并复染DAPI(4',6-diamidino-2-phenylindole,dihydrochloride),激光共聚焦显微镜观察,随机选取5个镜下视野计数凋亡细胞,并进行统计学分析。
1.9统计学处理方法 采用SPSS 11.5统计学软件进行分析。计量数据用±s表示,用成组t检验比较2组各个指标的差异。P<0.05为差异有统计学意义。
2 结果
2.12组血糖检测结果 注射STZ后1周,D组大鼠均达到糖尿病模型标准(血糖>16.65 mmol/L),且血糖一直持续>16.65 mmol/L。见表1。
2.22组牙槽骨吸收情况 与N组比,D组下颌第一磨牙后牙ABL值增加,差异有统计学意义(P=0.01)。见图1。
2.22组氧化应激水平比较 与N组比较,D组大鼠牙龈组织线粒体ROS红色荧光明显增强,差异有统计学意义(P=0.03)。见图2。
2.32组RAGE表达比较 RAGE免疫组织化学染色显示,D组大鼠牙龈组织RAGE表达增加,牙龈上皮细胞细胞膜棕褐色着色明显,而N组无明显着色,2组间差异有统计学意义(P=0.01),见图3。
2.42组细胞凋亡水平比较 TUNEL染色显示,与正常大鼠相比,糖尿病大鼠牙龈组织凋亡细胞数量明显增加,差异有统计学意义(P=0.03),见图4。
3 讨论
表1 2组大鼠血糖变化情况(n=15,,mmol/L)

表1 2组大鼠血糖变化情况(n=15,,mmol/L)
与N组比:aP<0.05
组别注射STZ后各时间点0周 1周 2周 3周 4周N组 4.433±0.153 5.167±0.252a 5.200±0.529a 5.133±0.723a 5.367±0.666aD组 4.914±0.434 27.800±2.795a 25.271±2.801a 26.143±1.731a 29.443±2.607a
糖尿病性牙周炎的发生、发展及防治在牙周病研究中倍受关注[1]。WHO最新公布的数据表明,2012年全球糖尿病患者的人数已超过3.7亿,预计2030年将增至5.52亿[3]。这些数据揭示了全世界均面临着糖尿病大幅度增长的巨大威胁,并有扩大化和年轻化的趋势。因此,构建理想的糖尿病动物模型,模拟糖尿病的发病因素、病理过程和临床特征,对于研究糖尿病及其并发症的发病机制及防治方法具有重要的现实意义。
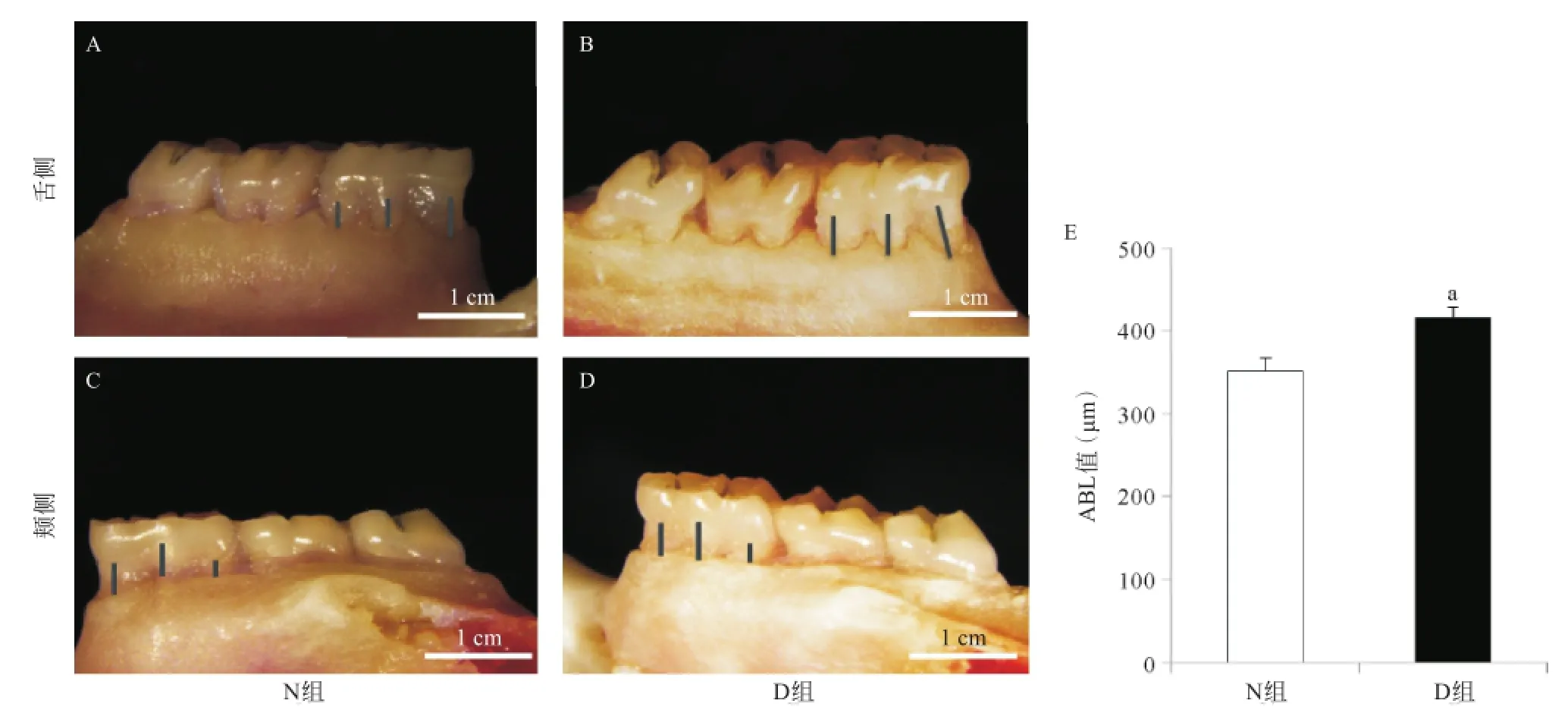
图1 2组大鼠下颌骨牙槽骨吸收情况
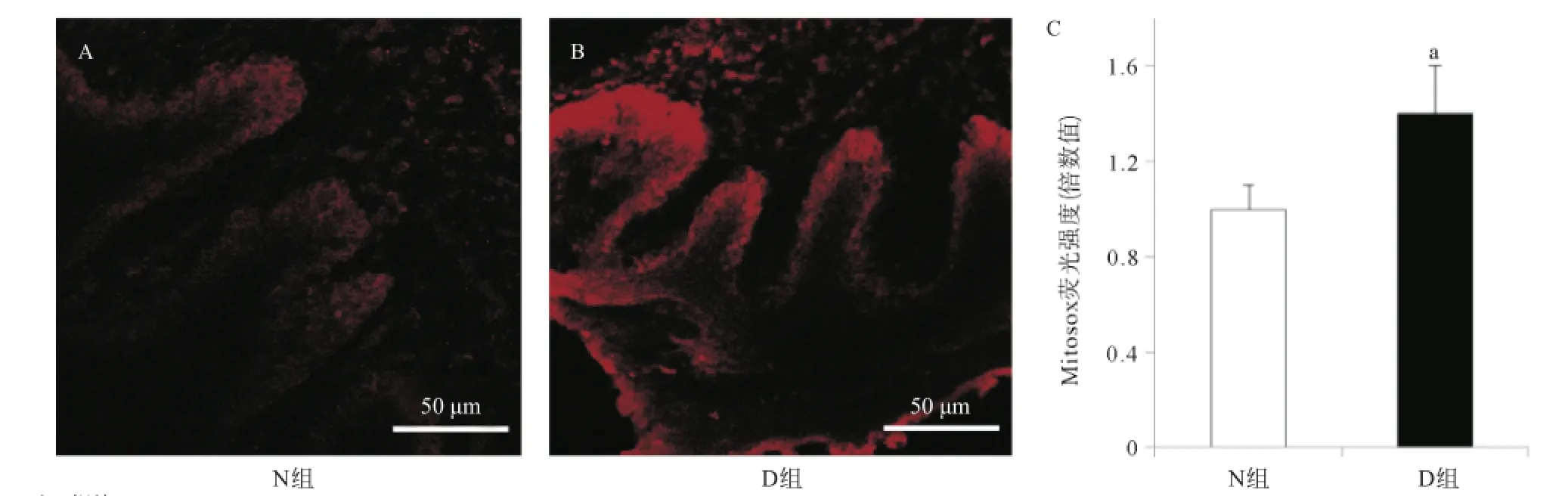
图2 牙龈组织Mitosox染色(×600)
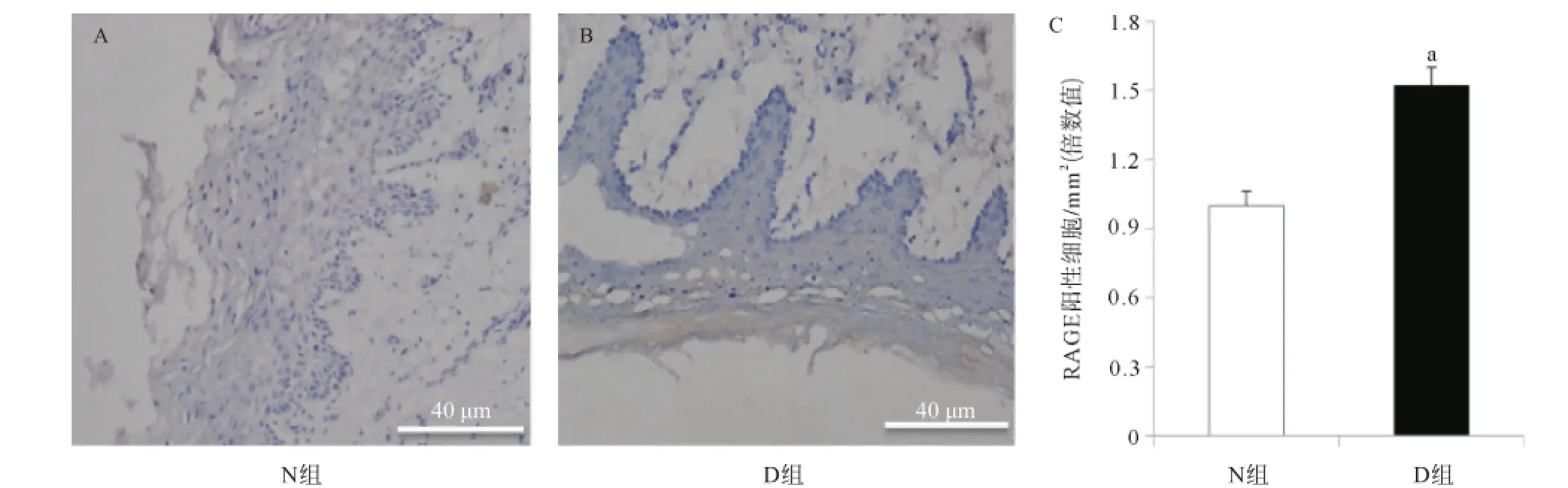
图3 牙龈组织RAGE免疫组织化学染色(×200)
目前国内外已有多种构建糖尿病动物模型的方法,主要分为自发性遗传性动物模型和实验性动物模型。在本研究中,利用STZ构建I型糖尿病模型,建模成功后随机血糖一直保持在>16.65 mmol/L水平,明显高于对照组。整个实验期间糖尿病大鼠摄食量、饮水量和尿量增多,随着病程进展,还出现失去光泽、脱毛、消瘦等与人类糖尿病相似的症状。这些均表明糖尿病大鼠建模成功,且具有良好的长期稳定性。另外,为直接研究糖尿病单一因素引起的牙槽骨吸收,本实验未使用结扎线或细菌涂布制造牙周炎的方法,减少了机械及菌斑诱发牙周炎发生的影响因素。
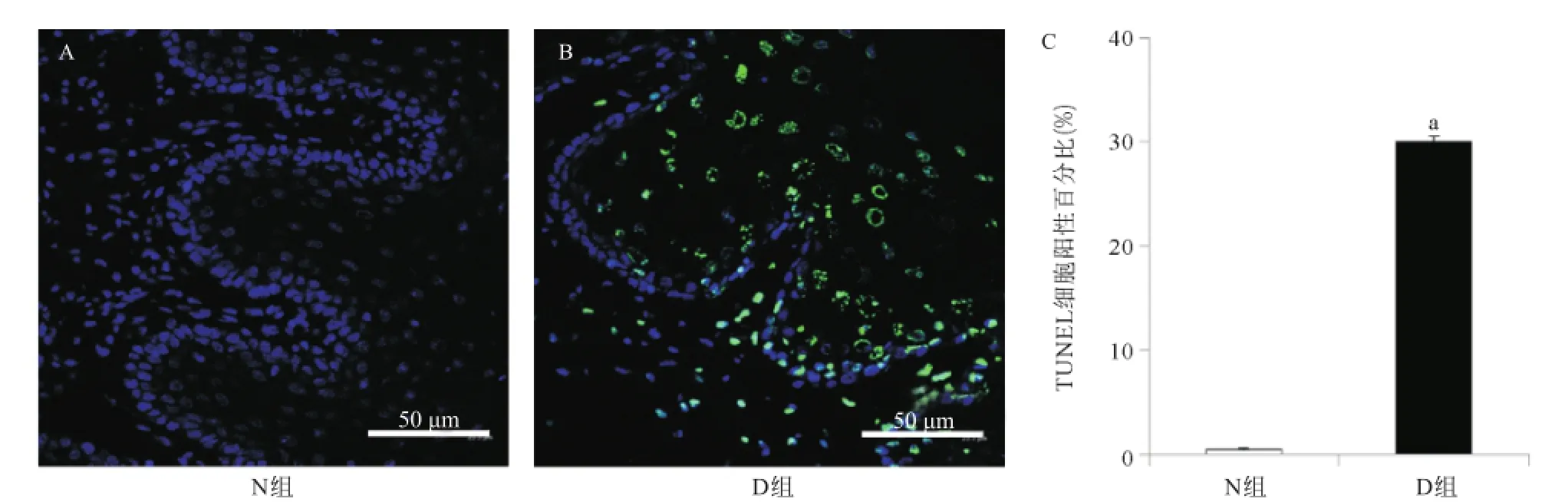
图4 牙龈组织TUNEL染色(×600)
糖尿病病理状态下,AGEs加速形成并积聚于各个组织中,同时促进其受体RAGE的激活和上调[4-5]。本研究对牙龈组织进行免疫组织化学染色发现,糖尿病牙龈组织RAGE表达增加。Katz等[6]通过对伴有或不伴有糖尿病的牙周炎患者的牙龈组织进行RTPCR检测,发现前者比后者牙龈组织中RAGE mRNA的表达增加了50%,认为AGEs与RAGE的相互作用对牙周组织产生损伤,这一结果与本实验研究结果一致,进一步证实了RAGE参与了糖尿病性牙周炎的发生、发展。
体外细胞实验证实,RAGA与AGEs相互作用能促进还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶的激活[7],导致细胞氧化-抗氧化防御系统失衡,造成ROS生成增多,促进炎性递质释放,参与牙周炎发生、发展。而临床实验发现糖尿病患者牙周组织的氧化应激水平比非糖尿病患者明显增加[8-9],这与本研究Mitosox的染色结果一致。Mitosox为线粒体ROS的标志物染色,这提示糖尿病可能直接影响牙周组织线粒体功能。而最新研究发现慢性牙周炎的牙周组织线粒体ATP水平下降,线粒体酶活性降低[10],因此,可以推断线粒体功能障碍及氧化应激在糖尿病性牙周炎的发病中可能起着关键作用。
Graves等[11]对糖尿病加重牙周组织破坏的内在机制进行了大量研究,认为糖尿病引起TNF-α等炎症递质表达增加可通过加强基质生成细胞的凋亡影响组织愈合。付永伟等[12-13]建立糖尿病牙周炎动物模型,发现糖尿病可促进炎症过程中骨细胞的凋亡,增加牙周炎骨丧失,同时可加强牙周炎条件下牙周膜中成纤维细胞的凋亡来促进牙周组织破坏。邓天政等[14]构建糖尿病牙周炎动物模型,发现牙周组织成骨细胞及牙周膜成纤维细胞凋亡数量显著高于对照组,并发现RAGE在牙周膜成纤维细胞中表达增加,提示RAGE可引起牙周细胞的凋亡从而参与组织损伤。在本研究中,D组大鼠牙龈组织凋亡细胞显著高于N组,且RAGE及氧化应激水平明显增加,这进一步提示RAGE-ROS参与了糖尿病性牙周炎中牙龈上皮细胞细胞凋亡,但其具体的机制还需进一步明确。
本研究发现,糖尿病大鼠牙龈组织中RAGE表达上调,氧化应激水平增加,这一病理改变参与并促进糖尿病性牙周炎牙龈上皮细胞凋亡的发生,最终诱发牙槽骨的吸收。因而,RAGE-ROS信号轴可能成为调控糖尿病性牙周炎发生、发展的新靶点。
[1]Taylor JJ, Preshaw PM, Lalla E. A review of the evidence for pathogenic mechanisms that may link periodontitis and diabetes[J]. Clin J Periodontol, 2013, 40 suppl 14: S113-134.
[2]Desta T, Li J, Chino T, et al. Altered fibroblast proliferation and apoptosis in diabetic gingival wounds[J]. J Dent Res,2010, 89(6): 609-614.
[3]International Diabetes Federation. (2012) IDF Diabetes Atlas[R]. 5th ed. International Diabetes Federation, 2012.
[4]Cipollone F, Iezzi A, Fazia M, et al. The receptor RAGE as a progression factor amplifying arachidonate-dependent inflammatory and proteolytic response in human atherosclerotic plaques: role of glycemic control[J]. Circulation, 2003,108(9): 1070-1077.
[5]Ramasamy R, Vannucci SJ, Yan SS, et al. Advanced glycation end products and RAGE: a common thread in aging, diabetes, neurodegeneration, and inflammation[J]. Glycobiology, 2005, 15(7): 16-28.
[6]Katz J, Bhattacharyya I, Farkhondeh-Kish F, et al. Expression of the receptor of advanced glycation end products in gingival tissue of type 2 diabetes patients with chronic periodontal disease: a study utilizing immunohistochemistry and RT-PCR[J]. J Clin Periodontol, 2005, 32(1): 40-44.
[7]Thomas MC, Forbes JM, Cooper ME. Advanced glycation end products and diabetic nephropathy[J]. Am J Ther,2005, 12(6): 562-572.
[8]Schmidt AM, Weidman E, Lalla E, et al. Advanced glycation end products (AGEs) induce oxidant stress in the gingiva: a potential mechanism underlying accelerated periodontal disease associated with diabetes[J]. J Periodontal Res, 1996, 31 (7): 508-515.
[9]Takeda M, Ojima M, Yoshioka H, et al. Relationship of serum advanced glycation end products with deterioration of periodontitis in type 2 diabetes patients[J]. J Periodontol, 2006,77(1): 15-20.
[10] Govindaraj P, Khan NA, Gopalakrishna P, et al. Mitochondrial dysfunction and genetic heterogeneity in chronic periodontitis [J]. Mitochondrion, 2011, 11(3): 504-512.
[11] Graves DT, Liu R, Alikhani M, et al. Diabetes enhanced inflammation and apotosis-impact on periodontal pathology[J]. J Dent Res, 2006, 85(1): 15-21.
[12] 付永伟, 和红兵, 欧炯光. 实验性糖尿病牙周炎诱导骨细胞凋亡的初步研究[J]. 现代口腔医学杂志, 2009, 23(5):500-504.
[13] 付永伟, 和红兵, 欧炯光. 实验性糖尿病牙周炎牙周膜中成纤维细胞凋亡的初步研究[J]. 实用口腔医学杂志, 2010,26(3): 310-314.
[14] 邓天政, 吕晶, 逢键梁, 等. 细胞凋亡在糖尿病大鼠牙周炎中参与牙槽骨吸收的实验研究[J]. 北京口腔医学, 2010,18(5): 257-260.
(本文编辑:吴彬)
The role of RAGE-ROS axis in the apoptosis of gingival fibroblast in diabetic periodontitis
HUANG Shengbin, DAI Panpan, MAO Yixin, LI Xumin, MA Jianfeng. Department of Prosthodontics, Hospital of Stomatology Wenzhou Medical University, Wenzhou, 325027
Objective: To investigate the role of RAGE-ROS axis in the apoptosis of gingival fibroblast in diabetic periodontitis. Methods: Thirty wistar rats (male, six weeks old) were randomly divided into two groups: normal control group (N) and diabetic periodontitis group (D). Four weeks later, animals were sacrificed; meanwhile, the alveolar bone loss and apoptosis of gingival fibroblast were detected while the expression of RAGE and oxidative stress marker were also investigated. Results: Compared to N group, more severe alveolar bone loss, along with more apoptosis of gingival fibroblast appeared in D group (P<0.05). The expression of RAGE and oxidative stress marker increased significantly in gingival tissue in D group (P<0.05). Conclusion: RAGEROS axis plays an important role in the apoptosis of gingival fibroblast in diabetic periodontitis.
diabetes; periodontitis; apoptosis; reactive oxidative stress; receptor of advanced glycation end products
R781.4
A DOI: 10.3969/j.issn.2095-9400.2015.12.002
2015-11-16
国家自然科学基金资助项目(81500817);浙江省自然科学基金资助项目(LY15H140008);温州市公益技术研究医学项目(Y20140708)。
黄盛斌(1982-),男,浙江庆元人,讲师,博士。
麻健丰,教授,Email:dentistmacn@aliyun.com。
