丙泊酚对大鼠S1区锥体神经元电压门控钠离子通道及动作电位的影响
2015-10-13何炯策张宇刘兴奎喻田
何炯策,张宇,刘兴奎,喻田
(1.温州医科大学附属第二医院 麻醉科,浙江 温州 325027;2.遵义医学院 麻醉学系,贵州 遵义563003)
·论 著·
丙泊酚对大鼠S1区锥体神经元电压门控钠离子通道及动作电位的影响
何炯策1,张宇2,刘兴奎2,喻田2
(1.温州医科大学附属第二医院麻醉科,浙江温州325027;2.遵义医学院麻醉学系,贵州遵义563003)
目的:观察丙泊酚对大鼠感觉皮层(S1)区神经元电压门控钠离子通道及动作电位的影响。方法:制备SD大鼠(鼠龄7~14 d)脑片,采用全细胞膜片钳技术测定电流及电压。加入不同浓度(10、30、100、300 μmol/L)丙泊酚,记录各组神经元钠电流(INa),绘制电流电压(IV)曲线、稳态激活曲线、稳态失活曲线及去失活曲线并计算相关参数。向神经元施加幅度50 pA、刺激时程30 ms的去极化刺激电流,记录各组神经元动作电位。结果:丙泊酚呈浓度依赖性抑制大鼠S1区神经元电压门控性INa,加快钠通道的失活过程,使稳态失活曲线向超极化方向移动,延缓钠通道失活后的恢复,但并不影响钠通道的激活过程。丙泊酚呈浓度依赖性(浓度为10、30、100 μmol/L)抑制大鼠S1区神经元动作电位的超射值(P<0.01),对电位阈值有一定的影响(100 μmol/L,P<0.01),300 μmol/L的丙泊酚可以完全抑制动作电位的形成。结论:丙泊酚对大鼠丘脑皮层环路中的S1区神经元电压门控钠离子通道及动作电位具有抑制作用,可能是其诱导的全身麻醉作用的机制之一。[关键词] 丙泊酚;膜片钳;钠通道;动作电位;大鼠
相关研究显示,全麻药物通过影响大脑和脊髓关键区域的突触传递和离子通道发挥作用[1-2],且药物的中枢抑制作用与各脑区之间信息的传递、处理、整合及分离过程密切相关[3-4]。目前对丙泊酚全麻机制的研究主要集中在其对大鼠海马、丘脑、脊髓等的影响,对皮层神经元电生理学的作用研究报道则较少,其诱导的全身麻醉作用与皮层电压门控离子通道是否有关尚需进一步探讨。初级躯体感觉皮层(S1)是大鼠丘脑皮层环路中躯体感觉信息传递的关键脑区之一,本实验拟使用脑片膜片钳技术,采用全细胞记录模式,检测不同浓度丙泊酚对大鼠S1区锥体神经元电压门控钠离子通道及动作电位的影响。
1 材料和方法
1.1材料 动物:健康SD大鼠,SPF级,鼠龄7~14 d,雌雄不拘。药品与试剂:丙泊酚(阿斯利康公司),河豚毒素(TTX,Sigma公司),人工脑脊液(ACSF):126 NaCl,2.5 KCl,2 CaCl2,2 MgSO4· 7H2O,1.5 NaH2PO4·2H2O,25 NaHCO3,10 Glucose· H2O(mmol/L);钠离子通道记录电极内液:140 CsCl,5 NaCl,1 CaCl2,10 HEPES,10 EGTA,2 MgCl2·6H2O,2 Na2-ATP(mmol/L);动作电位记录电极内液:120 KCl,1 CaCl2,10 HEPES,10 EGTA,2 MgCl2·6H2O,3 Na2-ATP(mmol/L)。仪器:EPC10膜片钳放大器,德国HEKA公司;PCS-5400微电极操纵器,美国Burleigh公司;BX51W1-IR7显微镜,日本Olympus公司;HM 650V全自动振动式切片机,美国Thermo公司;P-97微电极拉制仪,美国Sutter公司。
1.2方法
1.2.1分组方法:设立对照组(Control组)和实验组,Control组脑片灌流普通ACSF,实验组脑片根据ACSF中所含丙泊酚浓度的不同分为:丙泊酚10 μmol/L(Pro10组),丙泊酚30 μmol/L(Pro30)组,丙泊酚100 μmol/L(Pro100)组及丙泊酚300 μmol/L(Pro300)组,各组脑片例数为8(n=8)。
1.2.2脑片的制备方法:健康SD大鼠乳鼠快速断头,快速剥出全脑置于氧混合气(95% O2+5% CO2)饱和的0~4 ℃的ACSF中5 min。使用Thermo HM 650V全自动振动式切片机沿冠状面制备出包含S1区厚度为300 μm的脑切片,置于脑片孵育槽中。在控制32 ℃下平衡孵育30 min,复温30 min。
1.3统计学处理方法 采用PatchMaster软件记录电信号,FitMaster、SPSS 19.0、Origin7.5统计软件进行数据提取、统计分析和图表绘制。所得数据均用±s表示,组间比较用单因素方差分析。钠通道的激活:利用公式G=I/(V-Vrev)将所得的钠电流峰值转换成电导值,以电导值与最大电导值的比值及对应膜电位绘制出各组钠通道的稳态激活曲线。用Boltzmann方程G/Gmax=1/{1+exp[V-V1/2]/κ}进行拟合,式中G为电导,V为膜电位,V1/2为半数激活电压,κ为曲线斜率因子。钠通道的失活使用Boltzmann方程I/Imax=1/{1+exp[V-V1/2]/κ}进行拟合,求得半数失活电压和曲线斜率因子。钠通道去失活根据单指数方程I/Imax=1-exp(-t/γ)进行拟合,式中I和Imax分别为不同恢复时间的电流大小和条件脉冲诱发的电流,t为恢复时间,γ为通道恢复的时间常数。P<0.05为差异有统计学意义。
2 结果
2.1S1区锥体神经元电压门控钠离子通道电流图
采用钠通道的细胞外液和电极内液,全细胞记录模式形成后,置钳制电位于-80 mV,给予神经元一幅度-30 mV,刺激时程20 ms的去极化脉冲刺激电压可诱发一快速激活与失活的内向电流,该电流可被1 μmol/L的钠通道阻断剂TTX所阻断,证实其为TTX敏感的INa,见图1。
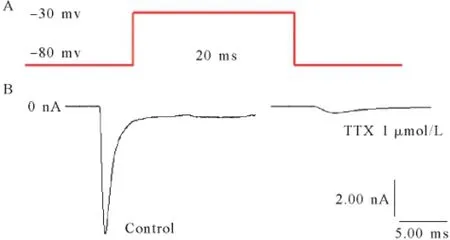
图1 TTX对大鼠S1区锥体神经元INa的阻断作用
2.2丙泊酚对电压门控钠通道IV曲线的影响 置钳制电位于-80 mV,给予脉冲幅度为-80 mV~+60 mV,脉冲宽度20 ms,步幅+10 mV的去极化脉冲刺激电压,可激发一系列INa,见图2。以不同膜电位为横轴,该膜电位下的INa峰值为纵轴,绘制INa的IV曲线。丙泊酚作用稳定后,INa的IV曲线显著上移,但INa的激活阈电位没有明显变化(约-60 mV),且在-30 mV能够激发最大INa,见图3。随着丙泊酚浓度的升高,INa峰值呈浓度依赖性下降,见图4。
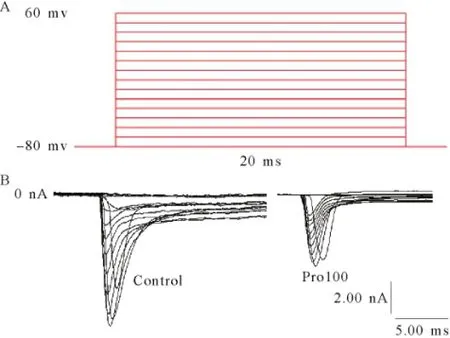
图2 钠通道电流的刺激方波和记录的电流曲线
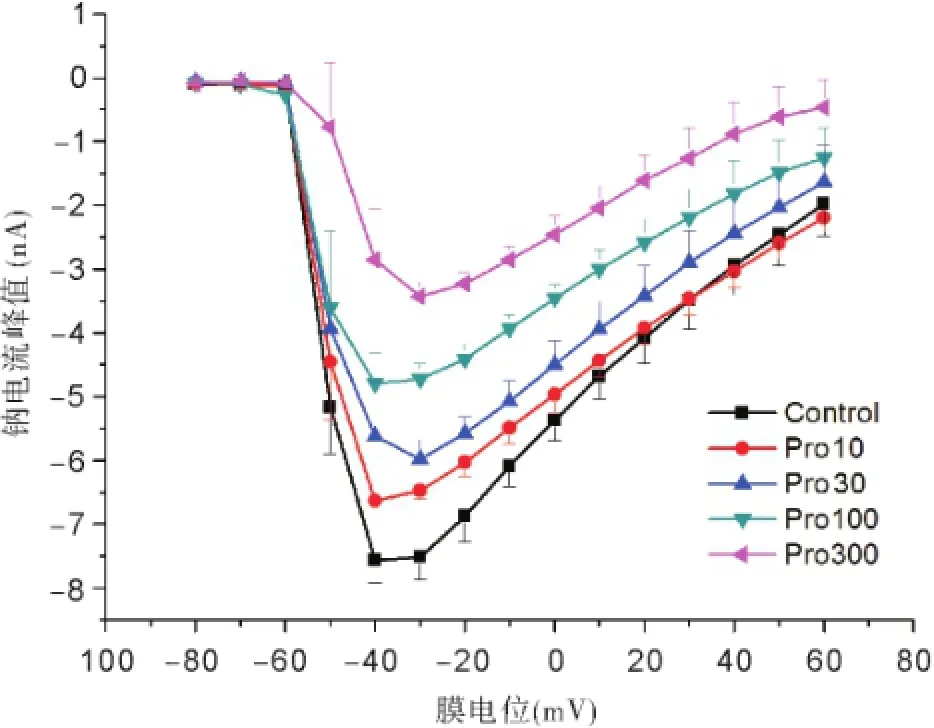
图3 各组电压门控钠通道电流IV曲线
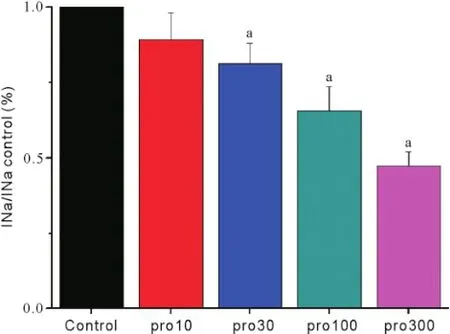
图4 各组对钠通道电流峰值的抑制
2.3丙泊酚对电压门控钠通道激活及失活的影响
置钳制电位于-80 mV,预置-120 mV超极化电压500 ms,然后从-80 mV起给予10 mV步幅递增,12 ms脉宽的去极化脉冲刺激至0 mV,记录各组神经元INa变化,见图5。以电导值与最大电导值的比值及对应膜电位绘制出各组钠通道的稳态激活曲线,见图6。INa稳态激活曲线均呈S型,与正常组曲线相比,其他各组曲线没有明显的移位,INa的半数激活电压V1/2及斜率因子κ也未发生显著变化,见表1。置钳制电位-100 mV,先给予-100~-10 mV,步幅10 mV,刺激波宽500 ms的阶梯钳制预脉冲刺激,间隔1 ms之后,再给予-30 mV的测试脉冲刺激,刺激波宽12 ms,记录各组测试脉冲下钠通道电流,见图7。以电流值与最大电流值的比值及对应膜电位绘制出各组INa的稳态失活曲线,见图8。各组钠通道电流稳态失活曲线均呈反S型,与正常组曲线相比,其他各组曲线向左(超极化方向)移位。丙泊酚呈浓度依赖性加快钠通道电流的失活,使失活曲线向超级化方向移动,除Pro300组外基本上不改变曲线斜率因子。
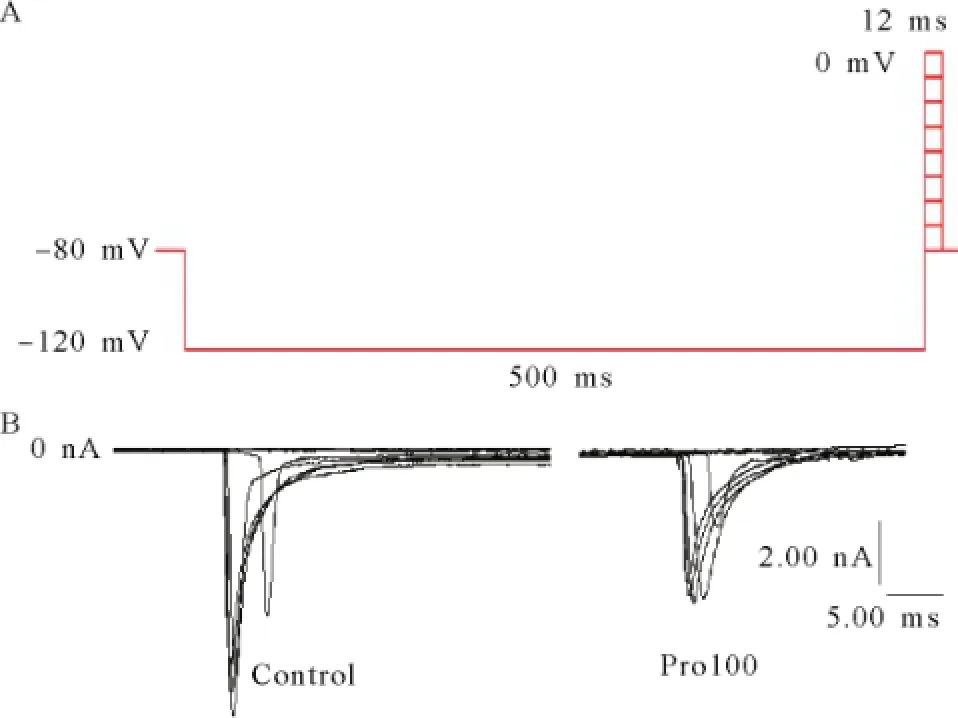
图5 钠通道电流激活的刺激方波和记录的电流曲线
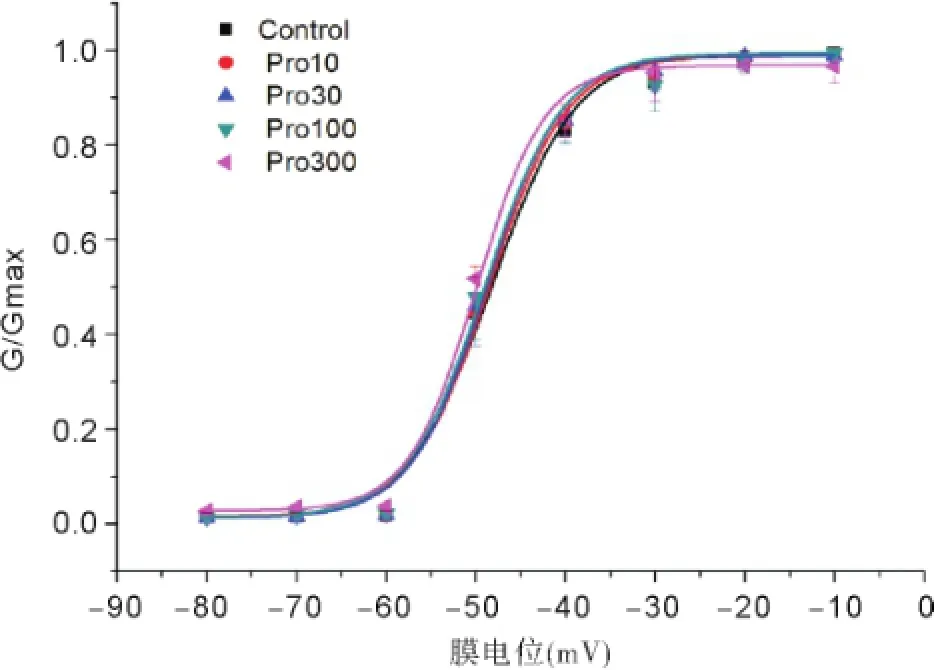
图6 各组电压门控钠通道电流稳态激活曲线
表1 各组INa半数激活电压和激活斜率因子(n=8)
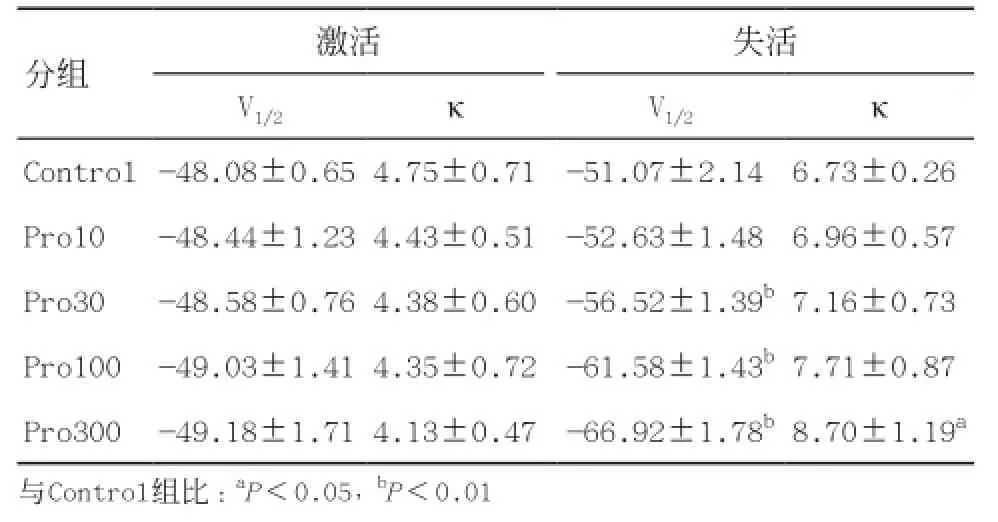
表1 各组INa半数激活电压和激活斜率因子(n=8)
分组 激活 失活V1/2 κ V1/2 κ Control-48.08±0.65 4.75±0.71 -51.07±2.14b6.73±0.26bPro10 -48.44±1.23 4.43±0.51 -52.63±1.48b6.96±0.57bPro30 -48.58±0.76 4.38±0.60 -56.52±1.39b7.16±0.73bPro100 -49.03±1.41 4.35±0.72 -61.58±1.43b7.71±0.87bPro300 -49.18±1.71 4.13±0.47 -66.92±1.78b8.70±1.19a与Control组比:aP<0.05,bP<0.01
2.4丙泊酚对电压门控钠通道去失活的影响 置钳制电位于-80 mV,给予-10 mV的条件脉冲12 ms,然后给予-10 mV的去极化测试脉冲20 ms,两个刺激间隔保持钳制在-80 mV,间隔时程从2~20 ms,刺激间隔2 ms,记录各组INa变化,见图9。与正常组曲线相比,其他各组曲线下移,曲度逐渐减小,见图10。各组的通道恢复时间常数随着丙泊酚浓度增加而逐渐延长,见图11。
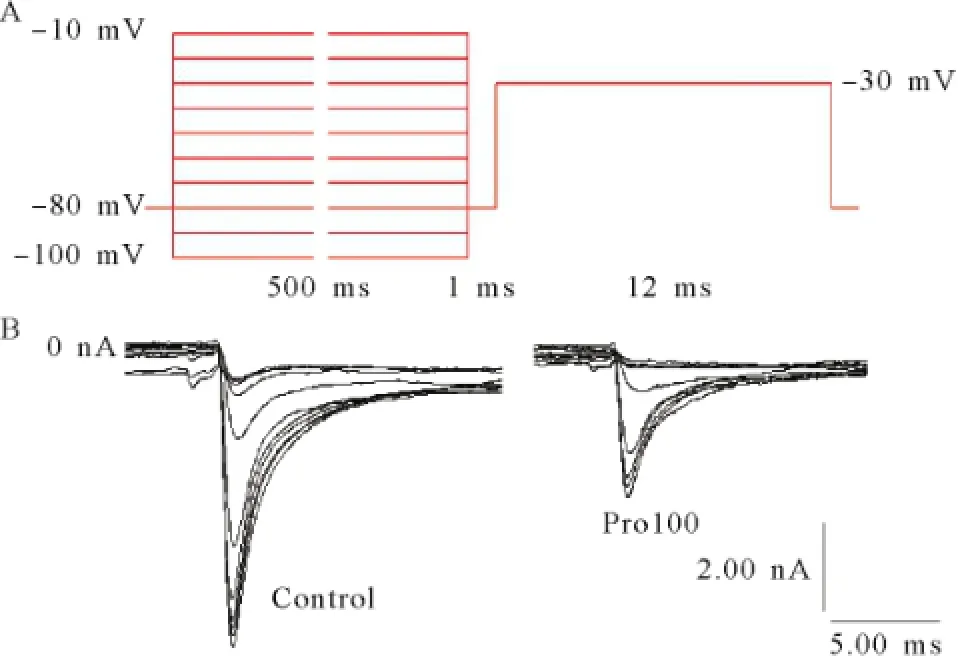
图7 钠通道电流失活的刺激方波和记录的电流曲线
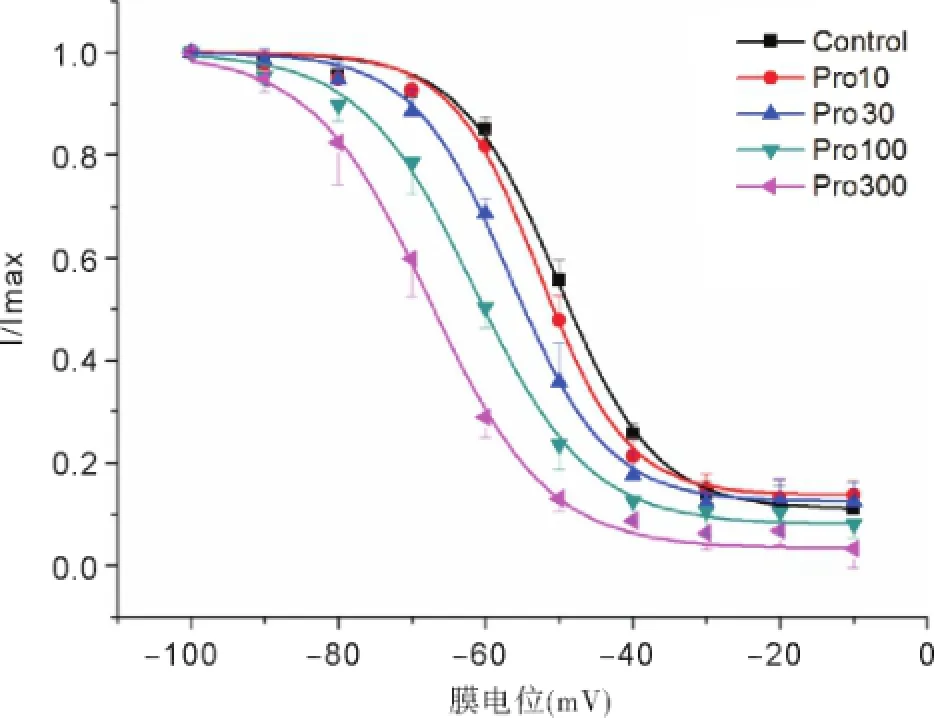
图8 各组电压门控钠通道电流稳态失活曲线
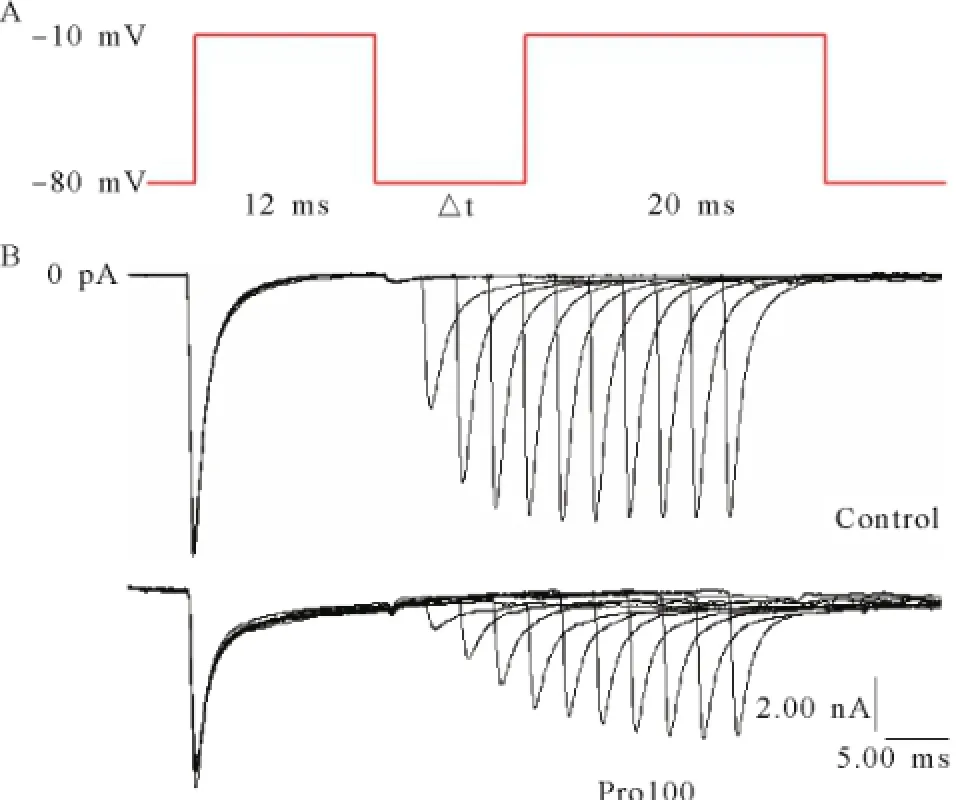
图9 钠通道去失活的双脉冲刺激方波和记录的电流曲线
2.5丙泊酚对神经元由单刺激引发的动作电位的影响 全细胞记录模式形成后,在电流钳模式下,给予神经元一幅度50 pA,刺激时程30 ms的去极化脉冲刺激电流,诱发动作电位发放,见图12。300 μmol/L组的丙泊酚可以完全抑制动作电位的形成,只形成刺激电流引起的电紧张,因此Pro300组相关数据不予统计分析。结果显示丙泊酚使神经元动作电位的幅度(超射值)呈浓度依赖性下降,除Pro100组外基本上不改变其阈值,见表2。
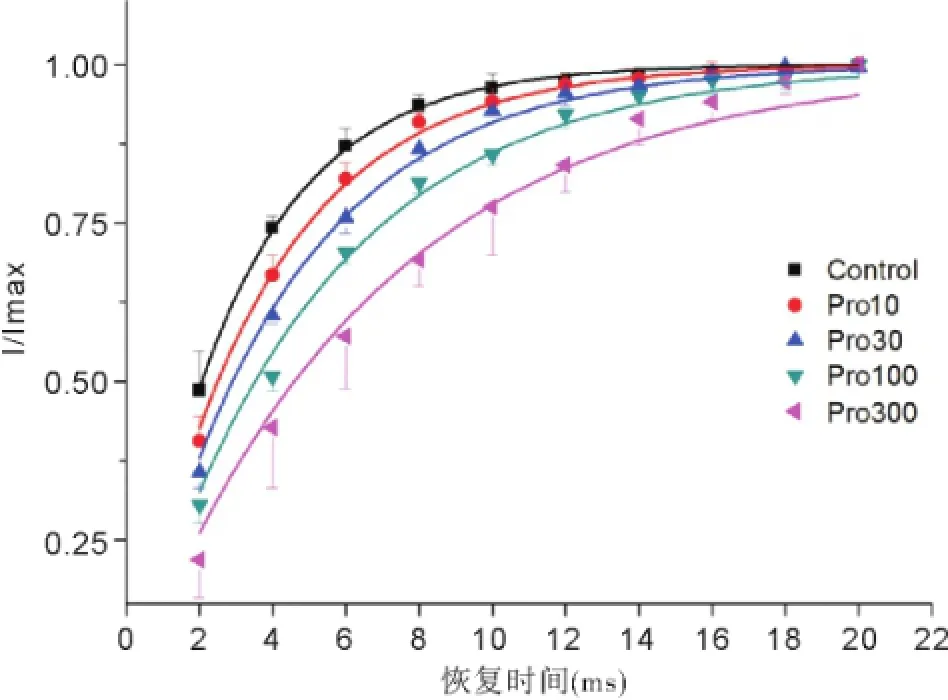
图10 各组电压门控钠通道失活后的恢复曲线
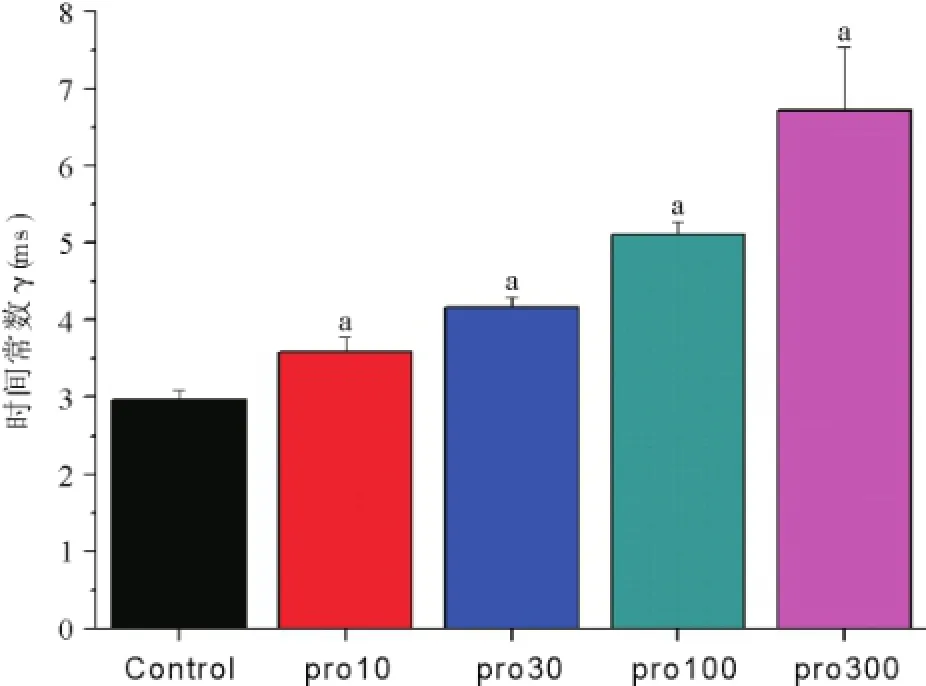
图11 各组电压门控钠通道失活后恢复的时间常数
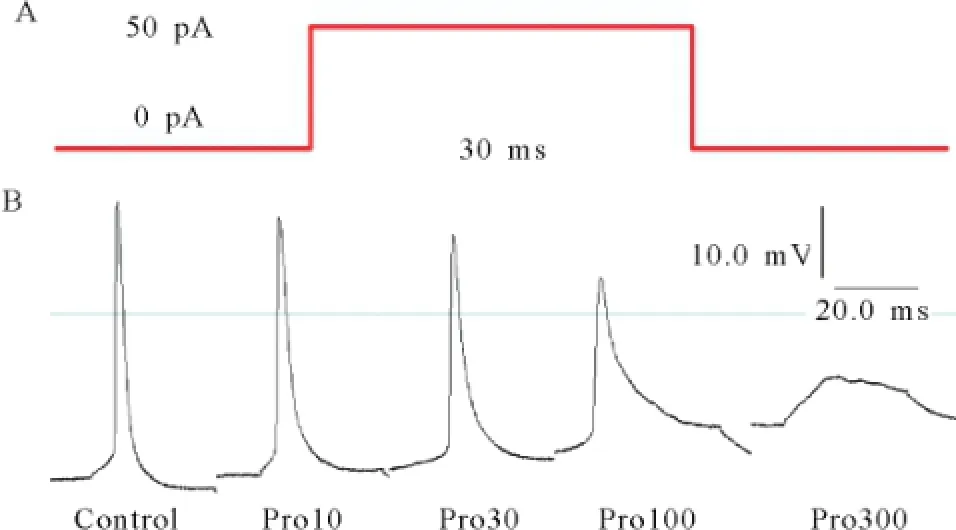
图12 丙泊酚对大鼠S1区神经元动作电位的影响
3 讨论
全身麻醉药物在中枢系统存在多个作用靶点,目前认为麻醉药物通过影响神经系统中的突触传递和离子通道的状态,抑制兴奋性神经元传递并加强抑制性神经元传递[5]。实验结果表明,丙泊酚对大鼠S1区神经元电压门控钠通道存在抑制作用,一方面以浓度依赖性的方式抑制钠通道电导,降低INa,另一方面通过改变通道动力学特性,加快通道的失活,延缓通道的去失活。丙泊酚虽然不影响钠通道的激活过程,但各组丙泊酚均使钠通道失活曲线向左移动,半数失活电压逐渐向超级化方向变化,说明丙泊酚能促进钠通道的失活,减少神经元细胞膜上可激活的钠通道数量,从而减少神经冲动的产生和传导,达到中枢抑制作用。同时,丙泊酚呈浓度依赖性延长钠通道失活后的恢复时间,通过延缓通道失活后的恢复过程,减弱神经元对刺激的反应性,使细胞兴奋性降低。这些结果表明丙泊酚可能通过作用于钠通道的不同位点或者他们的调节器发挥其对通道的不同效应,最终产生全麻效应。
表2 各组动作电位特性(n=8,mV)
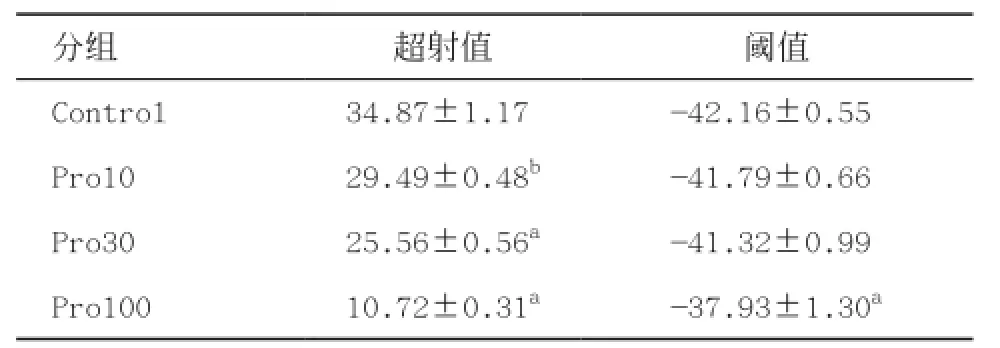
表2 各组动作电位特性(n=8,mV)
与Control组比:aP<0.01
分组 超射值 阈值Control 34.87±1.17b -42.16±0.55bPro10 29.49±0.48b -41.79±0.66bPro30 25.56±0.56a -41.32±0.99bPro100 10.72±0.31a -37.93±1.30a
离子通道是生物体内信息传递的基本单位,是细胞兴奋性的基础。动作电位是可兴奋性细胞兴奋标志,是细胞生命活动的基础。钠通道开放引起去极化内向电流是动作电位产生和传递的基础,是中枢神经系统神经元之间、各脑区间进行信息交流和调控的必要条件。本研究结果显示丙泊酚呈浓度依赖性抑制大鼠S1区神经元动作的超射值并对电位阈值产生了一定的影响,这种抑制则是通过影响钠通道来实现的。丙泊酚能抑制钠通道电流,INa的强度则决定动作电位的幅值,因此动作电位的超射值随丙泊酚浓度的增加而显著下降。另一方面丙泊酚通过加快通道失活和对电流的抑制共同影响动作电位的去极化。动作电位的传导速度和幅度与钠通道的功能状态和钠离子驱动力等因素有关,丙泊酚可改变动作电位的传导特性并使神经元兴奋性下降。
目前的神经生物学理论认为,意识的产生是大范围、各层次的脑神经共同参与的结果,包括皮层、丘脑和中脑(主要为脑干网状结构上行激活系统)在内的各脑区必须共同参与对外界信号刺激的识别和处理,而最终产生意识。感觉信息的处理加工在意识的形成过程中起着至关重要的作用[6],各种感觉信息需要经过脑干的相应核团传输到丘脑腹侧基底复合体,然后传递到初级感觉皮质区,最后扩散到邻近的感觉联合皮质区及额叶联合皮质[7]。中枢整体整合的观点认为意识觉醒的状态与整个中枢神经系统信号转导网络整合活动有关[8]。全麻药物对这种整合活动的抑制或阻断可能最终导致了意识的消失。整个神经系统内部存在着神经元之间、各脑区间复杂的信息交流方式,提示药物的作用位点应该是多水平、多方面的,任何单一的位点或作用机制不能解释麻醉的整体效应[9]。本研究显示丙泊酚对皮层神经元电压门控钠通道及动作电位存在抑制作用,该抑制效应可能通过传入、传出神经纤维各种方式的级联、整合而影响相关的脑区,发挥更广泛的中枢效应。
综上所述,丙泊酚对大鼠丘脑皮层环路中的S1区神经元电压门控钠离子通道及动作电位具有抑制作用,可能是其诱导的全身麻醉作用的机制之一。
[1]Kopp Lugli A, Yost CS, Kindler CH. Anaesthetic mechanisms: update on the challenge of unravelling the mystery of anaesthesia[J]. Eur J Anaesthesiol, 2009, 26(10): 807-820.
[2]Nau C. Voltage-gated ion channels[J]. Handb Exp Pharmacol, 2008, 182(1): 85-92.
[3]Alkire MT, Hudetz AG, Tononi G. Consciousness and anesthesia[J]. Science, 2008, 322(5903): 876-880.
[4]Barrett AB, Murphy M, Bruno MA, et al. Granger causality analysis of steady-state electroencephalographic signals during propofol-induced anaesthesia[J]. PLoS One, 2012,7(1): e29072.
[5]Lingamaneni R, Hemmings HC Jr. Differential interaction of anaesthetics and antiepileptic drugs with neuronal Na+channels, Ca2+channels, and GABAA receptors[J]. Br J Anaesth, 2003, 90(2): 199-211.
[6]Varela F, Lachaux JP, Rodriguez E, et al. The brainweb: phase synchronization and large-scale integration[J]. Nat Rev Neurosci, 2001, 2(4): 229-239.
[7]Kimura A, Yokoi I, Imbe H, et a1. Auditory thalamic reticular nucleus of the rat: anatomicaI nodes for modulation of auditory and cross-modal sensory processing in the loop connectivity between the cortex and thalamus[J]. J Comp Neurol, 2012, 520(7): 1457-1480.
[8]曹云飞, 俞卫锋, 王士雷. 全麻原理及研究新进展[M]. 北京:人民军医出版社, 2005: 329.
[9]Pittson S, Himmel AM, Maclver MB. Multiple synapitic and membrane sites of anesthetic action in the CA1 region of rat hippocampal slices[J]. BMC Neurosci, 2004, 5: 52.
(本文编辑:吴彬)
Effects of propofol on voltage-gated sodium channels and single action potention of S1 neurons in rats
HE Jiongce1, ZHANG Yu2, LIU Xingkui2, YU Tian2. 1.Department of Anesthesia, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Anaesthesiology, Zunyi Medical College,Zunyi, 563003
Objective: The aim of this study is to investigate the effects of propofol on voltage-gated sodium channels and single action potention (AP) of primary S1 neurons in rats. Methods: Brain slices were prepared from SD rats of 7 to 14 days old, and whole-cell patch clamp technique was used to record currents and voltages. After application with propofol at different concentrations (10-300 μmol/L), the sodium currents (INa) were recorded. Data were used to make current-voltage curve, steady-state activation curve, steady-state inactivation curve,deinactivation curve and account characteristic parameters. AP was activated by a 30 mspulse of 50 pA, the data of each group were taken for analysis. Results: Propofol inhibited INA of S1 neurons in rats in a dose-dependent manner (10-300 μmol/L). It also inhibited the inactivation of sodium channels, shifted the inactivation curve towards the hyperpolarzating potential, and prolonged the recovery of sodium channels from their deinactivation,however it did not affect activation of sodium channels. Propofol inhibited the overshoot of single AP of S1 neurons in rats in a dose-dependent manner (10-100 μmol/L, P<0.01), and also depressed the overshoot (100 μmol/L,P<0.01), there was no AP be activated at 300 μmol/L. Conclusion: Propofol shows an inhibitory effect on voltage-gated sodium channels and AP of S1 neurons in the thalamocortical circuit, which may play a role in the mechanisms of propofol-induced general anesthesia.
propofol; patch clamp; sodium channel; action potention; rats
R614.1
A DOI: 10.3969/j.issn.2095-9400.2015.12.001
2015-04-22
国家自然科学基金资助项目(81060266)。
何炯策(1986-),男,浙江温州人,住院医师,硕士。
刘兴奎,教授,Email:xkliu@zmc.edu.cn。
