水通道蛋白在光化性角化病、Bowen病和浸润性鳞状细胞癌中的表达及其意义
2015-10-13王小勇陶承军任金平袁丞达王敏磊应航宇
王小勇,陶承军,任金平,袁丞达,王敏磊,应航宇
(杭州市中医院 皮肤科,浙江 杭州 310007)
水通道蛋白在光化性角化病、Bowen病和浸润性鳞状细胞癌中的表达及其意义
王小勇,陶承军,任金平,袁丞达,王敏磊,应航宇
(杭州市中医院皮肤科,浙江杭州310007)
目的:探讨水通道蛋白(AQP)1、3、9、10在光化性角化病(AK)、Bowen病(BD)和浸润性皮肤鳞状细胞癌(SCC)中的表达及其意义。方法:应用免疫组织化学方法检测AQP1、AQP3、AQP9、AQP10在人正常皮肤组织、AK、BD和浸润性SCC中的表达情况。结果:与正常皮肤组织比较,AQP3、AQP9和AQP10表达在AK、BD和浸润性SCC中均显著增高;AQP1在浸润性SCC的血管内膜和血管内皮细胞中强度染色;浸润性SCC 中AQP9、AQP10的表达水平显著高于AK。结论:AQP1、AQP3、AQP9、AQP10的表达上调与浸润性SCC的发生、发展可能相关。
水通道蛋白;光化性角化病;Bowen病;鳞状细胞癌
水通道蛋白(aquaporin,AQP),又名水乳蛋白,是一类介导水分子跨膜运动的转运蛋白的总称,其在细胞膜上组成“孔道”,可控制水在细胞的进出。研究发现,在人皮肤中共有6种亚型的AQP表达,分别是AQP1、AQP3、AQP5、AQP7、AQP9和AQP10,其中在表皮角质形成细胞中表达的有AQP1、AQP3、AQP9、AQP10[1]。AQP和各种肿瘤间的关系是近年来的研究热点。研究表明AQP与肿瘤的发生和发展密切相关[2]。本研究检测AQP1、AQP3、AQP9、AQP10在光化性角化病(actinic keratosis,AK)、Bowen病(Bowen’s disease,BD)和浸润性皮肤鳞状细胞癌(squamous cell carcinoma,SCC)中的表达水平,并初步探讨AQP1、AQP3、AQP9、AQP10的表达在AK、BD和浸润性SCC发生和发展中的作用及意义。
1 材料和方法
1.1标本来源 收集AK病理标本12例,其中面部9例,手背2例,小腿1例,年龄(79.86±8.09)岁;BD病理标本15例,其中躯干9例,四肢6例,年龄(71± 6.51)岁;SCC病理标本20例,其中面部4例,头皮3例,躯干3例,四肢10例,年龄(67.67±14.04)岁,根据Broders分级法,I级10例,I I级4例,I I I级4例,IV级2例,均未发现淋巴结转移。对照的正常皮肤组
1.2方法
1.2.1免疫组织化学染色:新鲜正常皮肤组织及肿瘤组织用4%甲醛固定,常规石蜡包埋。石蜡切片制作流程:修块、冲洗、梯度乙醇脱水、二甲苯透明、浸蜡、包埋、切片、烤片、保存。免疫组织化学染色步骤:二甲苯脱蜡,梯度乙醇脱水,3% H2O2阻断和灭活内源性过氧化物酶,抗原修复,正常羊血清工作液封闭,加一抗过夜,加二抗,加链霉素抗生物素-过氧化物酶,DAB显色,自来水充分冲洗,苏木素复染,干燥,封片。以正常皮肤作对照,以PBS代替一抗作阴性对照。
1.2.2结果判断:细胞膜、细胞浆或/和细胞核出现棕黄色或棕褐色颗粒判定为阳性细胞。参照Ozdemir等[3]的评分标准,按染色强度及染色细胞比例进行评分。按染色强度评分为:轻度染色(淡黄色)为1,中度染色(棕黄色)为2,强度染色(棕黑色)为3。按阳性细胞比例评分为:阳性细胞<1/3 为l,1/3~2/3为2,>2/3为3。染色强度得分与阳性细胞比例得分相乘为最后得分。1~3分为弱阳性(+),4~6分为阳性(++),7~9分为强阳性(+++)。
1.3统计学处理方法 采用SPSSl2.0统计软件进行统计学分析。以Mann-Whitney U检验比较各组间蛋白表达水平。P<0.05为差异有统计学意义。
2 结果
2.1AQP1、AQP3、AQP9、AQP10在正常皮肤及AK、BD和浸润性SCC中的表达情况 AQP1在正常皮肤的角质层和表皮角质形成细胞中为弱阳性表达,在表皮中上层表达更明显,在角质形成细胞中主要为胞膜和胞浆染色(见图1a)。AQP1在AK、BD和浸润性SCC中均为弱阳性表达,与正常皮肤不同的是部分异型细胞核轻度染色(见图1b-d)。AQP1在正常真皮的血管内膜中为轻度染色或不染色,AQP1在AK和BD真皮的血管内膜中为中度至强度染色,在浸润性SCC肿瘤团块间的血管内膜中为强度染色(见图1a-d)。
AQP3在正常皮肤的角质形成细胞中为弱阳性表达,在表皮中下层表达更明显,主要为胞膜染色,部分胞浆淡染(见图2a)。AQP3在AK和BD中为阳性表达,主要为胞膜染色,部分为胞浆染色(见图2b-c)。在BD中,部分异型细胞核亦染色阳性。在浸润性SCC的癌珠及癌巢处为强阳性表达,主要为胞膜染色(见图2d)。AQP3在正常皮肤、SK、BD和浸润性SCC的血管内膜中均为阴性表达。
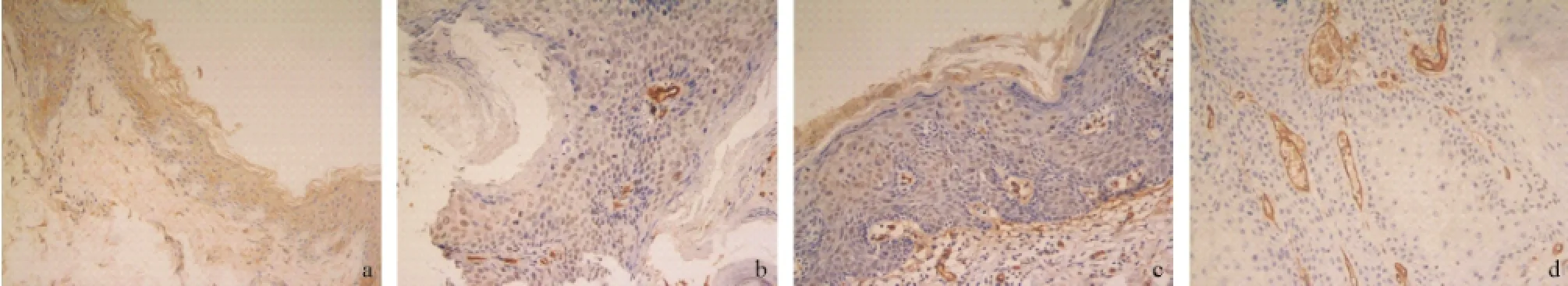
图1 AQP1的表达情况(SP法,×200)
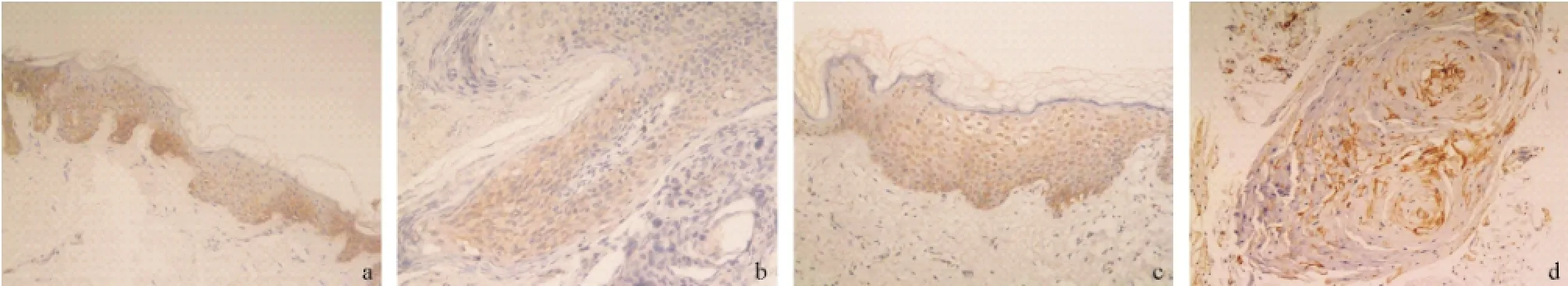
图2 AQP3的表达情况(SP法,×200)
AQP9在正常皮肤的角质形成细胞中为弱阳性表达,主要为胞浆染色,部分胞核染色(见图3a)。AQP9在AK和BD中阳性表达,主要为胞核染色,部分胞浆染色(见图3b-c)。AQP9在浸润性SCC中为强阳性表达,所有细胞均染色,主要为胞核染色,部分胞浆染色(见图3d)。AQP9在正常皮肤、SK、BD和浸润性SCC的血管内膜中均为阴性表达。
AQP10在正常皮肤的角质形成细胞中为弱阳性表达,主要为胞核染色,胞浆淡染(见图4a)。AQP10 在AK中阳性表达,主要为胞核染色,胞浆淡染(见图4b)。AQP10在BD和浸润性SCC中为强阳性表达,主要为胞核染色,胞浆淡染(见图4c-d)。AQP10在正常皮肤、SK、BD和浸润性SCC的血管内膜中均为阴性表达。
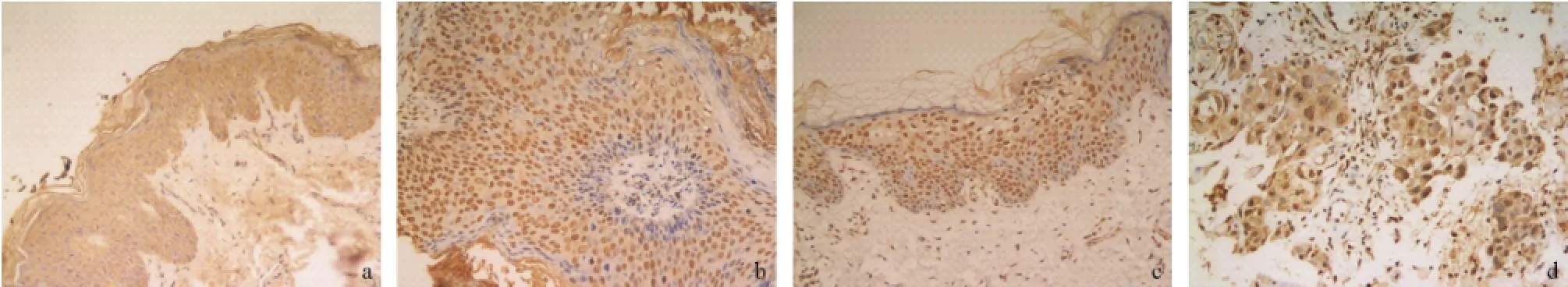
图3 AQP9的表达情况(SP法,×200)
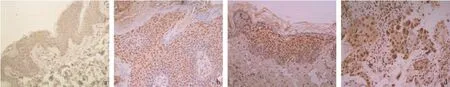
图4 AQP10的表达情况(SP法,×200)
2.2AQP1、AQP3、AQP9、AQP10在正常皮肤及AK、BD和浸润性SCC中的差异表达 AQP1在AK、BD和浸润性SCC中为弱阳性表达,与正常皮肤组织比较差异无统计学意义(P>0.05)。AK、BD和浸润性SCC的癌珠及癌巢中AQP3的表达水平均显著高于正常表皮(Z值分别为4.175、4.369、4.813,均P<0.01)。AK、BD和浸润性SCC中AQP9的表达水平均显著高于正常表皮(Z值分别为4.195、4.533、4.678,均P<0.01),浸润性SCC中AQP9的表达水平显著高于AK和BD(Z值分别为3.756、3.718,均P<0.01)。AK、BD和浸润性SCC中AQP10的表达水平均显著高于正常表皮(Z值分别为4.179、4.371、4.751,均P<0.01),浸润性SCC和BD中AQP10的表达水平显著高于AK(Z值分别为4.208、3.661,均P<0.01)。见表1。
表1 AQP1、AQP3、AQP9、AQP10在正常皮肤及AK、BD和浸润性SCC中的表达
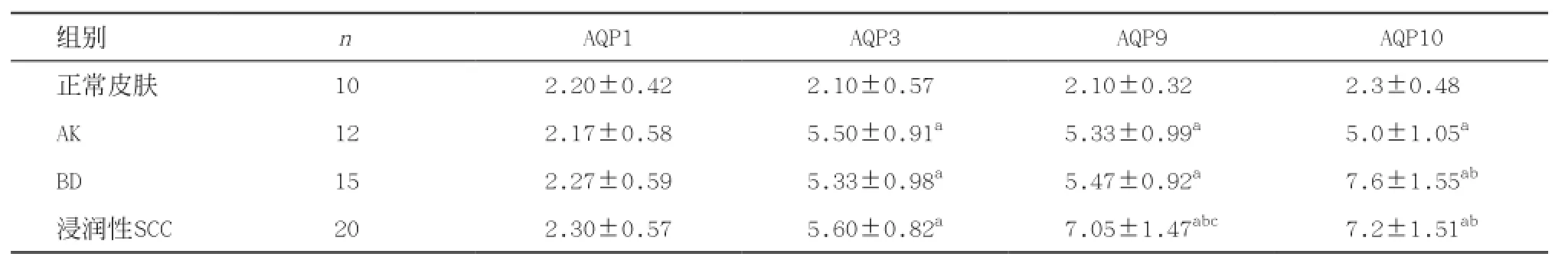
表1 AQP1、AQP3、AQP9、AQP10在正常皮肤及AK、BD和浸润性SCC中的表达
与正常皮肤比:aP<0.01;与AK比:bP<0.01;与BD组比:cP<0.01
组别 n AQP1 AQP3 AQP9 AQP10正常皮肤 10 2.20±0.42 2.10±0.57a 2.10±0.32abc 2.3±0.48aaAK 12 2.17±0.58 5.50±0.91a 5.33±0.99abc 5.0±1.05aaBD 15 2.27±0.59 5.33±0.98a 5.47±0.92abc 7.6±1.55ab浸润性SCC 20 2.30±0.57 5.60±0.82a 7.05±1.47abc 7.2±1.51ab
3 讨论
皮肤SCC在临床上很常见,治疗的关键在于早期发现和早期治疗,所以诊断和鉴别皮肤癌前病变、原位癌和浸润性SCC对于选择治疗方案和预后都至关重要。AK是癌前期疾病,有0.01%~0.30%的可能转变为浸润性SCC。BD,即原位鳞状细胞癌,约3%~5%的患者,也有认为高达20%~30%的患者可发展成为浸润性SCC。
本实验应用免疫组织化学方法检测了正常皮肤及AK、BD和浸润性SCC中AQP1、AQP3、AQP9、AQP10的表达情况,并且比较了它们之间的表达差异。结果发现,AQP3、AQP9和AQP10表达在AK、BD和浸润性SCC中均显著增高;AQP1在AK和BD真皮的血管内膜中为中度至强度染色,在浸润性SCC肿瘤团块间的血管内膜中为强度染色;浸润性SCC中AQP9的表达水平显著高于AK和BD;浸润性SCC和BD中AQP10的表达水平显著高于AK。以上结果表明,这些AQP的差异表达与浸润性SCC的发生、发展可能相关。
AQP1是近年来与肿瘤关系研究中的一个热点蛋白。研究表明,AQP1能促进肿瘤的局部浸润、扩散和转移[2]。AQP1还与肿瘤的新生血管形成有关,缺少AQP1时,肿瘤的生长和新生血管形成明显降低[4]。本研究发现,AQP1在浸润性SCC的血管内膜和血管内皮细胞中强度染色,明显高于在正常皮肤中的表达水平,亦高于在AK和BD真皮中的表达水平,说明随着SCC的发展,当真皮中有肿瘤细胞转移、增殖和新生血管形成时,AQP1在血管内膜和血管内皮细胞中的表达是明显增加的,这表明AQP1确实与浸润性SCC的转移、扩散和新生血管形成有关系,但其中具体的机制有待进一步的研究。因此,当判断皮肤SCC在真皮中是否有转移及扩散有困难时,用免疫组织化学方法检测AQP1在真皮血管中的表达水平可能具有重要的意义。
AQP3也是与肿瘤关系研究中的一个热点蛋白。研究发现,AQP3在SCC中高表达,而且细胞分化越低,AQP3的表达越少[5]。本研究同样发现,AQP3主要在浸润性SCC的癌珠及癌巢处表达,即在高分化处高表达,在低分化处低表达或不表达,表明AQP3的表达与SCC的分化有关。本研究还发现AQP3的表达水平在AK、BD和浸润性SCC中显著增高,表明AQP3的高表达与皮肤SCC的发生亦相关。本课题组用siRNA下调AQP3的表达可抑制SCC细胞增殖和诱导SCC细胞凋亡,证实AQP3表达与皮肤SCC细胞的增殖和凋亡相关[6]。研究亦发现AQP3主要在细胞膜上表达,AQP3的高表达可能通过改变肿瘤细胞的渗透压,使肿瘤细胞的形态发生改变,从而有利于向周围组织发生浸润[7]。
目前关于AQP9、AQP10与皮肤SCC关系的研究很少。以往研究发现,AQP9只在处于分化状态的角质形成细胞中表达[8]。本研究发现,AK、BD和浸润性SCC中AQP9、AQP10的表达水平均显著高于正常表皮角质形成细胞,而且浸润性SCC中AQP9、AQP10的表达水平显著高于AK,这些结果提示AQP9、AQP10的表达与SCC的发生和发展有关。在AQP家族中,AQP3、AQP7、AQP9和AQP10是水-甘油通道蛋白,能转运水和甘油。这些AQP的高表达可能通过转运甘油增加,接下来通过腺嘌呤核苷三磷酸/p38丝裂原活化蛋白激酶(ATP/p38 MAPK)信号通路促进皮肤肿瘤的发生[2]。在本研究中,AQP9、AQP10主要在AK、BD和浸润性SCC的异型胞核中表达,其具体的意义还有待进一步的研究。
[1]Boury-Jamot M, Sougrat R, Tailhardat M, et al. Expression and function of aquaporins in human skin: Is aquaporin-3 just a glycerol transporter?[J]. Biochim Biophys Acta, 2006,1758(8): 1034-1042.
[2]Verkman AS, Hara-Chikuma M, Papadopoulos MC. Aquaporins—new players in cancer biology[J]. J Mol Med, 2008,86(5): 523-529.
[3]Ozdemir E, Kakehi Y, Okuno H, et al. Role of matrix metalloproteinase-9 in the basement membrane destruction of superficialurothelial carcinomas[J]. J Urol, 1999, 161(4): 1359-1363.
[4]Saadoun S, Papadopoulos MC, Hara-Chikuma M, et al. Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption[J]. Nature, 2005, 434(7034): 786-792.
[5]李吉, 张碧红, 谢红付, 等. 水通道蛋白3在四种皮肤肿瘤中的表达[J]. 中华皮肤科杂志, 2008, 41(11): 716-718.
[6]王小勇, 陶承军, 袁丞达, 等. si RNA干扰水通道蛋白3和磷脂酶D2表达对A431细胞株生长和凋亡的影响[J]. 中华皮肤科杂志, 2014, 47(11): 772-775.
[7]McCoy E, Sontheimer H. Expression and function of water channels (aquaporins) in migrating malignant astrocytes[J]. Glia, 2007, 55(10): 1034-1043.
[8]Sugiyama Y, Ota Y, Hara M, et al. Osmotic stress up-regulates aquaporin-3 gene expression in cultured human keratinocytes[J]. Biochim Biophys Acta, 2001, 1522(2): 82-88.
(本文编辑:丁敏娇)
Expression and significance of aquaporin in actinic keratosis, Bowen’s disease and invasive squamous cell carcinoma
WANG Xiaoyong, TAO Chengjun, REN Jinping, YUAN Chengda, WANG Minlei, YING Hangyu. Department of Dermatology, Hangzhou Hospital of Traditional Chinese Medicine, Hangzhou, 310007
Objective: To explore the expression and significance of aquaporin (AQP) 1, 3, 9, 10 in lesions of actinic keratosis, Bowen’s disease and invasive squamous cell carcinoma. Methods: Immunohistochemistry was utilized to measure the expression of AQP 1, 3, 9, 10 in tissue samples from normal human skin, actinic keratosis, Bowen’s disease and invasive squamous cell carcinoma. Results: The expression of AQP 3, 9, 10 in tissue samples from actinic keratosis, Bowen’s disease and invasive squamous cell carcinoma all increased significantly compared with the normal skin tissue. The high staining of AQP1 was observed in vascular inner membrance and endothelial cells of invasive squamous cell carcinoma. The expression of AOP9 and AQP10 in tissue samples from invasive squamous cell carcinoma increased significantly compared with actinic keratosis. Conclusion: The upregulated expression of AQP1, 3, 9, 10 may correlated with the carcinogenesis and progression of invasive squamous cell carcinoma.
aquaporin; actinic keratosis; Bowen’s disease; squamous cell carcinoma
R758.69
A DOI: 10.3969/j.issn.2095-9400.2015.12.004
2014-11-13
浙江省自然科学基金资助项目(LY12H11010)。
王小勇(1974-),男,湖南邵阳人,副主任医师,博士。织标本取自本科室皮肤活检标本边缘的正常皮肤,共10例,其中面部4例,躯干3例,四肢3例,年龄(73.43±8.49)岁。兔抗人AQP1多克隆抗体购自美国Santa Cruz生物技术公司,兔抗人AQP3多克隆抗体购自美国Bioworld技术公司,兔抗人AQP9多克隆抗体购自台湾Abnova生物技术公司,兔抗人AQP10多克隆抗体购自香港Abcam公司,SP免疫组织化学染色试剂盒购自福州迈新生物技术开发有限公司。
