低温保护剂渗透关节软骨研究进展
2015-09-11虞效益张绍志范菊莉胡长兴
虞效益 张绍志 范菊莉 胡长兴*
1(浙江大学宁波理工学院,浙江 宁波 315100)2(浙江大学制冷与低温研究所,杭州 310027)3(南京航空航天大学航空宇航学院,南京 210016)
低温保护剂渗透关节软骨研究进展
虞效益1张绍志2范菊莉3胡长兴1*
1(浙江大学宁波理工学院,浙江 宁波 315100)2(浙江大学制冷与低温研究所,杭州 310027)3(南京航空航天大学航空宇航学院,南京 210016)
玻璃化保存关节软骨具有临床治疗和科学研究的双重意义。如何在保证对软骨细胞造成的损伤最小的前提下,将足够多的低温保护剂载入软骨组织,是玻璃化保存关节软骨的关键环节之一,而低温保护剂渗透关节软骨的特性是指导设计低温保护剂加载处理过程的重要依据。从实验研究和数学建模两方面,系统评述低温保护剂渗透关节软骨的研究进展,指出现有研究存在的不足,并对今后低温保护剂渗透关节软骨的研究方向提出展望。
关节软骨;低温保护剂;渗透;扩散;数学建模
引言
玻璃化保存生物材料可以避免冰晶形成带来的直接危害(如细胞膜破裂)和间接危害(如电解质浓缩导致蛋白质变性),是低温保存生物材料、建立生物样品库的理想选择。关节软骨的玻璃化保存研究具有两个方面的重要意义:一是软骨移植是临床上修复、重建和替换受损关节软骨的有效手段。捐献的软骨若能长期保存,那么外科医生将可针对病变部位挑选合适的移植物,并且有充裕的时间进行多项检测,以防止供者可能带来的病毒或细菌感染。这不仅有助于提高软骨移植手术的成功率,而且使得软骨移植手术的广泛开展成为可能。二是关节软骨仅由单一的软骨细胞和软骨基质构成,不含血管、神经和淋巴管,被认为是研究生物组织玻璃化保存的理想对象。关节软骨的成功保存对低温保存从细胞水平跨越到体积更大、结构更复杂的组织层面具有重要意义。
Song等最早报道了玻璃化保存关节软骨的较为成功的案例——采用玻璃化溶液VS55(含二甲亚砜、甲酰胺和丙二醇,55表示低温保护剂总浓度,单位%(W/V))以及特定的步骤,对较薄的兔关节软骨实施了玻璃化保存并进行移植试验[1]。Pegg等提出了一边降低温度、一边提高低温保护剂浓度并始终使温度略高于组织冻结点的新方法(liquidus-tracking method)来实现玻璃化[2]。该方法的最大优点是不需要快速冷却和升温,不足是低温保护剂溶液处理软骨样品的时间很长,且操作步骤繁琐。Pegg等也曾尝试Song等的保存方案,但发现某些技术环节难以复制。Guan等尝试将经过VS55处理的牛关节软骨直接投入液氮,发现快速冷却对保护软骨细胞及软骨基质具有积极作用,但方案的诸多环节有待优化[3]。Brockbank等比较了VS55和VS83玻璃化保存猪关节软骨的效果,发现在相同保存步骤下浓度较高的VS83更适合较厚的猪关节软骨,但如此高浓度的VS83溶液的毒性不可忽视[4]。Jomha等对影响玻璃化保存的多个因素进行研究,从而优化保存方案,对人关节软骨进行了较为成功的玻璃化保存——软骨细胞存活率约75%,可基本满足临床移植要求,但仍待进一步提高[5]。国内的胥义等则采用动态热机械分析法,研究关节软骨力学性能的低温损伤机理,为关节软骨保存方案的优化提供力学依据[6-8]。
尽管目前对关节软骨玻璃化保存的研究已有了相当多的成果,但如上所述,保存方案大多或多或少地存在这样或那样的缺陷与不足。为了完善关节软骨玻璃化保存技术,相关的基础问题仍需要深入研究[9]。玻璃化保存关节软骨的一般流程如图1所示,其中的关键是:在保证对软骨细胞造成的损伤最小的前提下,将足够多的低温保护剂载入软骨组织,以避免在后续的冷却和升温步骤中形成冰晶。低温保护剂虽能在低温下对软骨细胞起保护作用,但却极易在加载处理过程中对软骨细胞造成毒性损伤,这种毒性损伤与低温保护剂的种类、浓度、加载处理温度和时间均密切相关[10-11]。因此,深入了解低温保护剂渗透(permeate)关节软骨的特性,对合理设计加载处理程序非常重要。笔者对低温保护剂渗透关节软骨过程的实验研究和数学建模两方面的进展进行了较为详细的评述,并对今后的研究方向提出了展望。
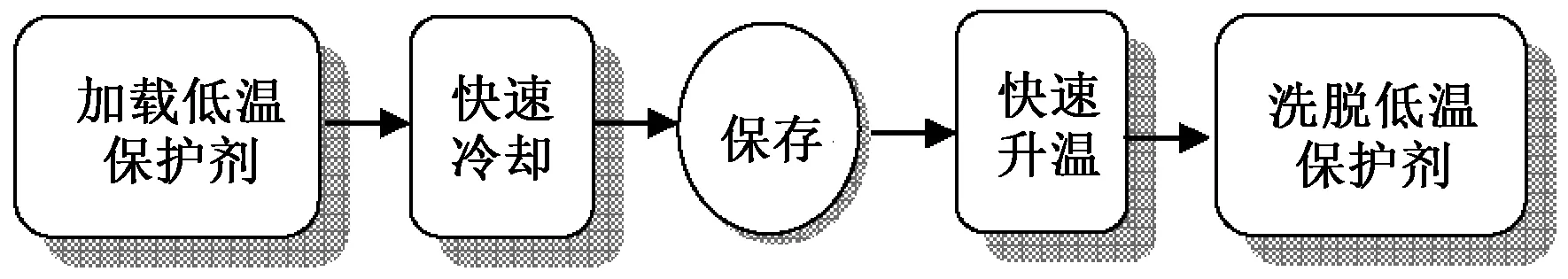
图1 玻璃化保存关节软骨一般流程Fig. 1 General procedure of vitrification of articular cartilage
1 实验研究
根据所采用的低温保护剂定量分析方法的不同,实验研究低温保护剂渗透关节软骨一般可采用两种路线,如图2所示[12]。实验步骤大致如下:首先是采用合适的工具(如角膜环转),在关节的负重部位获取所需大小的软骨样品,用缓冲溶液(如PBS)漂洗并擦干后,将其置于事先配制好的一定温度和浓度的低温保护剂溶液中浸渗处理指定的时间。一种路线,如果是对低温保护剂进行组织原位定量分析(如采用磁共振成像(MRI)),则将浸渗处理过的软骨样品快速漂洗并擦干,再放于相应仪器中测量(图2中路线2);另一种路线,将浸渗处理过的软骨样品快速漂洗并擦干,然后置于一定量的纯水中并放置足够长的时间,使得其中的低温保护剂可以充分反渗出来,再采用合适的方法(比如高效液相色谱(HPLC)),对所得反渗液中的低温保护剂进行定量分析(图2中路线1)。如此重复,不管选用哪种路线,最终都可以得到渗入软骨样品的低温保护剂的量随时间的变化关系。实验采用的软骨样品可以是不带软骨下骨(subchondral bone)的软骨片(cartilage disc),也可以是带软骨下骨的骨软骨栓(osteochondral dowel)。已有研究表明,低温保护剂在这两种样品中的扩散特性并无显著差别[13-14]。
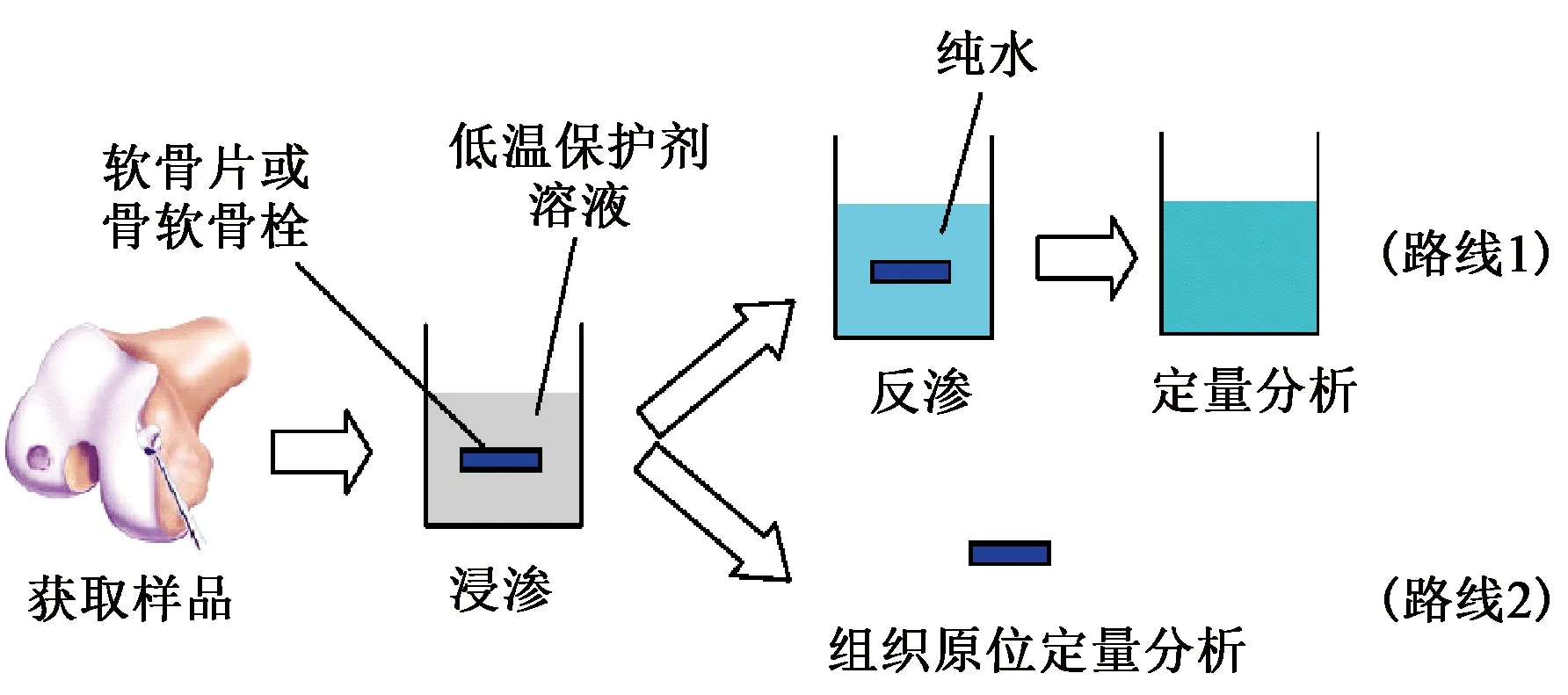
图2 低温保护剂渗透关节软骨实验研究路线Fig. 2 Experimental research routes of cryoprotectant permeation into articular cartilage
到目前为止,研究者已经提出和采用多种不同的低温保护剂定量分析方法,研究了低温保护剂渗透关节软骨的过程。在路线1中,核磁共振(NMR)[15-17]和高效液相色谱(HPLC)[18]是经常采用的低温保护剂定量分析方法;而路线2中的典型定量手段是磁共振成像(MRI),如Carsi等采用MRI分别研究了二甲亚砜和甘油在人关节软骨中的扩散[19]。MRI技术可以对软骨样品中的低温保护剂进行组织原位定量分析,不仅可以获得一个总的浓度,还可以知道低温保护剂在组织中的空间分布情况,并进而获取软骨组织的各向异性对扩散的影响信息。Abazari等就采用MRI技术,首次实验得到了二甲亚砜在猪骨软骨栓中的时空分布情况。他们的数据表明,软骨组织的各向异性对二甲亚砜扩散的影响很小,且二甲亚砜无法从软骨样品的骨侧渗入[20]。不管是MRI还是NMR或HPLC,均存在所需设备昂贵、操作复杂的缺点。于是,有研究者提出了渗透压仪法,即采用渗透压仪测得反渗液的质量渗摩尔浓度(osmolality,是指在1kg溶剂中所溶解的具有渗透作用的微粒的量,单位为Osm·kg-1或osmol·kg-1),再经过换算以得到所要的浓度。Sharma等[11]和Jomha等[21]分别采用该方法,得到了二甲亚砜、丙二醇、乙二醇和甘油渗入猪软骨样品的量随时间的变化数据。有研究者也通过测量洗脱液的质量渗摩尔浓度,确定除去软骨样品中的低温保护剂所需的时间[22]。笔者所在研究小组也采用渗透压仪法,实验研究了二甲亚砜对羊关节软骨的渗透性[23]。另外,还依据二甲亚砜分子的特性——含有亚砜基团(-SO-)这一硫基生色团,提出可采用紫外吸收光谱法对反渗液中的二甲亚砜进行定量[24]。
低温保护剂对生物材料的毒性是与温度密切相关的——温度越低,毒性越小。Pegg等提出一边降低温度、一边提高二甲亚砜浓度并始终使温度略高于组织冻结点的方法,在玻璃化保存羊关节软骨上获得了较大成功[2]。借鉴Pegg等的这一思想,Jomha等在对影响玻璃化保存的多个因素进行优化的基础上,实施了较为成功的人关节软骨玻璃化保存[5]。实践证明,边降温、边提高低温保护剂浓度的方法是行之有效的,但要在加载低温保护剂时加以贯彻,则低温保护剂在宽温度范围内对软骨样品的渗透性数据必不可少。然而,目前研究者对低温保护剂渗透关节软骨过程的研究大都局限于0℃以上温区[15-23],一方面可能是0℃以下温区渗透实验操作上的困难,另一方面可能是大多数研究者仍习惯尝试采用传统的玻璃化法(见图1)来保存关节软骨。鉴于此,笔者所在的研究小组设计并搭建了专门的实验装置(见图3),首次研究了-10、-20和-30℃时二甲亚砜渗透羊软骨样品的过程,并结合Fick扩散定律拟合得了相应的扩散系数数据[21]。有关该实验装置的详细介绍可参见文献[9, 25-26]。
2 数学建模研究
单纯的实验研究只能获得渗入软骨样品的低温保护剂的量随时间变化的离散数据,对指导设计低温保护剂加载处理程序的帮助有限。建立合适的描述低温保护剂渗透软骨组织的数学模型,则可以对加载处理过程中软骨组织内部各点低温保护剂的浓度进行实时监测。目前,针对这方面的研究并不少见。
长时间内,研究者一直采用传统的常系数Fick扩散模型对渗透实验数据进行拟合,从而得到相应温度下低温保护剂在软骨组织中的扩散系数,即
(1)
式中,Dd为二甲亚砜在软骨中的扩散系数,wd为二甲亚砜的浓度,t为时间。常系数Fick扩散模型可以进行数值求解[14,17],也可以根据特定的样品形状采用相应的解析解,比如圆柱[21]、半无限大平板[15]。当得到了有限个离散温度点下低温保护剂在软骨组织中的扩散系数后,再利用Arrhenius公式建立扩散系数与温度的关系[14-15,21],即
(2)
式中,A0为指前因子,Ea为活化能,R为通用气体常数,T为绝对温度。Mukherjee等[17]和Lawson等[27]应用各自所得的常系数Fick扩散模型,预测低温保护剂在软骨样品中的时空分布,并结合低温保护剂跨膜运输的两参数模型来指导低温保护剂加载处理程序的设计。
Pegg等则直接根据渗入软骨样品的低温保护剂的量随时间的变化趋势,采用特殊形式的数学公式对实验所得渗透数据进行拟合[18],即
(3)
式中,a、k、b和j为待拟合参数。该公式的不足是参数不具有明确的物理意义,并且只能计算经历一定时间后渗入软骨样品的低温保护剂的总量。
对于浓溶液,假设扩散系数为一常数通常是不合适的,而玻璃化保存又通常采用较高浓度的低温保护剂溶液。因此,常系数Fick扩散模型是否能精确预测低温保护剂在软骨样品中的时空分布有待商榷。于是,有研究者提出采用生物力学三相模型(biomechanical triphasic model,BTM),对渗透数据进行拟合,以得到扩散系数(因BTM公式过多,且相当复杂,这里不便列出,有兴趣的读者可参阅如下所述的相关文献)。Zhang等首先将BTM应用于低温保护剂对关节软骨的渗透性分析,并将BTM与常系数Fick扩散模型的计算结果进行了比较,结果显示两者并无显著差别[28]。Abazari等认为,Zhang等所做的一些诸如理想稀溶液的假设并不合适,应用非理想溶液热力学理论对Zhang等的模型进行了改进[29]。之后,他们又考虑软骨组织的各向异性,拟合得到了更加准确的模型参数[30]。Abazari等应用改进的BTM对低温保护剂渗透软骨样品的过程进行了分析,指出在加载低温保护剂时软骨组织会因脱水而收缩[30],常系数Fick扩散模型则会显著地低估低温保护剂渗透软骨组织的速率[20]。
不管是常系数Fick扩散模型还是BTM,低温保护剂在软骨组织中的扩散系数都是采用拟合的方式获得的,并且没有考虑浓度对扩散系数的影响。鉴于此,笔者所在研究小组结合溶液扩散理论和溶液热力学的相关知识,先后提出了两个描述二甲亚砜渗透关节软骨过程的理论模型——渗透模型I和渗透模型II,以实现对扩散系数的直接预测。两个模型的方程及模型各参数的含义如表1所示[12, 31-32]。渗透模型I和II的区别在于应用不同的理论和经验公式来预测扩散系数。渗透模型I将扩散系数与无限稀释扩散系数进行关联,活度系数采用UNIFAC模型(表1中式(7))估算,扩散系数的浓度依赖性采用Vignes公式(表1中式(8))表示,无限稀释扩散系数采用Siddiqi-Lucas公式(表1中式(9)和式(10))计算。由于该模型涉及了纯组分的黏度(表1中式(11)和式(12)),从严格意义上来说,只适用于纯组分冻结点以上的温区,以保证模型的物理意义。在渗透模型II中,扩散系数的计算主要依据了自由体积模型式表1中式(18)和Flory-Huggins溶液热力学理论(表1中式(21)和式(22))。渗透模型II虽相对较复杂,但克服了渗透模型I应用温区受限的不足。渗透模型I和II侧重于对低温保护剂渗透软骨组织这一过程的扩散传质机理的描述,忽略了软骨组织本身的生物力学特性对该过程的影响,就此而言不及BTM。
3 总结与展望
如上所述,目前研究者已对低温保护剂渗透关节软骨过程进行了较为广泛而深入的研究,也取得了相当的研究成果。为了更加有效地指导和帮助低温保护剂加载处理程序的设计,需要对一些问题进行探索。
1)现有研究大多针对的是单种低温保护剂渗透关节软骨的情况,渗透模型也是基于单种低温保护剂这一情况而建立的。然而,实际的玻璃化保存通常是将多种低温保护剂混合使用,以构成总浓度较高(30%~60%wt)的溶液。对于多元浓溶液,组分之间的相互作用对扩散的影响不可忽略[33-34]。如何获得多种低温保护剂协同渗透(co-permeate)关节软骨的特性,这对不管是实验研究还是数学建模都带来了新的挑战,比如多种低温保护剂共存时的定量分析问题,以及如何考虑低温保护剂之间相互作用对扩散速率的影响等。
2)现有研究的温度范围大多局限于0℃以上,而一边降低温度、一边提高低温保护剂浓度的加载处理方式被证明是行之有效的。为了将这一思想更好地加以贯彻,需要对0℃以下温区低温保护剂渗透关节软骨的特性进行广泛而深入的研究。
3)温度降低可减少毒性损伤,但也会带来扩散速率降低的负面效应。已有研究表明,当温度从0℃降低至-10℃时,二甲亚砜的扩散系数将减小25%,甘油和丙二醇受到的影响则更甚[21]。扩散速率的降低将直接导致加载处理时间的延长,以至毒性损伤的增强。因此,如何强化低温保护剂渗透关节软骨也是一个值得研究的问题。
注:Ddw为二甲亚砜在水中的扩散系数,H为新鲜软骨含水量,λ为软骨曲折度因子,D0为参考扩散系数,为热力学因子,m为一指数,γd为二甲亚砜的活度系数,xd为二甲亚砜的摩尔分数,为无限稀释的二甲亚砜在水中的扩散系数,为无限稀释的水在二甲亚砜中的扩散系数,xw为水的摩尔分数,ηd和ηw分别为纯二甲亚砜和纯水的黏度,Vb,d和Vb,w分别为纯二甲亚砜和纯水在正常沸点下的摩尔体积,A、B和T0为常数,为水在0 K时的比体积,β为一重叠因子,K和K’为两个自由体积参数,Tg,w为纯水的玻璃化转变温度,η0为一指前因子,Vc为临界摩尔体积,Dwd为水在二甲亚砜中的扩散系数,Dw为水在二甲亚砜水溶液中的自扩散系数,φw为水的体积分数,μw为水的化学势,Dw,0为指前因子,为一个水分子从一个位置跳跃到另一个新位置所需的临界局部空穴自由体积,FH为每个分子的平均空穴自由体积,γ为重叠因子,为二甲亚砜在0 K时的比体积,ξ为水和二甲亚砜各自的跳跃单元的摩尔体积之比,ww为水的质量分数,Kw1和Kw2为水的自由体积参数,Kd1和Kd2为二甲亚砜的自由体积参数,Tgd为二甲亚砜的玻璃化转变温度,Mw和Md分别为水和二甲亚砜的分子量,a、b和c为常数,y为相对分子体积,χ为Flory-Huggins相互作用参数,d和w分别为二甲亚砜和水的比体积。
Note:Ddwis the diffusion coefficient of dimethyl sulfoxide (Me2SO) in water,His the water content of fresh articular cartilage (AC) by mass,λis the tortuosity factor of AC,D0is the reference diffusion coefficient,is the thermodynamic factor,mis an exponent,dis the activity coefficient of Me2SO,xdis the mole fraction of Me2SO,is the diffusion coefficient of infinite dilute Me2SO in water,is the diffusion coefficient of infinite dilute water in Me2SO,xwis the mole fraction of water,ηdandηware the viscosity of Me2SO and water respectively,Vb,dandVb,ware the molar volume of Me2SO and water at the normal boiling point respectively,A,BandT0are three constants,is the specific volume of water at 0 K,βis an overlap factor,KandK′ are two free volume parameters,Tg,wis the glass transition temperature of water,η0is an pre-exponential factor,Vcis the critical molar volume,Dwdis the diffusion coefficient of water in Me2SO,Dwis the self-diffusion coefficient of water in aqueous Me2SO solution,φwis the volume fraction of water,μwis the chemical potential of water,Dw,0is an pre-exponential factor,is the critical local hole free volume required for a water molecule to jump to a new position,FHis the average hole free volume per molecule in the liquid,γis an overlap factor,is the specific volume of Me2SO at 0 K,ξis the ratio of the molar volume of a jumping unit of water to that of Me2SO,wwis the mass fraction of water,Kw1andKw2are the free volume parameters for water,Kd1andKd2are the free volume parameters for Me2SO,Tgdis the glass transition temperature of Me2SO,MwandMdare the molecule weights of water and Me2SO respectively,a,bandcare three constants,yis the relative molecule volume,is the Flory-Huggins interaction parameter,dandware the specific volumes of Me2SO and water respectively.
[1] Song YC, An YH, Kang QK,etal. Vitreous preservation of articular cartilage grafts [J]. J Investig Surg, 2004, 17(2): 65-70.
[2] Pegg DE, Wang LH, Vaughan D. Cryopreservation of articular cartilage. Part 3: the liquidus-tracking method [J]. Cryobiology, 2006, 52(3): 360-368.
[3] Guan J, Urban JPG, Li ZH,etal. Effects of rapid cooling on articular cartilage [J]. Cryobiology, 2006, 52(3): 430-439.
[4] Brockbank KGM, Chen ZZ, Song YC. Vitrification of porcine articular cartilage [J]. Cryobiology, 2010, 60(2): 217-221.
[5] Jomha NM, Elliott JAW, Law GK,etal. Vitrification of intact human articular cartilage [J]. Biomaterials, 2012, 33(26): 6061-6068.
[6] 吕娅, 胥义, 孙慧君, 等. 低温保护剂和降温速率对猪关节软骨压缩杨氏模量的影响[J]. 中国生物医学工程学报, 2012, 31(1): 156-160.
[7] 胥义, 孙慧君, 吕娅. 关节软骨冻结过程热膨胀行为的实验研究[J]. 中国生物医学工程学报, 2012, 31(5): 742-747.
[8] 孙慧君, 胥义, 吕娅. 冻干保护剂和预冻结速率对猪关节软骨压缩杨氏模量的影响[J]. 中国生物医学工程学报, 2013, 32(1): 53-60.
[9] Abazari A, Jomha NM, Elliott JAW,etal. Cryopreservation of articular cartilage [J]. Cryobiology, 2013, 66(3): 201-209.
[10] Elmoazzen HY, Poovadan A, Law GK,etal. Dimethyl sulfoxide toxicity kinetics in intact articular cartilage [J]. Cell Tissue Bank, 2007, 8(2): 125-133.
[11] Jomha NM, Weiss ADH, Fraser Forbes J,etal. Cryoprotectant agent toxicity in porcine articular chondrocytes [J]. Cryobiology, 2010, 61(3): 297-302.
[12] 虞效益. 低温保护剂处理关节软骨的若干问题研究[D]. 杭州: 浙江大学, 2013.
[13] Xia Y, Farquhar T, Burton-Wurster N,etal. Diffusion and relaxation mapping of cartilage-bone plugs and excised disks using microscopic magnetic resonance imaging [J]. Magn Reson Med, 1994, 31(3): 273-282.
[14] Sharma R, Law GK, Rehieh K,etal. A novel method to measure cryoprotectant permeation into intact articular cartilage [J]. Cryobiology, 2007, 54(2): 196-203.
[15] Muldrew K, Sykes B, Schachar N,etal. Permeation kinetics of dimethyl sulfoxide in articular cartilage [J]. CryoLetters, 1996, 17(6): 331-340.
[16] Pegg DE. Cryobiology of cells in situ: experiments with ovine articular cartilage [J]. Cryobiology, 1998, 37(4): 381-381.
[17] Mukherjee IN, Li Y, Song YC,etal. Cryoprotectant transport through articular cartilage for long-term storage: experimental and modeling studies [J]. Osteoarthritis Cartilage, 2008, 16(11): 1379-1386.
[18] Pegg DE, Wang LH, Vaughan D,etal. Cryopreservation of articular cartilage. Part 2: mechanisms of cryoinjury [J]. Cryobiology, 2006, 52(3): 347-359.
[19] Carsi B, Lopez-Lacomba JL, Sanz J,etal. Cryoprotectant permeation through human articular cartilage [J]. Osteoarthritis Cartilage, 2004, 12(10): 787-792.
[20] Abazari A, Elliott JAW, McGann L E,etal. MR spectroscopy measurement of the diffusion of dimethyl sulfoxide in articular cartilage and comparison to theoretical predictions [J]. Osteoarthritis Cartilage, 2012, 20(9): 1004-1010.
[21] Jomha NM, Law GK, Abazari A,etal. Permeation of several cryoprotectant agents into porcine articular cartilage [J]. Cryobiology, 2009, 58(1): 110-114.
[22] Yu H, Al-Abbasi KK, Elliott JAW,etal. Clinical efflux of cryoprotective agents from vitrified human articular cartilage [J]. Cryobiology, 2013, 66(2): 121-125.
[23] 虞效益, 张绍志, 徐梦洁, 等. 二甲亚砜对关节软骨渗透性研究[J]. 工程热物理学报, 2010, 31(8): 1363-1366.
[24] Zhang Shaozhi, Yu Xiaoyi, Chen Guangming. Permeation of dimethyl sulfoxide into articular cartilage at subzero temperatures [J]. J Zhejiang Univ-Sci B (Biomed & Biotechnol), 2012, 13(3): 213-220.
[25] 张绍志, 马凡资, 虞效益, 等. 低温保护剂溶液冷却系统的研究[J]. 低温工程, 2008, (2): 1-3, 17.
[26] 杨戈, 张绍志, 陈光明, 等. 新型低温保存装置性能的实验研究[J]. 制冷学报, 2010, 31(2): 43-47.
[27] Lawson A, Mukherjee IN, Sambanis A. Mathematical modeling of cryoprotectant addition and removal for the cryopreservation of engineered or natural tissues [J]. Cryobiology, 2012, 64(1): 1-11.
[28] Zhang Shaozhi, Pegg DE. Analysis of the permeation of cryoprotectants in cartilage [J]. Cryobiology, 2007, 54(2): 146-153.
[29] Abazari A, Elliott JAW, Law GK,etal. A biomechanical triphasic approach to the transport of nondilute solutions in articular cartilage [J]. Biophys J, 2009, 97(12): 3054-3064.
[30] Abazari A, Thompson RB, Elliott JAW,etal. Transport phenomena in articular cartilage cryopreservation as predicted by the modified triphasic model and the effect of natural inhomogeneities [J]. Biophys J, 2012, 102(6): 1284-1293.
[31] Yu Xiaoyi, Chen Guangming, Zhang Shaozhi. A model to predict the permeation kinetics of dimethyl sulfoxide in articular cartilage [J]. Biopreserv Biobank, 2013, 11(1): 51-56.
[32] Yu Xiaoyi, Chen Guangming, Zhang Shaozhi. A model for predicting the permeation of dimethyl sulfoxide into articular cartilage, and its application to the liquidus-tracking method [J]. Cryobiology, 2013, 67(3): 332-338.
[33] Taylor R, Krishna R. Multicomponent mass transfer [M]. New York: John Wiley & Sons, Inc, 1993.
[34] Medvedev O. Diffusion coefficients in multicomponent mixtures [D]. Copenhagen: Technical University of Demark, 2005.
A Review of Cryoprotectant Permeation into Articular Cartilage
Yu Xiaoyi1Zhang Shaozhi2Fan Juli3Hu Changxing1 *
1(NingboInstituteofTechnology,ZhejiangUniversity,Ningbo315100,Zhejiang,China)2(InstituteofRefrigerationandCryogenics,ZhejiangUniversity,Hangzhou310027,China)3(CollegeofAerospaceEngineering,NanjingUniversityofAeronautics&Astronautics,Nanjing210016,China)
Vitrification of articular cartilage (AC) has excited great interest due to the clinical and scientific significances of this tissue. Sufficient permeation throughout the tissue and minimization of accompanying damage to cells are required for successful vitrification of AC. The knowledge of permeation kinetics of cryoprotectant (CPA) in AC is important for designing the CPA addition protocol. In this review, developments on the permeation of CPA into AC are summarized from two aspects: measurement of CPA diffusion in AC and mathematical modeling of CPA transport in AC. A great of efforts have been made, which has led to the recent advancements in the field, but more investigations still deserved to be addressed, such as co-permeation of multiple CPAs into AC, CPA permeation at subzero temperatures, and strengthening of CPA transport.
articular cartilage;cryoprotectant;permeation;diffusion;mathematical modeling
10.3969/j.issn.0258-8021. 2015. 04.013
2015-01-22, 录用日期:2015-04-30
国家自然科学基金(5140618,511060740); 中国科学院低温工程学重点实验室开放基金(CRYO201416); 浙江省教育厅科研项目(Y201432759)
R318.52,TQ021.4
A
0258-8021(2015) 04-0481-06
*通信作者(Corresponding author), E-mail: 03nyhjyxy@zju.edu.cn
