传统发酵豆酱中产脂肪酶菌株的筛选
2015-09-09刘思佳孙晓东卢萌萌卢影影胡光琴马一涵大连民族大学环境与资源学院辽宁大连6600大连理工大学生命科学与技术学院辽宁大连6024
刘思佳,孙晓东,2*,卢萌萌,卢影影,胡光琴,马一涵(.大连民族大学 环境与资源学院,辽宁 大连 6600;2.大连理工大学 生命科学与技术学院,辽宁 大连 6024)
传统发酵豆酱中产脂肪酶菌株的筛选
刘思佳1,孙晓东1,2*,卢萌萌1,卢影影1,胡光琴1,马一涵1
(1.大连民族大学 环境与资源学院,辽宁 大连 116600;2.大连理工大学 生命科学与技术学院,辽宁 大连 116024)
脂肪酶属于羧基酯水解酶类,能将甘油三酯逐步地水解成甘油和脂肪酸。该研究从东北三省传统的家庭自制豆酱上获得纯培养真菌389株,通过三丁酸甘油酯平板法初筛获得具有脂肪酶活性的菌株41株,其中青霉属的真菌27株、曲霉5株、毛霉3株、犁头霉2株、酵母菌1株、镰孢菌2株、帚霉菌1株。结果表明,青霉属的真菌无论从数量还是酶活都高于其他属的真菌,其中橘灰青霉(Penici1-1ium aurantiogriseum)数量最多。在分离到的菌株中,毛霉属的卷枝毛霉(Mucor circine11oides)酶活最高,是具有生物催化潜力的功能菌株。
豆酱;真菌;脂肪酶活性;三丁酸甘油酯;橘灰青霉;卷枝毛霉
豆酱(soybean paste)是我国传统的发酵豆制品,它是以大豆为主要原料,经自然发酵而成的半流动状态的发酵食品,也称黄豆酱、黄酱或大豆酱。豆酱在自然发酵过程中pH和总酸在起始发酵的2~4周内变化较快,后期变化缓慢,到16周时分别达到4.55和3.48%(以干基计)[1]。传统豆酱是通过天然接菌,自然发酵3~4个月而形成的,微生物及其酶系在酱曲培养和酱醪发酵中发挥了重要作用[2]。微生物分子生态学作为分子生物学与微生物生态学交叉而形成的学科,在传统发酵食品行业中的应用还处于起步阶段[3]。传统的家庭自制豆酱是自然发酵而成,在完全开放式的制作过程中,空气中的大量微生物自由落入,形成特殊的微生物区系,其中真菌伴随在豆酱的整个制作过程中,尤其在制曲阶段为优势类群[4]。中国传统发酵豆制品的生产过程中发生了一系列复杂的生化反应,使其制品具有特定的风味、组成和营养。豆酱在发酵过程中微生物的分布及这些微生物在工业生产方面的发掘与利用,通过对菌种的筛选、改良进一步提高产品的营养、风味及功能性[5]。有人分离得到的霉菌,经鉴定主要为黑曲霉(Aspergi11us niger)、米曲霉(Aspergi11usoryzae)、高大毛霉(Mucor mucedo)和酱油曲霉(Aspergi11us sojae)等[6],这些真菌分解大豆中的蛋白质和脂肪,将大分子物质分解成可被人体吸收利用的小分子营养物质[7]。
脂肪酶是一种特殊的酯键水解酶,将脂肪分解为甘油脂和脂肪酸,它广泛存在于动植物和微生物中,也可通过化学合成获得,是一种既可催化水解反应又可催化合成反应的生物催化剂。因微生物脂肪酶的产量高,便于基因操作,生产无季节波动等原因,故比植物和动物来源的脂肪酶的应用更为广泛[8]。脂肪酶是一类能够催化酯的水解反应以及在非水相体系中催化脂肪酸和醇类发生酯化反应的酶类。随着酶学技术的快速发展,微生物脂肪酶也受到了越来越多的关注[9]。目前,产脂肪酶的微生物包括黑曲霉、白地霉、假单胞菌属、毛霉、根霉、假丝酵母等,所产脂肪酶应用于工业中,如洗涤业、食品行业、化学业、皮革业、造纸业等[10]。脂肪酶是重要的工业用酶。脂肪酶在焙烤食品中可作为绿色生物改良剂;在油脂工业上可促油脂水解、促酯交换和促酯化;在乳品工业中可用于乳酯水解;在食品添加剂中应用可增香改质、提高食品档次。目前国内外还开发出了许多新型脂肪酶产品[11]。更多还原脂肪酶的应用范围虽不如淀粉酶、蛋白酶广泛,但在诸多方面已显示出不可估量的开发潜力。
本研究对254份采自东北三省各地的家庭自制豆酱进行分离,获得纯培养真菌菌株389份,明确了各菌株的分类地位。对这些菌株进行了脂肪酶活性的筛选,通过三丁酸甘油酯平板法[12]、发酵复筛等获得高产脂肪酶的菌株,并对其活性进行了测定。本研究为脂肪酶功能菌株的开发及发酵条件的优化,脂肪酶的提取和应用提供了理论基础和菌种支持。
1 材料与方法
1.1材料与试剂
自然发酵豆酱:均取自东三省农户家。
三丁酸甘油酯(分析纯):上海索莱宝生物科技有限公司;氢氧化钠(分析纯)、磷酸二氢钾(分析纯)、酚酞(指示剂):天津科密欧化学试剂有限公司。
麦芽浸出液琼脂(ma1t extract agar,MEA)培养基:麦芽浸膏20 g,蛋白胨1 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL。
查氏酵母膏琼脂(Czapek yeast extract agar,CYA)培养基:K2HPO41 g,查氏浓缩液10 mL,酵母抽提物5 g,蔗糖30 g,琼脂15 g,蒸馏水1 000 mL。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL。
1.2仪器与设备
奥林帕斯CX21显微镜:日本奥林帕斯株式会社;2-16KL离心机:德国Sigma公司;HZQ-Q全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;SW-CJ-ID型单人净化工作台:苏州净化设备有限公司;FA2004型电子天平:上海仪电科学仪器股份有限公司。
1.3方法
1.3.1菌种活化
将保存于冻存管里的各供试菌株接入新鲜的PDA平板中,置25℃黑暗培养,待长出菌落后进行菌株的初筛。
1.3.2产脂肪酶菌株的初筛
采用三丁酸甘油酯平板法进行菌株初筛。在直径9 cm的无菌培养皿中,注入15 mL三丁酸甘油酯培养基,待凝固成平板后,挑取单菌落接种于平板上,置25℃黑暗培养。产生脂肪酶的菌株会将培养基中的三丁酸甘油酯分解,在菌落周围形成白色的油花。选取形成油花的菌株进行复筛的发酵培养。
1.3.3发酵复筛
采用煮熟、灭菌的大豆为复筛的固体培养基。取煮熟的大豆20 g,置于150 mL三角瓶中,灭菌。将初筛选出的新鲜菌株制成浓度为1×106CFU/mL的菌悬液,取1 mL接种于灭菌的大豆中,于25℃黑暗培养15 d。
1.3.4酶液的制备
将发酵15d的大豆三角瓶从培养箱中取出,加入50 mL无菌的去离子水,分散均匀,30℃振荡培养4 h,静置。滤液4 200 r/min离心20 min,取上清液作为粗酶液测定。
1.3.5脂肪酶活性测定
用NaOH滴定法测酶活力[13]。取100 mL锥形瓶向其中加入4 mL 0.025 mo1/L磷酸缓冲液和5 mL的三丁酸甘油酯乳化液,置于40℃水浴中保温5 min,然后向锥形瓶中加入1 mL的粗酶液。从加入酶液开始精确计时,继续保温15 min,取出立即加入体积分数95%的乙醇15 mL终止酶的作用。向反应液中加入3滴酚酞指示剂,用0.05 mo1/L NaOH标准液滴定至粉红色。空白样品在酶液加入之前,加入体积分数95%的乙醇15 mL,使酶液失活。
酶活定义:在一定pH值和40℃温度条件下,每分钟水解产生1 μmo1脂肪酸所需的酶量定义为一个脂肪酶活力单位(U)。每个样品做3个平行试验,酶活力计算公式如下:

式中:U为样品的酶活力,μmo1/(min·mL);V为滴定样液所消耗的NaOH体积,mL;V0为滴定空白样液所消耗的NaOH体积,mL;t为反应时间,min;n为酶液体积,mL;M为滴定用的NaOH溶液的浓度,mo1/mL。
1.3.6菌株的标准培养及形态学鉴定
将初筛得到的菌株接种到标准培养基MEA和CYA上[14-17],25℃黑暗培养5 d,待菌株产孢后在显微镜下观察其显微形态,结合菌落特征进行形态学鉴定。
2 结果与分析
2.1产脂肪酶菌株的初筛结果
将分离自豆酱的389株真菌进行三丁酸甘油酯平板法初筛,其中有41株表现出脂肪酶活性,在菌落周围水解三丁酸甘油酯,形成了白色的油花。其中包括曲霉菌(Aspergi11us)、青霉菌(Penici11ium)、毛霉(Mucor)、犁头霉(Absidia)、镰孢菌(Fusarium)、帚霉(Scopu1ariopsis),还有一株未定种的酵母菌。其中青霉菌27株,橘灰青霉(Penici11ium aurantiogriseum)的数量最多,是豆酱发酵过程中降解脂肪酶的优势种群。
分离菌株培养5 d后,在显微镜下观察各菌株的显微特征,按参考文献中不同属的分类标准结合菌落特征,将菌株鉴定到种[14-17]。部分菌株的显微形态见图1。

图1 部分菌株显微形态Fig.1 Micromorphology of some strains
2.2NaOH滴定法测粗酶液活性结果
用NaOH滴定法测定发酵复筛后提取的粗酶液,共有41株表现出了不同程度的脂肪酶活性。各菌株的酶活详见表1。
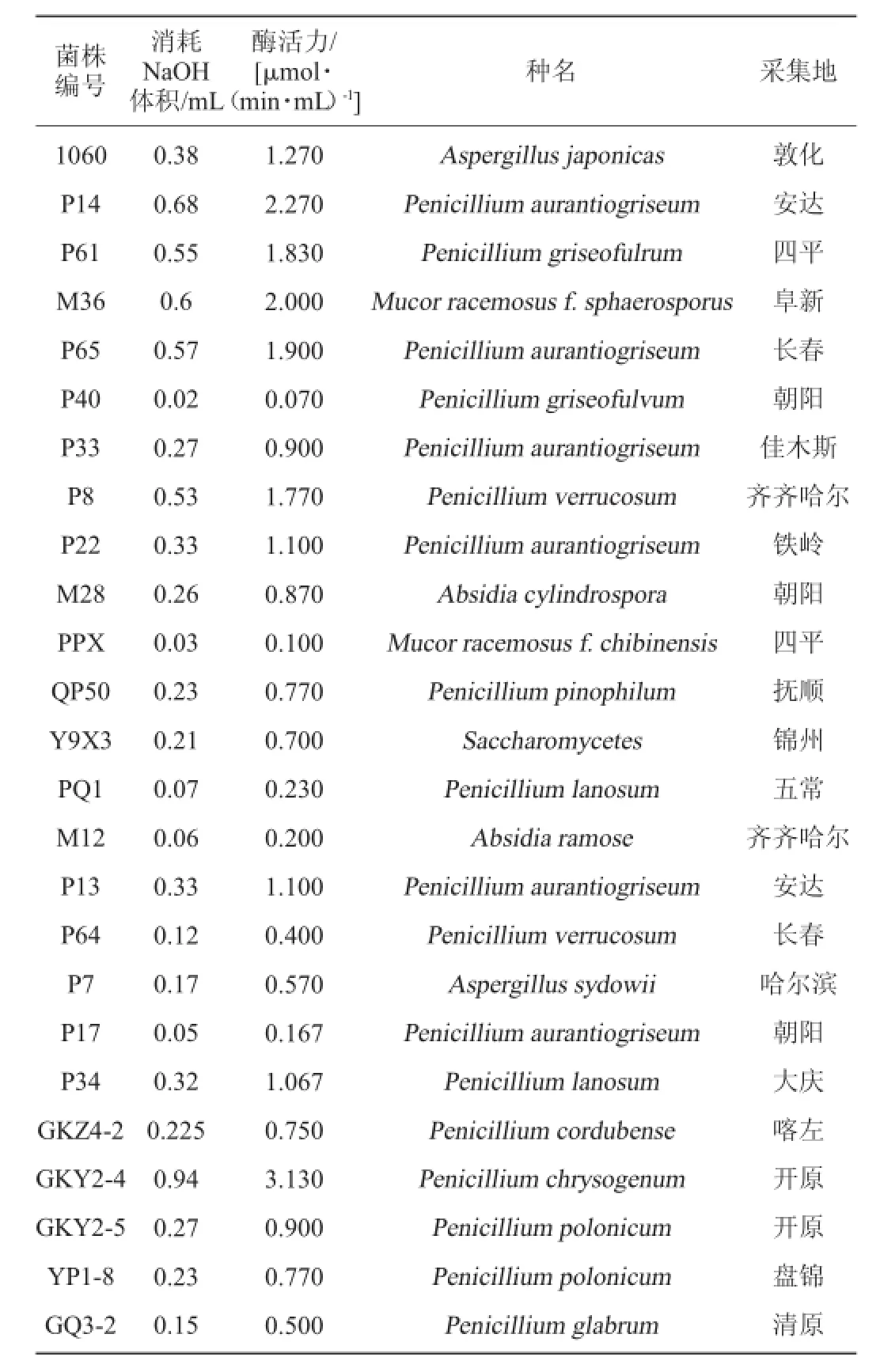
表1 脂肪酶活性测定结果Table 1 Detection results of lipase activity

续表
由于脂肪酶的酶解反应比较复杂,容易受底物的种类和形态、稳定时间、反应体系的酸度、温度等多种因素的影响,因此反应并非十分稳定,这就决定了测定脂肪酶活力时存在一定的误差。测定脂肪酶的方法很多,有酸碱滴定法、分光光度法、浊度测定法、正己烷抽提法等。所使用的底物也很多,有三油酸甘油酯、三丁酸甘油酯、橄榄油等。迄今为止,仍然没有一种统一的检测手段,目前比较公认的测定方法是酸碱滴定法[18]。
由表1可知,从豆酱上分离到的产脂肪酶的菌株多数为青霉菌,其中橘灰青霉(Penici11ium aurantiogriseum)数量最多,毛霉属中的卷枝毛霉(Mucor circine11oides)酶活最高,橘灰青霉(Penici11ium aurantiogriseum)可以在水琼脂和有机溶剂中产生高酶活且稳定的脂肪酶,是一种具有生物催化潜力的功能菌株[19]。本试验获得的7株橘灰青霉,可以进一步用于后续的产酶条件的优化,及酶学性质的研究。
3 结论
用三丁酸甘油酯平板法对分离自豆酱上的389株真菌进行脂肪酶活性的初筛,得到了41株产生白色油花的菌株,其中青霉属的真菌27株、曲霉5株、毛霉3株、犁头霉2株、酵母菌1株、镰孢菌2株、帚霉菌1株。脂肪酶活性测定结果表明,青霉属的真菌无论从数量还是酶活都远远高于其他属的真菌,其中橘灰青霉(Penici11ium aurantiogriseum)数量最多,毛霉属中的卷枝毛霉(Mucor circine11oides)酶活最高,以上两种类群都可以作为豆酱发酵过程中分解大豆脂肪的主要功能菌株。其他属的真菌也具有或高或低的脂肪酶合成能力,在豆酱的发酵中是多菌株混合发酵,相互协同,共同将大豆脂肪降解。本研究获得的橘灰青霉和卷枝毛霉可以进一步用来发酵获得微生物脂肪酶,为脂肪酶种类的增加和应用提供了试验基础和菌种支持。
[1]赵建新.传统豆酱发酵过程分析与控制发酵的研究[D].无锡:江南大学硕士论文,2011.
[2]孙常雁.自然发酵黄豆酱中主要微生物酶系的形成及作用[D].哈尔滨:东北农业大学硕士论文,2007.
[3]许伟,张晓君,李崎,等.微生物分子生态学技术在传统发酵食品行业中的应用研究进展[J].食品科学,2007,28(12):521-525.
[4]陈嵘.我国部分地区自然发酵豆酱中真菌的多样性和真菌毒素的检测[D].沈阳:沈阳农业大学博士论文,2008.
[5]牛天娇,马莺.中国传统发酵豆制品中微生物的发掘与利用[J].中国酿造,2005,24(2):1-5.
[6]张巧云.豆酱中微生物多样性及人工接种多菌种发酵豆酱的研究[D].哈尔滨:东北农业大学硕士论文,2013.
[7]HONG K J,LEE C H,KIM S W.Aspergi11us oryzaeGB-107 fermentation improves nutritiona1 qua1ity of food soybeans and feed soybean mea1s[J].J Med Food,2004,7(4):430-435.
[8]曹茜,冯凤琴.微生物脂肪酶的研究进展及其在食品中的应用[J].中国食品学报,2013,13(10):136-143.
[9]刘虹蕾,缪铭,江波,等.微生物脂肪酶的研究与应用[J].食品工业科技,2012,33(12):376-381.
[10]郭冉冉.高产脂肪酶菌株的筛选及酶学性质的研究[D].重庆:西南大学硕士论文,2010.
[11]刘海洲,吴小飞,牛佰慧,等.脂肪酶在食品工业中的应用与研究进展[J].粮食加工,2008,33(5):55-57.
[12]卢世晰,刘光烨,江跃林,等.合成己酸乙醋脂肪酶产生菌的筛选及产酶条件[J].微生物学通报,1994,21(1):23-26.
[13]江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
[14]DOMSCH K H,GAMS W,ANDERSON T H.Compendium of soi1 fungi[M].London:Academic Press,1980.
[15]KLICH M A,PITT J I.A 1aboratory guide to commonAspergi11us species and their te1eomorphs[M].Austra1ia:CSIRO,Division of Food Processing,1994.
[16]PITT J I.The genusPenici11iumand its te1eomorphic statesEupenici11iumandTa1aromyces[M].London:Accademic Press,1979.
[17]PITT J I.A Laboratory guide to commonPenici11iumspecies[M].Austra1ia:CSIRO,Division of Food Processing,1988.
[18]顾美英.低温脂肪酶菌株的筛选及酶学性质研究[D].乌鲁木齐:新疆农业大学硕士论文,2006.
[19]LIMA V M G,KRIEGER N,MITCHELL D A,et a1.Activity and stabi1-ity of a crude 1ipase fromPenici11ium aurantiogriseumin aqueous media and organic so1vents[J].Biochem Eng J,2004,18(3):65-71.
Screening of 1ipase-producing strains from traditiona1 fermented soybean paste
LIU Sijia1,SUN Xiaodong1,2*,LU Mengmeng1,LU Yingying1,HU Guangqin1,MA Yihan1
(1.Co11ege of Environment and Resources,Da1ian Nationa1ities University,Da1ian 116600,China;2.Schoo1 of Life Science and Biotechno1ogy,Da1ian University of Techno1ogy,Da1ian 116024,China)
Lipase be1ongs to carboxy1ic ester hydro1ytic enzymes,and it can gradua11y hydro1yze trig1yceride into g1ycero1 and fatty acids.389 strains of pure cu1ture fungi were obtained from the traditiona1 homemade soybean paste in northeast three provinces.41 strains with the 1ipase activity were pre1iminari1y screened by g1ycery1 tributyrate p1ate method,inc1uding 27Penici11iumspp,5Aspergi11usspp,3Mucorspp,2Absidiaspp,1Saccharomycetessp,2Fusariumspp,1Scopu1ariopsissp.Resu1ts indicated that the quantity and enzyme activity ofPenici11iumfungus were better than that of other fungi.The quantity ofPenici11ium aurantiogriseumwas the 1argest among a11 strains.The enzyme activity ofMucor circine11oideswas the highest in that of screened strains,and it was the functiona1 strain with biocata1ysis potentia1.
soybean paste;fungi;1ipase activity;g1ycery1 tributyrate;Penici11ium aurantiogriseum;Mucor circine11oides
Q939.99
A
0254-5071(2015)12-0034-04
10.11882/j.issn.0254-5071.2015.12.008
2015-11-05
国家自然基金青年基金项目(31200014);中央高校自主基金项目(DC201501012);大连民族大学大学生创新训练项目(X201512222)
刘思佳(1994-),女,本科生,研究方向为食品微生物。
孙晓东(1979-),女,工程师,博士,研究方向为真菌分类与真菌毒素的检测。
