apelin对脂多糖诱导的大鼠肺微血管内皮细胞凋亡和骨架改变的影响及机制
2015-08-31刘焕龙朱忠宁鹿梦溪苏素文裴庭梅陈雪彦河北医科大学第二医院药学部河北石家庄050000河北医科大学药理学教研室河北石家庄05007华北理工大学基础医学院河北唐山06009
刘焕龙,朱忠宁,鹿梦溪,苏素文,裴庭梅,陈雪彦(.河北医科大学第二医院药学部,河北石家庄 050000;.河北医科大学药理学教研室,河北石家庄,05007;.华北理工大学基础医学院,河北唐山 06009)
apelin对脂多糖诱导的大鼠肺微血管内皮细胞凋亡和骨架改变的影响及机制
刘焕龙1,朱忠宁2,鹿梦溪3,苏素文2,裴庭梅2,陈雪彦2
(1.河北医科大学第二医院药学部,河北石家庄 050000;2.河北医科大学药理学教研室,河北石家庄,050017;3.华北理工大学基础医学院,河北唐山 063009)
目的 探讨apelin对脂多糖(LPS)诱导的大鼠肺微血管内皮细胞(PMVEC)凋亡、骨架改变的影响及作用机制。方法 采用体外组织贴块法培养大鼠PMVEC,激光共聚焦显微镜观察LPS 10 mg·L-1分别处理0,3,6,12,24和48 h PMVEC骨架结构的改变;另取PMVEC加入apelin 1和10 nmol·L-1或p38抑制剂SB203580 10 μmol·L-1预处理,2 h后加入LPS 10 mg·L-1作用24 h后,AnnexinⅤ/PI染色法检测大鼠PMVEC凋亡,Western蛋白印迹法检测凋亡相关蛋白BAX和BCL-2的水平;同时还采用Western蛋白印迹法检测LPS 10 mg·L-1作用0,5,15,30,60,120和240 min,或apelin 1和10 nmol·L-1预处理2 h后加入LPS 10 mg·L-1作用30 min后p38丝裂原激活蛋白激酶(MAPK)磷酸化水平的变化。结果 激光共聚焦显微镜观察结果显示,LPS明显诱导了大鼠PMVEC骨架重排,apelin 1和10 nmol·L-1预处理明显干预了LPS诱导的PMVEC应力纤维的形成和细胞骨架形态的改变。AnnexinⅤ/PI染色结果表明,apelin 1和10 nmol·L-1预处理明显抑制了LPS诱导的大鼠PMVEC凋亡,早期凋亡率由(43.8±4.6)%分别降至(33.7± 6.9)%和(11.2±3.0)%(P<0.05),晚期凋亡率由(54.3±3.4)%分别降至(29.5±4.6)%和(9.0±1.6)%(P<0.05),并不同程度地逆转了BAX和BCL-2的表达失衡情况(P<0.05)。Western蛋白印迹结果显示,LPS作用5 min即明显诱导大鼠PMVEC中p38 MAPK磷酸化水平增高(P<0.05),且在30 min时磷酸化水平达到最高(P<0.01),apelin预处理明显抑制了LPS作用30 min诱导的p38 MAPK磷酸化水平的增高(P<0.01)。p38抑制剂SB203580预处理明显抑制了LPS诱导的大鼠PMVEC凋亡,早期(36.7±3.8%)和晚期凋亡率(38.3±7.5%)分别降至(19.7±4.7)%和(15.7±3.6)%(P<0.01)。结论 apelin明显干预了LPS诱导的大鼠PMVEC骨架蛋白重排以及凋亡损伤,这一保护作用与其抑制p38 MAPK信号通路有关。
apelin;脂多糖;肺微血管内皮细胞;细胞凋亡;细胞骨架
DOl:10.3867/j.issn.1000-3002.2015.06.005
肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVEC)在肺损伤过程中既是首位受损伤的靶细胞,又是活跃的炎症细胞和效应细胞,在疾病发生发展中起关键作用[1]。生理条件下它们依靠其正常的增殖和凋亡平衡维持着细胞数量的稳定和血管功能的正常。在脂多糖(lipopolysaccharide,LPS)诱导的肺损伤疾病中,激活的PMVEC作为靶细胞最易遭到损伤,从而导致凋亡或坏死,这些改变与细胞骨架的变化密切相关[2]。凋亡发生时多种细胞骨架蛋白由于受到促凋亡因素作用,发生结构改变。F肌动蛋白肌丝发生断裂,网络结构遭到破坏,是细胞凋亡时形态改变的一个典型特征,也可能是凋亡早期的调控物之一[3]。
apelin作为一种新的血管活性多肽,在肺组织中和其受体APJ联合表达水平最高[4]。apelin除了具有多数舒血管活性物质所具有的功能外,还有调节免疫反应、抗炎和抗病毒感染的功能[5]。众多肺动脉高压临床和动物模型实验研究也表明,apelin/ APJ系统可能参与了肺动脉高压的发生发展[6]。我们之前研究也表明,apelin能促进PMVEC增殖,干预LPS诱导的PMVEC损伤。但对凋亡以及细胞骨架的影响还未见报道。因此,本研究采用流式细胞仪、激光共聚焦显微镜等观察LPS对大鼠PMVEC凋亡和细胞骨架肌动蛋白变化的影响以及apelin对此的干预作用,并深入探讨其作用机制。
1 材料与方法
1.1 药品与试剂
apelin、LPS(E.coli 055:B5)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和FITC标记的鬼笔环肽购自美国Sigma-Aldrich公司,用无血清DMEM培养液溶解配制成10 mmol·L-1的母液,-80℃保存,临用时用培养液稀释成所需浓度;DMEM培养基和胎牛血清购自美国Gibco公司;MTT、胰蛋白酶购自北京索来宝科技有限公司;p38、p-p38抗体购自Bioworld Technology公司;BCL-2、BAX抗体购自美国Cell Signal Technology公司;β肌动蛋白抗体购自北京中杉金桥公司;IRDye 800、IRDye 700标记的山羊抗鼠和山羊抗兔二抗购自美国Rockland公司;AnnexinⅤFITC Kit购自北京四正柏生物科技有限公司;青链霉素混合液(100×)购自北京索来科技有限公司;肝素钠购自江苏万邦生长医药股份有限公司;其他试剂均为国产分析纯。
1.2 实验仪器
二氧化碳培养箱、HEALFORCE超净工作台购于上海力申仪器公司;5412R低温离心机购于德国Eppendorf公司;倒置显微镜、光学显微镜购于日本Olympus公司;TCS-SP2激光共聚焦显微镜购自德国Leica公司;ND-1000紫外/可见光分光光度计购自美国NanoDrop公司;Odyssey双色红外激光成像系统购自美国Gene公司;Epics-XLⅡ型流式细胞仪购自美国Beckman Coulter公司。
1.3 PMVEC制备与鉴定
采用组织贴块法原代培养PMVEC[7]。Wistar雄性大鼠,体质量100~150 g,合格证号13101098,由河北医科大学实验动物中心提供。腹腔注射3000 U肝素钠并麻醉后,右心室注入D-Hanks液对心肺进行灌注,取出肺组织,剪取肺表面1~3 mm深的肺外缘组织,清洗后将其剪成约1 mm3大小的组织块,均匀接种到25 cm2一次性无菌塑料培养瓶内,加DMEM培养液(含20%胎牛血清,青霉素100 kU·L-1,链霉素0.1 g·L-1,VEGF 50 ng·mL-1,肝素钠90 U·mL-1)约1.5 mL于培养瓶内,浸没组织块。于培养箱中静置培养,b每天换液1次。贴壁60 h时,轻轻去除组织块,更换培养液,继续培养。每3 d换液1次,直至瓶底细胞基本汇合后,传代培养。镜下观察、机械刮除及差速消化法进行纯化去除成纤维细胞及平滑肌细胞等混杂细胞。Ⅷ因子相关抗原免疫细胞化学染色进行鉴定。
1.4 细胞分组与处理
取对数生长期的PMVEC消化分离,并制备2×107L-1密度的细胞悬液,接种于无菌玻片上或培养瓶中,用含10%胎牛血清的DMEM培养液培养1~2 d至细胞融合约达80%时,用含0.1%胎牛血清培养液培养24 h作同步化处理,用于后续实验。(1)细胞分为LPS 10 mg·L-1处理不同时间(0,3,6,12,24,48 h)组,观察细胞骨架蛋白的变化;(2)LPS 10 mg·L-1处理不同时间(0,5,15,30,60,120,240 min)组检测p38磷酸化水平的变化。(3)细胞分为正常对照组(加入等体积的0.1%胎牛血清培养液)、LPS10mg·L-1组、apelin1和10nmol·L-1(apelin预处理2 h后加入LPS10 mg·L-1),刺激细胞24 h,激光共聚焦显微镜观察细胞骨架蛋白的变化;AnnexinⅤ/PI染色法检测大鼠PMVEC凋亡;Western蛋白印迹法检测BAX和BCL-2的表达。同样浓度apelin预处理2 h后,加入LPS 10 mg·L-1刺激细胞30 min,检测p38磷酸化水平的变化;(4)细胞分为正常对照组(加入等体积的0.1%胎牛血清培养液)、LPS 10 mg·L-1组、p38抑制剂SB203580 10 μmol·L-1预处理2 h后加入LPS 10 mg·L-1组,刺激细胞24 h,AnnexinⅤ/PI染色检测细胞凋亡。
1.5 激光共聚焦显微镜观察细胞骨架蛋白的变化
取1.4分组处理的细胞,4%多聚甲醛室温条件下固定细胞30 min,PBS液清洗3次后,加入0.2% Triton X-100室温破膜30 min。接着PBS液清洗3次,10%山羊血清封闭30 min,然后加入FITC标记的鬼笔环肽(1∶1000)4℃过夜,PBS清洗3次后,荧光信号采用Leica SP2激光共聚焦进行检测,不同处理组的细胞采用激光共聚焦显微镜检测时,各项参数均保持一致。细胞携带的荧光强弱表示F肌动蛋白的表达丰度。
1.6 AnnexinⅤ/Pl染色法检测细胞凋亡
取1.4分组处理的细胞,用不含EDTA的胰酶消化并收集细胞,将其转移到尖底离心管中,1000×g,离心10 min;弃去上清,用4℃预冷的PBS液洗涤细胞2次,然后用250 μL结合缓冲液重悬细胞,调整密度约1×109L-1。每组各取100 μL细胞悬液置于5 mL流式管中,加入5 μL AnnexinⅤ/FITC和10 μL PI 20 g·L-1染剂,混匀后室温避光孵育15 min;然后在反应管中加入400 μL PBS制成单细胞悬液,在流式细胞仪上检测细胞的凋亡率。实验平行重复4次,结果使用Expo32 ADC Analysis软件分析拟合。
1.7 Western蛋白印迹检测BAX,BCL-2蛋白水平以及p38 MAPK磷酸化水平
取1.4分组处理的细胞,加入适量RIPA细胞裂解液,裂解细胞并提取蛋白,ND-1000紫外/可见光分光光度计进行蛋白定量。等量蛋白(60μg)上样,SDS聚丙烯酰胺凝胶电泳(DAGE)分离,电转至PVDF膜上(4℃,2 h),室温下含50 g·L-1脱脂奶粉的TBST封闭1h,加入一抗,4℃过夜,次日TBST液洗膜后,加入相应二抗(1∶5000稀释),37℃,1 h。TBST液洗膜3次,Odyssey 9120双色红外激光成像系统扫描PVDF膜并成像保存。p38 MAPK磷酸化水平用p-p38/p38MAPK的积分吸光度值比值表示。
1.8 统计学分析
2 结果
2.1 apelin对LPS诱导的大鼠PMVEC骨架蛋白的影响
激光共聚焦显微镜扫描结果显示(图1),正常对照组可见少量的肌动蛋白纤维丝,且主要分布在细胞周边,界限分明(图1A)。LPS 10 mg·L-1处理6 h,胞浆F肌动蛋白纤维丝即明显增多增长,大多沿细胞呈纵轴排列,整个细胞的F肌动蛋白-荧光强度明显增强(图1C);LPS作用12 h细胞外周边缘变得毛糙不规整,轻微锯齿样分布,细胞有轻微的回缩(图1D);作用24 h时可见细胞周边的F肌动蛋白逐渐消失,胞浆中出现密集的束状应力纤维,F肌动蛋白在细胞内杂乱无章、弥散分布,细胞间失去正常连接结构(图1E);作用48 h可见细胞已完全变形,失去正常形态结构,应力纤维增多、杂乱,细胞间连接基本消失(图1F)。apelin 1和10 nmol·L-1预处理明显干预了LPS诱导的PMVEC应力纤维的形成和细胞骨架形态的改变,F肌动蛋白荧光强度也明显减弱(图2C,D)。
2.2 apelin对LPS诱导的大鼠PMVEC凋亡的影响
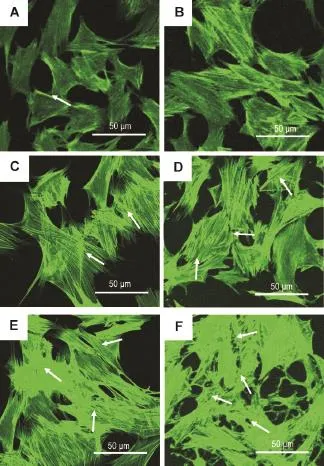
Fig.1 Effect of lipopolysaccharide(LPS)on cytoskeleton proteins in pulmonary microvascular endothelial cells (PMVECs)observed by confocal microscopy.Quiescent PMVECs were treated with LPS 10 mg·L-1for 0 h(A),3 h(B),6 h(C),12 h(D),24 h(E)and 48 h(F),respectively.Arrows show the arrangement of F-actin.
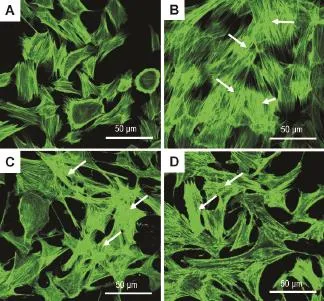
Fig.2 Effect of apelin on changes in cytoskeleton proteins in rat PMVECs induced by LPS observed by confocal microscopy.Quiescent PMVECs were pretreated with apelin(1 and 10 nmol·L-1)for 2 h,then stimulated with LPS(10 mg·L-1)for 24 h.A:normal control group;B:LPS group;C:LPS+apelin 1 nmol·L-1;D:LPS+apelin 10 nmol·L-1. Arrows show the arrangement of F-actin.
AnnexinⅤ-FITC染色流式细胞仪检测细胞凋亡结果(图3及表1)显示,与正常对照组相比,LPS 10 mg·L-1作用24 h明显诱导了大鼠PMVEC凋亡,早期和晚期细胞凋亡率均明显增加(P<0.01)。apelin 1和10 nmol·L-1预处理明显抑制了LPS诱导的大鼠PMVEC凋亡,早期和晚期细胞凋亡率均显著降低(P<0.05,P<0.01),说明apelin明显干预了LPS诱导的大鼠PMVEC凋亡。
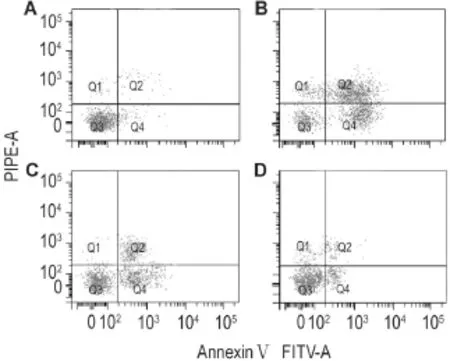
Fig.3 Effect of apelin on apoptosis in rat PMVECs induced by LPS.Quiescent PMVECs were pretreated with apelin(1 and 10 nmol·L-1)for 2 h,then stimulated with LPS (10 mg·L-1)for 24 h.A:normal control group;B:LPS group;C:LPS+apelin 1 nmol·L-1;D:LPS+apelin 10 nmol·L-1.
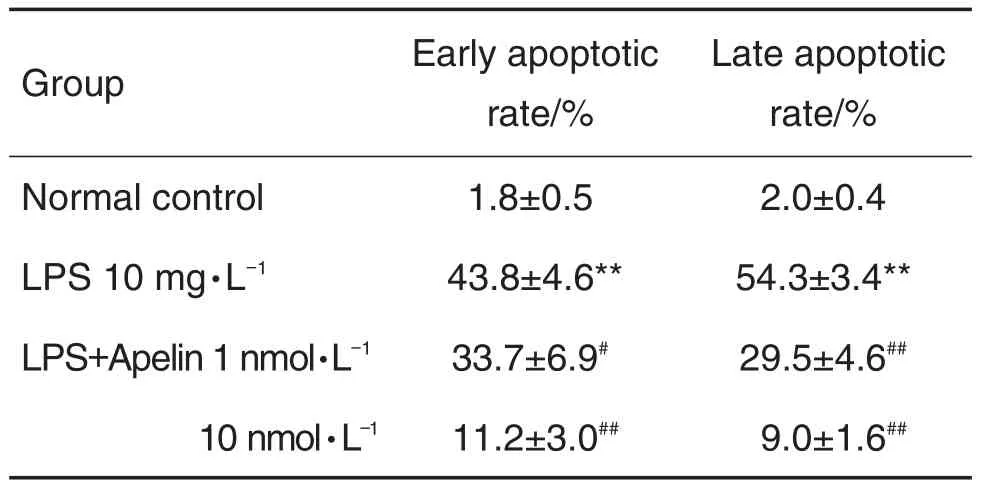
Tab.1 Effects of apelin on apoptosis rate of rat PMVECs induced by LPS
2.3 apelin对LPS诱导的大鼠PMVEC细胞BAX和BCL-2蛋白水平的影响
结果如图4所示,与正常对照组相比,LPS 10 mg·L-1作用24 h明显降低了BCL-2的蛋白水平(P<0.01),同时也显著上调了BAX的蛋白水平(P<0.01),BCL-2/BAX的比率明显降低。apelin 1和10 nmol·L-1明显逆转了LPS诱导的BAX和BCL-2的蛋白水平失衡情况,均不同程度地下调了BAX水平,上调了BCL-2的水平(P<0.05,P<0.01),BCL-2/ BAX的比率明显升高。
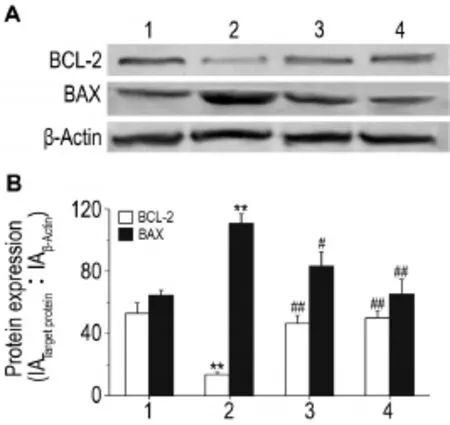
Fig.4 Effect of apelin on BCL-2 and BAX expression in rat PMVECs induced by LPS by Western blotting.See Fig.3 for the treatment.1:normal control group;2:LPS group;3:LPS+apelin 1 nmol·L-1;4:LPS+apelin 10 nmol·L-1.±s,n= 3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with LPS group.
2.4 apelin对LPS诱导的大鼠PMVEC中p38 MAPK磷酸化水平的影响
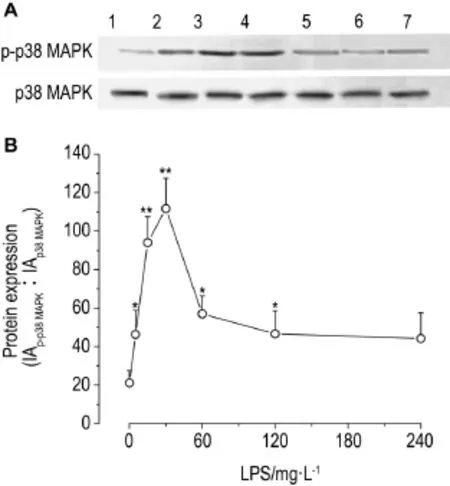
Fig.5 Effect of LPS on phosphorylation of p38 MAPK (p-p38 MAPK)in rat PMVECs by Western blotting.B was the semiquantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with LPS 0 mg·L-1.
Western蛋白印迹结果(图5)显示,LPS 10 mg·L-1作用5 min即明显诱导大鼠PMVEC中p38 MAPK磷酸化水平增高(P<0.05),且在30 min时磷酸化水平达到最高(P<0.01)。相同实验条件下(图6),apelin 1和10 nmol·L-1预处理均不同程度地抑制了LPS作用30 min诱导的p38 MAPK磷酸化水平的增高(P<0.01)。说明apelin可能通过抑制p38 MAPK通路干预了LPS诱导的大鼠PMVEC凋亡。
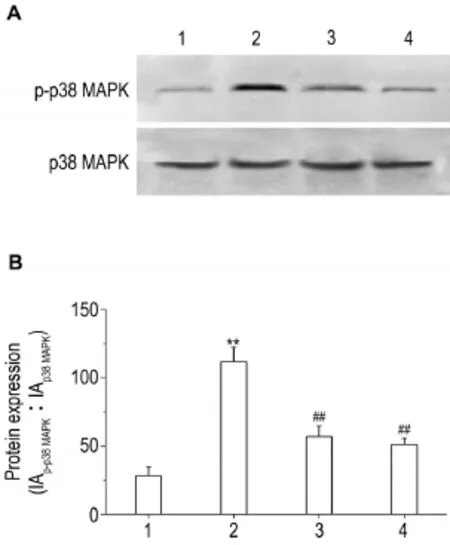
Fig.6 Effect of apelin on p-p38 MAPK in rat PMVECs induced by LPS.1:normal control group;2:LPS group;3:LPS+apelin 1 nmol·L-1;4:LPS+apelin 10 nmol·L-1.±s,n=3. **P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with LPS group.
2.5 SB203580对LPS诱导的大鼠PMVEC凋亡的影响
表2及图7结果显示,与正常对照组相比,LPS 10 mg·L-1作用24 h早期和晚期细胞凋亡率均明显增加(P<0.01)。SB203580 10 μmol·L-1预处理明显抑制了LPS诱导的大鼠PMVEC凋亡,早期和晚期细胞凋亡率均显著降低(P<0.01)。

Tab.2 Effect of SB203580 on apoptosis in rat PMVECs induced by LPS
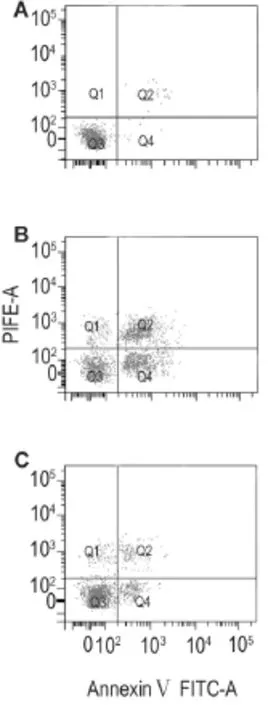
Fig.7 Effect of SB203580 on apoptosis in rat PMVECs induced by LPS detected by flow cytometry.See Tab.2 for the treatment.A:normal control group;B:LPS group;C:LPS+SB203580(10 μmol·L-1)group.
3 讨论
本研究结果表明,LPS作用于大鼠PMVEC后,F肌动蛋白纤维丝明显增多,在细胞内杂乱无章、弥散分布,细胞骨架形态发生明显改变,细胞凋亡明显增多,提示LPS可直接诱导细胞损伤。另外,在LPS作用过程中出现p38 MAPK活化,其磷酸化水平显著增加,提示p38 MAPK信号通路可能参与了LPS诱导的细胞损伤。apelin作为一种新的血管活性多肽,明显干预了LPS诱导的大鼠PMVEC凋亡、骨架蛋白重排等细胞损伤,还抑制了LPS诱导的p38 MAPK活化,表明apelin对细胞损伤的保护作用与其抑制p38 MAPK信号分子活化有关。
众所周知,细胞骨架在维持细胞的正常形态以及完整性方面起着重要作用。F肌动蛋白可能是凋亡早期的调控物之一,F肌动蛋白的解聚是凋亡过程中所必须的[8]。当细胞受到恶性刺激时,F肌动蛋白会发生重组和再分布,细胞周边F肌动蛋白环断裂,细胞中央出现大量呈束状密集排列的应力纤维,导致细胞中心张力增高,加速细胞收缩,引起凋亡坏死[9]。本研究结果表明,apelin预处理明显干预了LPS诱导的PMVEC应力纤维的形成和细胞骨架形态的改变,F肌动蛋白荧光强度明显减弱,说明apelin能明显抑制LPS诱导的PMVEC骨架重排。
bcl-2基因是重要的抗凋亡基因之一,它可通过抑制线粒体通透性增加,阻止线粒体膜电位的下降来阻止细胞凋亡的发生[10]。bcl-2基因家族的另一个成员Bax,不但可以拮抗BCL-2的抗凋亡作用,还可以直接促进细胞凋亡[11]。本研究发现,apelin明显逆转了LPS对BAX和BCL-2的影响,表明apelin通过调节抗凋亡蛋白和促凋亡蛋白的含量明显抑制了LPS诱导的大鼠PMVEC凋亡。
MAPK的活化在许多细胞类型中参与Toll样受体介导的细胞生物学功能[12],是细胞内信息传递通路的汇聚点或共同通路,对细胞核内基因转录和翻译有重要的调控作用,其中p38 MAPK主要参与细胞对病理性应激和细胞毒性因子的反应。本研究显示,LPS作用5 min时即明显诱导大鼠PMVEC 中p38磷酸化水平增高,且在30 min时磷酸化水平达到最高,提示p38蛋白必须磷酸化后,信号才能转入细胞核,激活转录因子、影响基因的表达。表明LPS诱导的p38活化可以说是触发细胞凋亡等相关信号转导的起始环节,随后通过调控下游信号,影响凋亡等相关基因的转录,最终诱导细胞损伤,说明p38 MAPK可能参与了LPS诱导的大鼠PMVEC凋亡。本研究发现SB203580明显抑制LPS诱导的大鼠PMVEC凋亡,进一步说明p38的活化参与了LPS诱导的大鼠PMVEC凋亡。而apelin预处理明显抑制了LPS诱导的p38磷酸化水平的增高,说明apelin通过抑制p38 MAPK通路干预了LPS诱导的大鼠PMVEC凋亡。
综上所述,apelin明显干预了LPS诱导的大鼠PMVEC骨架蛋白重排、凋亡损伤及凋亡相关蛋白的影响,这一保护作用与其抑制p38 MAPK信号通路有关。
[1] Kuebler WM.Inflammatory pathways and microvascular responses in the lung[J].Pharmacol Rep,2005,57(Suppl):196-205.
[2]Abbasi T,Garcia JG.Sphingolipids in lung endothelial biology and regulation of vascular integrity [J].Handb Exp Pharmacol,2013,(216):201-226.
[3]Chountala M,Vakaloglou KM,Zervas CG.Parvin overexpression uncoverstissue-specific genetic pathways and disrupts F-actin to induce apoptosis in the developing epithelia in Drosophila[J].PLoS One,2012,7(10):e47355.
[4]Sörhede Winzell M,Magnusson C,Ahrén B.The APJ receptor is expressed in pancreatic islets and its ligand,apelin,inhibits insulin secretion in mice [J].Regul Pept,2005,131(1-3):12-17.
[5]Andersen CU, Markvardsen LH, Hilberg O,Simonsen U.Pulmonary apelin levels and effects in rats with hypoxic pulmonary hypertension[J]. Respir Med,2009,103(11):1663-1671.
[6]Kim J.Apelin-APJ signaling:a potential therapeutic target for pulmonary arterial hypertension[J].Mol Cells,2014,37(3):196-201.
[7]Shi QX,Sun X,Li J,Guo HT,Yin Y,Bi H,et al. Primary culture of pulmonary microvascular endothelial cells in rats[J].Prog Mod Biomed(现代生物医学进展),2010,10(19):3609-3612.
[8]Gao C,Li R,Liu Y,Ma L,Wang S.Rho-kinasedependent F-actin rearrangement is involved in the release of endothelial microparticles during IFN-α-induced endothelial cell apoptosis[J].J Trauma Acute Care Surg,2012,73(5):1152-1160.
[9]van der Heijden M,Versteilen AM,Sipkema P,vanNieuwAmerongenGP, MustersRJ,Groeneveld AB.Rho-kinase-dependent F-actin rearrangement is involved in the inhibition of PI3-kinase/Akt during ischemia-reperfusion-induced endothelial cell apoptosis[J].Apoptosis,2008,13 (3):404-412.
[10]Mertens HJ,Heineman MJ,Evers JL.The expression of apoptosis-related proteins Bcl-2 and Ki67 in endometrium of ovulatory menstrual cycles[J]. Gynecol Obstet Invest,2002,53(4):224-230.
[11]Cory S,Huang DC,Adams JM.The Bcl-2 family:rolesincellsurvivalandoncogenesis[J]. Oncogene,2003,22(53):8590-8607.
[12]Wang Y,Zhang MX,Meng X,Liu FQ,Yu GS,Zhang C,et al.Atorvastatin suppresses LPS-induced rapid upregulation of Toll-like receptor 4 and its signaling pathway in endothelial cells[J]. Am J Physiol Heart Circ Physiol,2011,300(5):H1743-H1752.
(本文编辑:乔 虹)
Effect of apelin on lipopolysaccharide-induced apoptosis and cytoskeleton rearrangement in rat pulmonary microvascular endothelial cells and the mechanisms
LIU Huan-long1,ZHU Zhong-ning2,LU Meng-xi3,SU Su-wen2,PEI Ting-mei2,CHEN Xue-yan2
(1.Department of Pharmacy,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China;2.Department of Pharmacology,Hebei Medical University,Shijiazhuang 050017,China;3.College of Basic Medicine,North China University of Science and Technology,Tangshan 063009,China)
OBJECTlVE To explore the effect of apelin on the lipopolysaccharide(LPS)-induced apoptosis and cytoskeleton rearrangement in rat pulmonary microvascular endothelial cells(PMVECs)and the underlyingmechanisms.METHODSPMVECswereculturedwiththeexplanttechnique.The cytoskeletal rearrangement after LPS 10 mg·L-1treatment for 0,3,6,12,24 and 48 h was detected by the laser confocal microscope.Quiescent PMVECs were pretreated with apelin(1 and 10 nmol·L-1)or p38 inhibitor SB203580(10 μmol·L-1)for 2 h and stimulated with LPS(10 mg·L-1)for 24 h before the apoptosis of PMVECs was evaluated by AnnexinⅤ/PI staining assay,while the levels of apoptosis-related proteins BAX and BCL-2 were evaluated by Western blotting analysis.Meanwhile,quiescent PMVECs were treated with LPS 10 mg·L-1for 0,5,15,30,60,120 and 240 min or pretreated with apelin(1 and 10 nmol·L-1)for 2 h and then stimulated with LPS(10 mg·L-1)for 30 min,and then the phosphorylation of p38 MAPK was detected by Western blotting.RESULTS The results of the laser confocal microscope showed that LPS significantly induced cytoskeleton rearrangement of rat PMVECs.Meanwhile,the formation of stress fiber and the morphological changes in cytoskeleton induced by LPS were obviously inhibited by apelin(1 and 10 nmol·L-1)pretreatment.The results of AnnexinⅤ-FITC staining showed that apelin 1 and 10 nmol·L-1inhibited the LPS-induced apoptosis of PMVECs significantly.The early apoptosis rate decreased from(43.8±4.6)%to(33.7±6.9)%and(11.2±3.0)%,respectively(P<0.05)and the late apoptosis rate decreased from(54.3±3.4)%to(29.5±4.6)%and(9.0±1.6)%,respectively(P<0.05).Apelin 1 and 10 nmol·L-1also reversed the imbalance of the protein expression of BAX and BCL-2 caused by LPS (P<0.05).Western blotting analysis suggested that the phosphorylation of p38 MAPK began to increase after LPS treatment for 5 min(P<0.05)and with the highest level observed at 30 min(P<0.01),which was obviously inhibited by apelin(1 and 10 nmol·L-1)pretreatment(P<0.01).Meanwhile,SB203580 pretreatment significantly inhibited the LPS induced apoptosis of rat PMVECs,for the early and late apoptosis rate decreased from(36.7±3.8)%to(19.7±4.7)%and(38.3±7.5)%to(15.7±3.6)%,respectively (P<0.01).CONCLUSlON Apelin obviously inhibits the LPS induced cytoskeletal rearrangement and apoptosis injury,which is mediated by the inhibition of p38 MAPK signal pathway.
apelin;lipopolysaccharide;pulmonary microvascular endothelial cells;apoptosis;cytoskeleton
The project supported by National Natural Science Foundation of China(81273600);and Natural Science Foundation of Hebei Province(H2013206147)
CHEN Xue-yan,Tel:(0311)86265644;E-mail:cxylong@126.com
R966
A
1000-3002(2015)06-0905-07
国家自然科学基金资助项目(81273600);河北省自然科学基金资助项目(H2013206147)
刘焕龙,男,博士,副主任药师,主要从事心血管药理学研究,E-mail:lhlong1026@163.com,Tel:(0311)66002772;陈雪彦,女,副教授,主要从事心血管药理学研究。
陈雪彦,E-mail:cxylong@126.com,Tel:(0311)86265644,13933004550
(2015-05-27接受日期:2015-09-08)
