过氧化氢诱导血管平滑肌细胞内质网应激及其自噬作用
2015-08-31李松岩刘师兵吉林医药学院科研实验室附属医院吉林吉林303
李松岩,郭 敏,王 烟,于 洋,刘师兵,徐 冶(吉林医药学院.科研实验室,.附属医院,吉林吉林 303)
过氧化氢诱导血管平滑肌细胞内质网应激及其自噬作用
李松岩1,郭 敏2,王 烟1,于 洋1,刘师兵1,徐 冶1
(吉林医药学院1.科研实验室,2.附属医院,吉林吉林 132013)
目的 观察过氧化氢(H2O2)诱导血管平滑肌细胞(VSMC)内质网应激及其自噬的作用机制。方法 体外培养VSMC细胞,加入H2O250,100,200,400,600,800,1200和1600 μmol·L-1分别作用12和24 h后,MTT法检测H2O2对VSMC的抑制率;倒置相差显微镜观察H2O2对VSMC细胞形态的影响;采用间接免疫荧光法检测自噬相关蛋白微管相关蛋白轻链3(LC3)和泛素结合蛋白p62的表达,采用Western蛋白印迹法检测自噬相关蛋白人卷曲螺旋肌球蛋白样BCL2相互作用蛋白/自噬基因(Beclin-1)和LC3、内质网应激相关蛋白葡萄糖调节蛋白78(GRP78)和CCAAT-增强子结合蛋白同源蛋白(CHOP)及自噬上游信号通路哺乳动物西罗莫司(雷帕霉素)靶蛋白(mTOR)的表达。结果 MTT结果显示,H2O250~1600 μmol·L-1作用VSMC细胞12和24 h,VSMC细胞存活率明显降低,12和24 h的IC50分别为(597.2±2.3)和(447.4± 1.7)μmol·L-1。倒置相差显微镜观察可见H2O2400 μmol·L-1组VSMC收缩变圆。H2O2400 μmol·L-1作用VSMC 12 h时,细胞存活率由(97.5±0.1)%下降至(74.4±1.0)%;作用VSMC 24 h,下降至(56.8±0.9)% (P<0.01)。激光共聚焦显微镜检测发现,H2O2400 μmol·L-1作用VSMC 8 h,细胞浆中LC3和p62蛋白随H2O2作用时间的延长表达增加。LC3与p62的共定位显示,H2O2400 μmol·L-1作用8 h最明显。Western蛋白印迹结果表明,H2O2诱导内质网应激相关蛋白GRP78,CHOP和自噬相关蛋白Beclin-1,LC3Ⅱ/LC3Ⅰ的表达显著增加(P<0.01),mTOR的表达显著降低(P<0.01)。结论 H2O2可能通过诱导VSMC内质网应激激活自噬。
自噬;血管平滑肌细胞;过氧化氢;内质网应激
DOl:10.3867/j.issn.1000-3002.2015.06.004
动脉粥样硬化(atherosclerosis,AS)是动脉血管的一种慢性炎症性病变,可引起心脑血管疾病,是严重危害人类健康的头号杀手[1]。近年来,自噬对AS的作用开始受到广泛关注。AS的特点是以炎症细胞浸润和脂质堆积为主要特征的慢性炎症性过程。研究发现,血管内皮细胞、血管平滑肌细胞(vascular smooth muscle cells,VSMC)以及巨噬细胞的自噬在动脉血管病变中起着重要保护作用[2]。
自噬是真核细胞利用溶酶体途径降解自身受损伤的细胞及细胞器和变性蛋白质等生物大分子的一个过程,是在自噬相关基因调控下完成的[3-6]。在AS病变中,VSMC的异常增殖是其主要的病理过程[7]。一些内外源因素的影响使VSMC增殖失控,可引起血管壁的病变[8]。研究表明,自噬可以抑制VSMC增殖[9]。黄英等[10]研究表明,过氧化氢(H2O2)可以诱导VSMC凋亡[11]。研究发现,内质网应激(endoplasmic reticulum stress,ERS)可引起细胞产生凋亡。本研究通过检测ERS相关蛋白和自噬相关蛋白的表达,探讨H2O2对VSMC的作用机制。
1 材料与方法
1.1 药物、试剂和仪器
β肌动蛋白、人卷曲螺旋肌球蛋白样BCL2相互作用蛋白/自噬基因(human coiled-coil myosin-like BCL2-interacting protein,Beclin-1)、葡萄糖调节蛋白78(glucose regulated proteins 78 ku,GRP78)、CCAAT-增强子结合蛋白同源蛋白(C/EBP homologous protein,CHOP)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)兔多克隆抗体均购自美国Santa Cruz公司;新生胎牛血清、杜尔伯科极限必需培养基(dulbecco minimum essential medium,DMEM)购自美国Gibco公司;辣根过氧化物酶(HRP)标记的山羊抗兔相应二抗购自长春德尔塔公司;微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)和p62蛋白兔多克隆抗体购自美国Epotomics公司;PVDF膜购自德国Milipore公司;H2O2、甘氨酸、甲叉丙烯酰胺、Hoechst33342荧光染料等购于北京鼎国公司;四甲基偶氮唑蓝〔3-(4,5-dimethy-2-thiazoly)-2,5-diphenyl-2-tetrazoliumbromide,MTT〕购于美国Sigma公司。
恒温二氧化碳细胞培养箱(日本Sanyo公司),电子分析天平(瑞士梅特勒托利多公司),超净工作台(北京东联哈尔公司),高速台式冷冻离心机(德国Hermle公司),倒置光学显微镜(日本Leica公司),水浴锅(上海精宏实验设备有限公司),Model-680型酶标仪、蛋白电泳仪和蛋白转印仪(美国Bio-Rad公司),脱色摇床(北京六一医学仪器厂),超声细胞粉碎仪(宁波新芝生物科技有限公司),高温高压蒸汽灭菌锅(上海博讯实业有限公司),数码凝胶成像系统(上海天能科技有限公司)。
1.2 细胞、细胞培养和分组处理
购自中国科学院上海细胞库的VSMC为贴壁细胞,用含体积分数为20%新生胎牛血清DMEM培养液,青霉素100 kU·L-1和链霉素0.1 g·L-1,37℃、5%CO2、饱和湿度的培养箱中培养。用0.25%胰蛋白酶消化传代。隔2 d传代1次。取生长状态良好且处于对数生长期的细胞进行实验。调整细胞密度为8×103L-1,接种于96空板,每孔200 μL,随机分为正常对照组、H2O250,100,200,400,600,800,1200和1600 μmol·L-1组,分别处理12和24 h后进行指标检测。
1.3 MTT方法检测细胞存活
取1.2分组处理的细胞,每孔加入200 μL新配制MTT 0.5 mg·L-1,37℃孵育4 h,小心弃去孔中培养液,每孔加入DMSO 150 μL,震荡10 min,Model-680型酶标仪490 nm波长测定吸光度(A490 nm)值。测3次,取平均值。细胞生长抑制率(%)=1-(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4 倒置相差显微镜下观察细胞形态
取对数生长期细胞以1×108L-1密度接种于24孔板中,每孔500 μL,置于37℃,5%CO2细胞培养箱中培养过夜。待细胞长至80%密度,加入H2O2400 μmol·L-1,继续培养12和24 h,同时设正常对照组。各组细胞置于倒置相差显微镜下观察细胞收缩、细胞密度情况,记录活细胞数,并照相。
1.5 间接免疫荧光法检测LC3和p62蛋白的共定位
取高压消毒后无菌盖玻片(10 mm×10 mm)置于24孔板中,取VSMC密度1×108L-1,每孔500 μL接种过夜,次日细胞长至80%密度,实验组加H2O2400 μmol·L-1分别处理4,8和12 h,同时设正常对照组。弃培养基,加入200 μL固定液(4%多聚甲醛)作用10 min,吸去固定液经0.1%Triton PBS作用5 min,PBS 0.01 moL·L-1溶液洗涤,非免疫山羊血清封闭30 min,加入预混的一抗4℃过夜,PBS 0.01 mol·L-1溶液洗涤,加入预混的荧光二抗作用30 min,PBS 0.01 mol·L-1溶液洗涤,抗荧光淬灭剂封片。应用激光共聚焦显微镜观察H2O2400 μmol·L-1作用VSMC 4,8和12 h细胞不同时间LC3和p62蛋白荧光强弱及共定位的变化。应用FV10-ASW软件随机选取视野,统计视野内所有细胞内荧光点个数,以细胞内荧光点个数的平均值作为目标蛋白的表达量。
1.6 Western蛋白印迹法检测Beclin-1,LC3,mTOR,GRP78和CHOP蛋白表达
待VSMC生长状态良好且呈对数生长时,随机分为正常对照组、H2O2400 μmol·L-14,8和12 h组,弃培养液,胰酶消化,离心收集细胞,每瓶加入150 μL蛋白裂解液RIPA,混匀,超声细胞粉碎仪超声细胞2次,每次3~5 s,4℃放置30 min,蛋白裂解液充分裂解细胞后,高速台式冷冻离心机离心收集上清液。Bradford法进行蛋白定量。SDS-PAGE电泳结束后,将蛋白转移到PVDF膜上,膜用5%脱脂奶粉封闭1.5 h,PBST洗3次,加入相应稀释度的一抗,4℃过夜。次日PBST洗3次,加入相应稀释度的HRP标记的二抗,室温摇床孵育1.5 h;PBST 洗5次,ECL显色,扫描纪录。以β-肌动蛋白作为内参照,采用Quantity One软件进行分析处理,以目标蛋白与内参照蛋白的积分吸光度值比值表示蛋白的相对表达量。
1.7 统计学分析
2 结果
2.1 过氧化氢对血管平滑肌细胞存活的影响
如图1所示,H2O2在50~1600 μmol·L-1浓度范围内对VSMC的存活具有明显的抑制作用,且呈现浓度依赖关系(r=0.985,P<0.05)。随着H2O2作用时间的延长,对VSMC存活的抑制作用也逐渐增强,呈现时间依赖关系(r=0.983,P<0.05)。H2O2作用12 h,VSMC的IC50为(447.4±2.3)μmol·L-1;作用24 h,VSMC的IC50为(597.2±1.7)μmol·L-1。表明H2O2可显著抑制VSMC的存活。
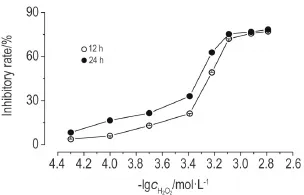
Flg.1 Effect of H2O2on survival of vascular smooth musclecells(VSMCs) detectedby MTTassay. VSMCs were treated with H2O2(50-1600 μmol·L-1)for 12 and 24 h,respectively.±s,n=3.
2.2 过氧化氢对血管平滑肌细胞的生长抑制作用
倒置相差显微镜观察结果显示(图2),随着时间延长,H2O2400 μmol·L-1可明显抑制VSMC的生长,导致细胞收缩变圆,细胞密度变稀薄(图2B,C)。H2O2400 μmol·L-1与VSMC作用12 h时,细胞存活率由(97.5±0.1)%下降至(74.4±1.0)% (P<0.01);H2O2400 μmol·L-1与VSMC作用24 h时,细胞存活率下降至(56.8±0.9)%(n=3,P<0.01)。
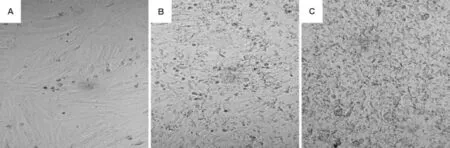
Fig.2 lnhibitory effect of H2O2on VSMCs growth(×250).See Fig.1 for the cell treatment.A:normal control;B:H2O2400 μmol·L-1for 12 h;C:H2O2400 μmol·L-1for 24 h.
2.3 过氧化氢对血管平滑肌细胞LC3和p62蛋白表达的影响
激光共聚焦显微镜及其定量分析(图3)结果显示,与正常对照组(图4A1-D1)相比,H2O2400 μmol·L-1与VSMC作用4,8和12 h后,LC3蛋白(图4B2~B4)和p62(图4C2~C4)均呈散在分布,荧光强度和共定位(图4D2~D4)随H2O2作用时间延长而递增。与正常对照组相比,8 h组细胞内LC3绿色荧光点数由(2.1±0.2)×103个增加到(29.8±0.3)×103个(P<0.01,图4B3),细胞内p62红色荧光点数由(1.6±0.1)×103个增加到(41.2± 0.7)×103个(P<0.05,图4C3),细胞内共定位黄色荧光点数由(1.8±0.1)×103个增加到(36.3±0.2)× 103个(P<0.01),共定位现象明显增强(图4D3)。表明H2O2400 μmol·L-1与VSMC作用8 h时,产生自噬最强。
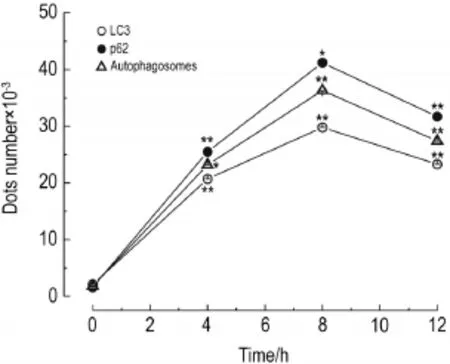
Fig.3 Effect of H2O2on VSMCs autophagy.See Fig.4 for the dots in the cells.LC3:microtubule-associated protein light chain 3.±s,n=3.*P<0.05,**P<0.01,compared with normal control group.
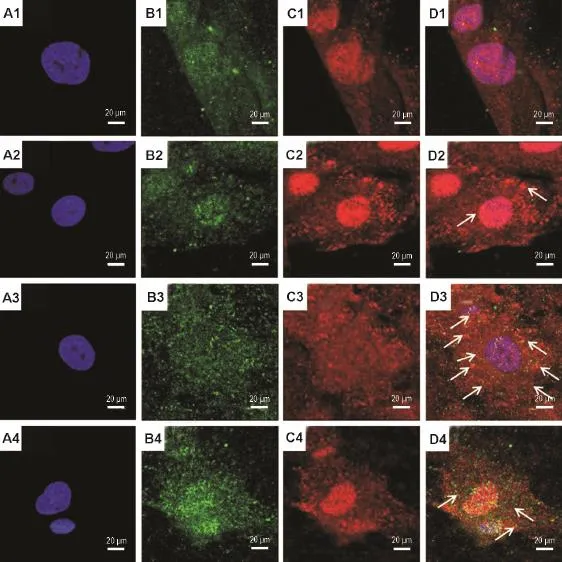
Fig.4 Effect of H2O2on LC3(B)and p62(C)protein co-localization in VSMCs by Hoechst(A),FlTC(B)and Rodamin123(C)staining.D was the merge of B and C.1:normal control;2:H2O2400 μmol·L-1for 4 h;3:H2O2400 μmol·L-1for 8 h;4:H2O2400 μmol·L-1for 12 h.Arrows indicate colocalization of LC3 and p62.
2.4 过氧化氢对血管平滑肌细胞Beclin-1,LC3,mTOR,GRP78和CHOP表达的影响
Western蛋白印迹法结果(图5)所示,H2O2400 μmol·L-1组自噬标志蛋白Beclin-1和LC3Ⅱ/Ⅰ的表达显著上升(P<0.01),内质网应激相关蛋白GRP78和CHOP表达显著上升(P<0.01)。说明ERS可以诱导VSMC细胞产生自噬。结果显示,随着H2O2作用时间的延长,Beclin-1蛋白表达逐渐增强,LC3Ⅱ/LC3Ⅰ比值逐渐增高,蛋白表达增强,且mTOR蛋白的表达逐渐减弱。
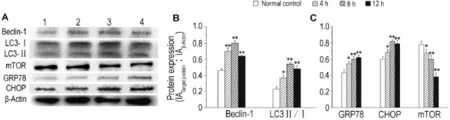
Fig.5 Effect of H2O2on expression of Beclin-1,LC3,glucose regulated proteins 78 ku(GRP78),C/EBP homologous protein(CHOP)and mammalian target of rapamycin(mTOR)in VSMCs detected by Western blotting.A:lane 1,normal control;lane 2,4 h;lane 3,8 h;lane 4,12 h.B and C were the semiquantitative results of A.±s,n=3.*P<0.05,**P<0.01,compared with normal control group.
3 讨论
本研究结果表明,H2O2作用VSMC后,细胞存活率下降,细胞收缩变圆,细胞密度也明显下降,存在时间和浓度依赖性。揭示作为活性氧家族一员的H2O2作用于VSMC,导致细胞应激损伤,这与已报道结果一致[10-11]。
自噬是哺乳动物中高度保守的清除、降解和回收利用细胞内生物大分子和受损细胞器的重要代谢通路,对维持细胞稳态有重要作用[12]。本研究通过共聚焦显微镜观察到,LC3和p62蛋白荧光强度随着H2O2作用时间的延长呈递增趋势。H2O2与VSMC作用8 h时,自噬标志蛋白LC3与p62荧光呈现点状聚集,有明显细胞内共定位现象。而Western蛋白印迹结果表明,H2O2诱导了VSMC Beclin-1和LC3Ⅱ蛋白表达增强,表明VSMC自噬被活化。进一步研究结果发现,有可能是肌醇需求酶1(inositol requiring enzyme 1,IRE1)-c-jun氨基端激酶(c-jun N-terminal kinase,JNK)途径发挥了一定的作用。IRE1-JNK途径是自噬的上游控制分子,可被多种刺激所诱导,如生长因子或营养变化,从而对应激产生反应,包括低氧和氧化应激[13]。在细胞中,Beclin-1的活化和Akt/mTOR信号途径的抑制与自噬的诱导活化有关联[14]。内质网是哺乳动物细胞内重要的膜性细胞器,其主要功能是参与蛋白质的折叠和修饰及Ca2+的贮存和释放。在一些生理病理或外界因素下均可诱导ERS[15]。本研究结果显示,H2O2作用VSMC增加了Beclin-1蛋白的表达,并且H2O2处理活化了GRP78和CHOP蛋白表达,与此同时Akt/mTOR信号途径也受到抑制。这可能是H2O2作用VSMC后,诱导VSMC产生ERS,激活细胞内质网Ca2+信号通道[16]。Ca2+信号通道激活,抑制mTOR信号通路。在这种多信号通路调节的情况下使VSMC细胞产生自噬,表明H2O2可通过诱导VSMC的ERS产生自噬。
综上所述,H2O2能诱导VSMC的ERS,通过激活Ca2+通道,抑制mTOR的表达,从而诱导细胞自噬。VSMC的凋亡,可导致AS斑块帽的破裂,促进AS进程。而自噬可抑制AS斑块的发展[17]。通过控制自噬的发生和发展来控制AS斑块的发展,最终达到治疗动脉硬化的目的,还需进一步研究。
[1]Xu YL.Atherosclerosis-achronicinflammatory process[J].Chin J Arterioscler(中国动脉硬化杂志),2001,9(2):93-95.
[2]Wei DH,Jia XY,Liu YH,Guo FX,Tang ZH,Li XH,et al.Cathepsin L stimulates autophagy and inhibits apoptosis of ox-LDL-inducedendothelialcells:potential role in atherosclerosis[J].Int J Mol Med,2013,31(2):400-406.
[3]Kijanska M,Peter M.Atg1 kinase regulates early and late steps during autophagy[J].Autophagy,2013,9(2):249-251.
[4]Takahashi Y,Meyerkord CL,Hori T,Runkle K,Fox TE,Kester M,et al.Bif-1 regulates Atg9 trafficking by mediating the fission of Golgi membranes during autophagy[J].Autophagy,2011,7(1):61-73.
[5]Jaber N,Zong WX.ClassⅢPI3K Vps34:essential roles in autophagy,endocytosis,and heart and liver function[J].Ann N Y Acad Sci,2013,1280:48-51.
[6]Shaid S,Brandts CH,Serve H,Dikic I.Ubiquitination and selective autophagy[J].Cell Death Differ,2013,20(1):21-30.
[7]Yang Z,Klionsky DJ.Eatenalive:a history of macroautophagy[J].Nat Cell Biol,2010,12(9):814-822.
[8]Majeski AE,Dice JF.Mechanisms of chaperonemediated autophagy[J].Int J Biochem Cell Biol,2004,36(12):2435-2444.
[9]Zhu HM,Chen R,Xue F,ST YP,Fan XF,Gong YS,et al.Effect of autophagy inhibitor chloroquine on the proliferation of PASMCs induced by hypoxia [J].Chin J Appl Physiol(中国应用生理学杂志),2014,30(1):8-12.
[10]Huang Y,Lu XW,Li WM,Zhang J,Jiang MR. Effect of hydrogen peroxide to vascular smooth muscular cells[J].Chin J Exp Surg(中华实验外科杂志),2004,21(4):403-405.
[11]Kim AJ,Shi Y,Austin RC,Werstuck GH.Valproate protects cells from ER stress-induced lipid accumulation and apoptosis by inhibiting glycogen synthase kinase-3[J].J Cell Sci,2005,118(Pt 1):89-99.
[12]Jin S,White E.Role of autophagy in cancer:managementofmetabolicstress[J].Autophagy,2007,3(1):28-31.
[13]Bjørkøy G,Lamark T,Pankiv S,Øvervatn A,Brech A,Johansen T.Monitoring autophagic degradation of p62/SQSTM1[J].Methods Enzymol,2009,452:181-197.
[14]Pattingre S,Espert L,Biard-Piechaczyk M,Codogno P. RegulationofmacroautophagybymTORand Beclin 1 complexes[J].Biochimie,2008,90(2):313-323.
[15]Paglin S,Lee NY,Nakar C,Fitzgerald M,Plotkin J,Deuel B,et al.Rapamycin-sensitive pathway regulates mitochondrialmembranepotential, autophagy,and survival in irradiated MCF-7 cells[J].Cancer Res,2005,65(23):11061-11070.
[16]Høyer-Hansen M,Bastholm L,Szyniarowski P,Campanella M,Szabadkai G,Farkas T,et al. Control of macroautophagy by calcium,calmodulindependent kinase kinase-beta,and Bcl-2[J].Mol Cell,2007,25(2):193-205.
[17]Razani B,Feng C,Coleman T,Emanuel R,Wen H,Hwang S,et al.Autophagy links inflammasomes to atherosclerotic progression[J].Cell Metab,2012,15(4):534-544.
(本文编辑:乔 虹)
Autophagy and endoplasmic reticulum stress of primary vascular smooth muscle cells triggered by hydrogen peroxide
LI Song-yan1,GUO Min2,WANG Yan1,YU Yang1,LIU Shi-bing1,XU Ye1
(1.Medical Research Laboratory,2.The Affliated Hospital of Jilin Medical University,Jilin 132013,China)
OBJECTlVE To observe the effect of the autophagy and endoplasmic reticulum stress (ERS)in vascular smooth muscle cells(VSMCs)with hydrogen peroxide(H2O2).METHODS The VSMCs were incubated with different concentrations of H2O2(50,100,200,400,600,800,1200 and 1600 μmol·L-1)for 12 and 24 h.The cell viability was determined by MTT assay.The cell morphology was observed under an inverted phase contrast microscope.The expression of autophagy related protein ubiquitin binding protein p62 and microtubule-associated protein light chain 3(LC3)was detected by indirect immunofluorescence.Western blotting was used to detect autophagy related protein human coiled-coil myosin-like BCL2-interacting protein(Beclin-1),LC3 and mammalian target of sirolimus Rapamycin(mTOR),as well as the expression of endoplasmic reticulum stress(ERS)related protein glucose regulated proteins 78 ku(GRP78)and C/EBP homologous protein(CHOP).RESULTS MTT results showed that H2O2inhibited the growth of VSMCs cells.The half inhibitory concentration(IC50)was 597.2±2.3 and(447.4±1.7)μmol·L-1at 12 and 24 h,respectively.The results of the inverted phase contrast microscope showed that VSMCs in H2O2group shrinked and turned into smaller round cells. The cell survival rate declined from(97.5±0.1)%in normal control group to(74.4±1.0)%and(56.8± 0.9)%in H2O2400 μmol·L-1at 12 and 24 h,respectively.The results of the laser scanning confocal microscope showed that H2O2400 μmol·L-1increasedthe expressionof LC3andp62 protein in a cytoplasmic time-dependent manner,and increased the colocalization of LC3 and p62,especially at 8 h.The results of Western blotting demonstrated that H2O2increased the expression of ERS related protein GRP78 and CHOP,autophagy related protein Beclin-1 and LC3Ⅱ/LC3Ⅰ(P<0.01),and decreased mTOR(P<0.01)in VSMCs.CONCLUSlON H2O2induces autophagy through ERS in VSMCs.
autophagy;vascular smooth muscle cells;hydrogen peroxide;endoplasmic reticulum stress
The project supported by Bureau of Education″Twelve-five″scientific and Technological Research Projects of Jilin Province(2013361);and Youth Physician Research Program of Affiliated Hospital of Jilin Medical College(2014-3)
XU Ye,E-mail:xuye_9707@163.com
R966
A
1000-3002(2015)06-0899-06
吉林省教育厅十二五科学技术研究项目(吉教科合字[2013]第361号);吉林医药学院附属医院青年医师科研课题(院资[2014-3]号)
李松岩,男,硕士,助理实验师,主要从事预防兽医学研究,E-mail:lisongyan888@163.com;徐 冶,男,教授,主要从事肿瘤化学药物治疗敏感性与耐药研究。
徐 冶,E-mail:xuye_9707@163.com
(2015-05-21接受日期:2015-07-28)
