补骨脂素和异补骨脂素在大鼠和人肝微粒体的酶促动力学
2015-08-31阳海鹰钟玉环庄笑梅抗毒药物与毒理学国家重点实验室军事医学科学院毒物药物研究所北京100850
阳海鹰,钟玉环,陈 琳,李 桦,庄笑梅(抗毒药物与毒理学国家重点实验室,军事医学科学院毒物药物研究所,北京 100850)
补骨脂素和异补骨脂素在大鼠和人肝微粒体的酶促动力学
阳海鹰,钟玉环,陈琳,李桦,庄笑梅
(抗毒药物与毒理学国家重点实验室,军事医学科学院毒物药物研究所,北京 100850)
目的 研究中药有效成分补骨脂素和异补骨脂素的细胞色素P450(CYP)酶促动力学特征,比较其结构和种属差异,为体内药代动力学特征的预测提供科学依据。方法 建立补骨脂素和异补骨脂素的液相色谱串联质谱(LC-MS/MS)检测方法,在优化人和大鼠肝微粒体孵育体系和评价体外代谢稳定性的基础上,进行了代谢稳定性和酶促动力学研究,应用非线性回归法计算最大反应速率(Vmax)和米氏常数(Km)。结果 应用建立的LC-MS/MS检测方法,补骨脂素、异补骨脂素在肝微粒体孵育液中定量范围为0.1~50.0 μmol·L-1,线性关系良好,精密度和准确度等满足检测要求。体外代谢稳定性研究显示,当底物浓度为1 μmol·L-1,蛋白浓度为0.5 g·L-1,孵育40 min内,补骨脂素和异补骨脂素在大鼠和人肝微粒体呈线性消除,体外半衰期分别为74.5,95.0,74.5和173.3 min。补骨脂素在大鼠和人肝微粒体中的Vmax分别为:(1.140± 0.080)μmol·min-1·g-1蛋白,(0.620±0.060)μmol·min-1·g-1蛋白;Km分别为(12.9±0.3)μmol·L-1和(7.4±1.3)μmol·L-1。异补骨脂素在大鼠和人肝微粒体中的Vmax分别为(0.251±0.012)μmol·min-1·g-1蛋白和(0.103± 0.014)μmol·min-1·g-1蛋白;Km分别为:(3.0±0.4)μmol·L-1和(3.4±0.7)μmol·L-1。结论 补骨脂素和异补骨脂素的CYP酶促动力学特征及代谢稳定性具有一定的种属和结构差异,在大鼠两者基于CYP酶的代谢清除过程可能相似。而在人体,异补骨脂素的CYP代谢清除可能慢于补骨脂素,导致药代动力学特征的差异。
补骨脂素;异补骨脂素;肝微粒体;细胞色素P450酶系统;药代动力学
DOl:10.3867/j.issn.1000-3002.2015.06.008
中药补骨脂为豆科植物补骨脂(Psoralea corylifolia L.)的果实,性温,味辛,具补肾助阳之功效。补骨脂素(psoralen,PRN)和异补骨脂素(isopsoralen,IPRN)是补骨脂的主要有效成分,具有抗肿瘤、诱导细胞凋亡和抗过敏等功效[1]。PRN 和IPRN还是多种中药制剂中的重要组成成分,主要的临床应用是治疗白癜风、银屑病等皮肤顽疾。口服PRN加紫外线照射的光化学疗法自1974年首次报告有效治疗银屑病以来,已治愈大量患者,1982年美国FDA批准临床应用该法治疗银屑病[2]。
PRN和IPRN属于呋喃香豆素类化合物,其代谢主要包括7-羟化、内酯环开环等途径[3]。文献报道,这类化合物在体内主要经细胞色素P450酶(cytochrome P-450,CYP)代谢并对CYP酶有抑制或诱导作用,应用人肝微粒体和大鼠肝微粒体研究发现,PRN和IPRN对CYP1A2有较强的抑制作用[4]。因此,研究PRN和IPRN的代谢特征以及与CYP代谢酶的作用,对加深该有效成分药理药效本质及作用机制的认识、指导临床合理用药有重要意义。本研究应用液相色谱串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)分别研究PRN和IPRN在人源和大鼠肝微粒体的CYP酶促动力学特征,比较结构和种属差异的影响,为深入研究PRN和IPRN与CYP酶的相互作用以及体内药代动力学特征预测提供科学数据。
1 材料与方法
1.1 药品与仪器
对照品PRN(纯度99.9%,批号110739-201416)、IPRN(纯度 99.9%,批号 102983-201423)(结构见图1)和内标盐酸普萘洛尔(纯度>99%,批号BCBB9359V)购自中国药品和生物制品检定所;NADPH购自瑞士Roche公司;甲醇和乙腈均为色谱纯,购自美国Sigma公司;水为娃哈哈饮用纯净水(杭州娃哈哈集团有限公司),其他试剂均为分析纯。Agilent 6410 B液质联用仪和ZORBAX SB-C18色谱柱(2.1 mm×50 mm,3.5 μm)为美国Agilent公司产品。
Fig.1 Chemical structures of psoralen(PRN)(A)and isopsoralen(lPRN)(B).
1.2 实验动物
SD大鼠20只,雄性,体质量为180~220 g,由军事医学科学院动物中心提供,动物合格证号:SYXK-(军)2011-0010。
1.3 肝微粒体来源或制备
50人混合肝微粒体(蛋白含量20 g·L-1,批号:34689)购自美国BD Gentest公司。20只雄性SD大鼠混合肝微粒体为实验室自制(差速离心法)[5],应用BCA蛋白检测方法测得蛋白含量10 g·L-1。
1.4 LC-MS/MS定量检测PRN和lPRN
色谱条件:流动相A为含有0.1%甲酸的甲酸铵5 mmol·L-1溶液,B为含有0.1%甲酸的乙腈。洗脱梯度程序为0.0~1.0 min(30%B),1.0~1.5 min (30%B~95%B),1.5~3.5 min(95%B),3.5~4.0 min (95%B~30%B),平衡时间为4.0~4.5 min(30%B),运行时间为4.5 min,流速为0.3 mL·min-1,柱温25℃。内标为盐酸普奈洛尔100 μg·L-1。
质谱条件:ESI源正离子MRM方式检测,毛细管温度300℃,毛细管电压4000 V,PRN和IPRN的检测离子对质荷比为186.7→131.1,碰撞能量为22 V,内标的检测离子对质荷比为260→116.2,碰撞能量为14 V,PRN和IPRN的MS2质谱图见图2。
1.5 PRN和lPRN的肝微粒体温孵和代谢稳定性
肝微粒体体外温孵条件依照本研究室既往报道方法[6]。用磷酸盐缓冲液100 mmol·L-1(K2HPO40.5 mmol·L-1/KH2PO40.5 mmol·L-1,pH=7.4)配置不同浓度的PRN和IPRN溶液(0.5,1.0和5.0 μmol·L-1),加入不同蛋白浓度肝微粒体溶液(0.2,0.5和1.0 g·L-1),与NADPH辅酶液(终浓度1 mmol·L-1)于37℃ 同时预孵育5 min后,将NADPH辅酶液加入含药的肝微粒体溶液中启动反应,继续孵育一定时间(5,10,20,30,40和60 min)后,将终体积为200 μL的孵育样品移至冰上,加入400 μL含内标(100 μg·L-1)的甲醇-乙腈(1∶1)终止反应,涡旋30 s,离心(13 800×g,4℃)10 min,取上清10 μL进样分析。考察不同孵育时间、肝微粒体蛋白浓度和底物浓度对PRN和IPRN代谢稳定性的影响,参考有关原则优化温孵条件[6]。根据预实验结果,选择0.5 g·L-1的肝微粒体蛋白含量,1 μmol·L-1的PRN和IPRN,37℃温孵不同时间(0,5,10,20,40和60 min),计算代谢稳定性。
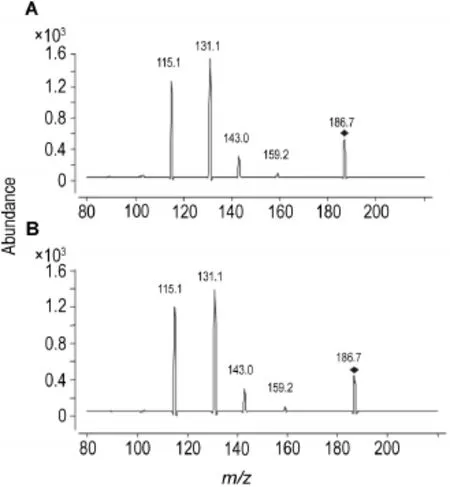
Fig.2 Mass spectra of PRN(A)and lPRN(B).
1.6 PRN和lPRN在大鼠和人肝微粒体的酶促动力学特征
根据代谢稳定性实验结果,系列浓度PRN (0.2,0.5,1.0,2.0,5.0,20.0和50.0 μmol·L-1)和 IPRN(0.2,0.5,1.0,2.0,5.0,20.0和50.0 μmol·L-1)分别在0.5 g·L-1大鼠肝微粒体中孵育20 min,相同系列浓度的PRN在0.5 g·L-1的人肝微粒体中孵育20 min、IPRN在0.5 g·L-1的人肝微粒体中孵育40 min后,将终体积为200 μL的孵育样品移至冰上,并加入400 μL含内标的甲醇-乙腈(1∶1)终止反应,涡旋,离心(13 800×g,4℃)10 min,取上清10 μL进样分析,测定PRN和IPRN的含量,计算代谢速率变化,每个浓度3个平行样品。
用灭活后的空白人或大鼠肝微粒体溶液(0.5 g·L-1)配制0.1,0.5,2.0,10.0,20.0和50.0 μmol·L-1的系列标准溶液各200 μL,加入400 μL含内标(100 μg·L-1)的甲醇-乙腈(1∶1),涡旋30 s,离心(13 800×g,4℃)10 min,取上清10 μL进样分析,测定PRN和IPRN的含量。质控样品浓度分别为0.2,5.0和40.0 μmol·L-1,用与系列标准溶液相同方法处理,连续3 d,每日测定各浓度的3个平行样品,得到日内和日间精密度。为了考察回收率和基质效应,配制含0.2,5.0和40.0 μmol·L-13个浓度的人或大鼠肝微粒体溶液样品,用与系列标准溶液相同方法处理为样品Ⅰ;将空白样品同样方法处理后再加标准溶液,为样品Ⅱ;另取标准溶液,为样品Ⅲ。以同浓度样品I的峰面积与样品Ⅱ的峰面积之比,计算回收率;以同浓度样品Ⅱ的峰面积与样品Ⅲ的峰面积之比,计算基质效应。
1.7 数据处理与分析
体外代谢稳定性:以0时的PRN和IPRN浓度作为100%,其他时间点的浓度与0时的浓度相比得到其剩余百分比。将各时间点剩余百分比的自然对数与相应的孵育时间作图,经直线回归求得斜率(-k),由式(1)得到两药在人和大鼠肝微粒体中的体外代谢半衰期(t1/2)。

酶促动力学参数计算:应用GraphPad Prism version 5.0(GraphPad Software Inc.,La Jolla, CA,USA)软件中的非线性回归分析方法计算PRN和IPRN在大鼠和人肝微粒体酶中代谢降解的米氏常数(Km)和最大反应速率(Vmax),内在清除率Clint=Vmax/Km,实验结果数据均用±s表示。
2 结果
2.1 PRN和lPRN定量检测方法确证
如图3所示,PRN、IPRN和内标对照品色谱峰在大鼠肝微粒体孵育液中的保留时间分别为0.93,0.92和0.76 min,在分析物出峰区域,未见内源性物质干扰。在0.1~50.0 μmol·L-1浓度范围内,PRN 和IPRN的线性关系良好,标准曲线方程分别为:y=0.1127x+0.0235(r2=0.990)和y=0.0867x+0.0045 (r2=0.995)。0.2,5.0和40.0 μmol·L-1质控样品的日内、日间精密度在3.8%和10.9%以内。PRN和IPRN的准确度在92%~113%和101%~109%之间,回收率分别为98%~110%和95%~117%,基质效应在为98%~114%和90%~110%之间,均满足检测要求。
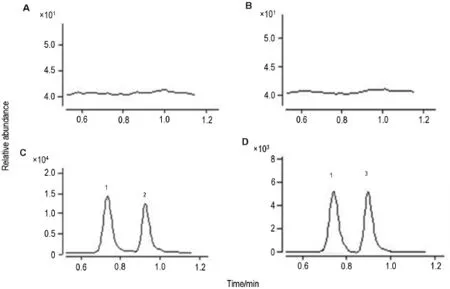
Fig.3 MRM chromatograms of PRN(C),lPRN(D)and internal standard(lS)in rat liver microsomal(RLM)incubations.A,B:blank RLM.1:propranolol hydrochloride(IS);2:PRN;3:IPRN.The analysis of PRN,IPRN and IS was performed on an Agilent 6410 B LC-MS/MS,with a ZORBAX SB-C18column(2.1 mm×50 mm,3.5 μm).The mobile phase was water (containing 5 mmol·L-1ammonium formate and 0.1%formic acid)and acetonitrile(containing 0.1%formic acid)running with the gradient elution.The flow rate was 0.3 mL·min-1.The transition ions m/z 186.7→131.1 and m/z 260→116.2 were selected for the quantification of PRN,IPRN and IS,respectively.
应用人肝微粒体孵育液进行部分验证的结果表明,PRN和IPRN在人肝微粒体中孵育液的基质效应与大鼠微粒体孵育液相似,在97%~116%和91.7%~102%之间,线性范围、精密度和准确度均符合检测要求。
2.2 PRN和lPRN在大鼠和人肝微粒体中代谢稳定性
将不同浓度的PRN和IPRN与不同蛋白浓度的肝微粒体温孵不同时间后,发现当底物浓度在1 μmol·L-1以内、蛋白含量0.5 g·L-1,以及孵育时间在40 min内,两药呈线性消除。两者的体外肝微粒体代谢稳定性结果见图4。由公式(1)计算得到PRN在大鼠和人肝微粒体的t1/2分别为74.5和95.0 min,IPRN的t1/2分别为74.5和173.3 min。由体外代谢稳定性的时间动力学曲线可见,PRN在大鼠和人肝微粒体中孵育20 min时,原型药物代谢消除约20%。IPRN在大鼠肝微粒体中孵育20 min、人肝微粒体中孵育40 min后,原型药物的代谢消除约为20%,以此确定酶动力学研究的孵育时间。
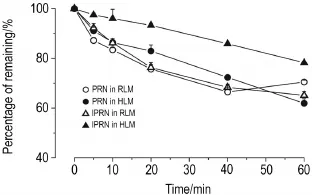
Fig.4 In vitro percentage of substrate remainingtime curves of PRN and lPRN in human or rat liver microsomes(HLM or RLM).1 μmol·L-1PRN and IPRN solutions were mixed with liver microsomes at the protein content of 0.5 g·L-1.The mixtures were added with NADPH 1 mmol·L-1after being pre-warmed at 37°C for 5 min to reach the final volume of 200 μL.After 5,10,20,30,40 and 60 min incubation at 37°C,the reactions were stopped by addition of 400 μL methanolacetonitrile(1∶1)containing 100 μg·L-1IS.After vortexing for 30 s,the sample was centrifuged at 13 800×g for 10 min (4℃).A 10 μL aliquot of the supernatant was analyzed by LC-MS/MS.±s,n=3.
2.3 PRN和lPRN在大鼠和人肝微粒体中酶促动力学比较
应用Eadie-Hofstee作图法处理数据可见,4组酶促动力学都未显示明显的双相动力学特征,初步判断主要是单酶介导的肝代谢。应用非线性回归分析方法拟合PRN和IPRN在人和大鼠肝微粒体中酶促动力学曲线见图5,参数见表1。从结果可见,PRN对大鼠和人肝CYP酶的Km和Vmax均有明显的种属差异,但是Clint没有明显差异。IPRN对大鼠和人肝CYP酶的Km相似,Vmax有明显的差异,因而Clint也表现出明显差异;比较实验结果可见,IPRN在人肝微粒体的Clint明显低于其他3组,PRN在大鼠和人肝微粒体以及IPRN在大鼠肝微粒体中的Clint相似。
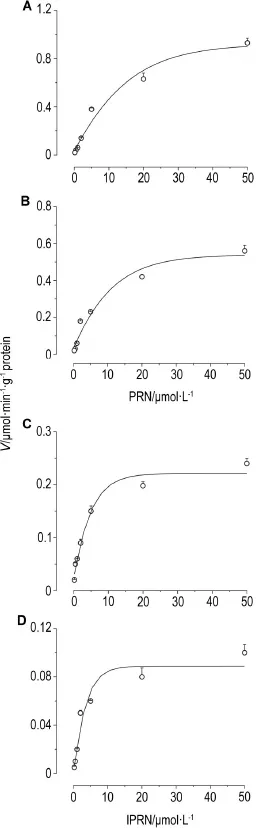
Fig.5 Reaction rate-substrate concentration curves of PRN(A,B)and lPRN(C,D)in HLM(B,D)or RLM(A,C). See Fig.4 for the incubation system and procedure.PRN(0.2,0.5,1.0,2.0,5.0,20.0 and 50.0 μmol·L-1)and IPRN(0.2,0.5,1.0,2.0,5.0,20.0 and 50.0 μmol·L-1),were incubated with RLM or HLM for 20 min,IPRN with HLM for 40 min.RLM and HLM were at the protein content of 0.5 g·L-1.±s,n=3.
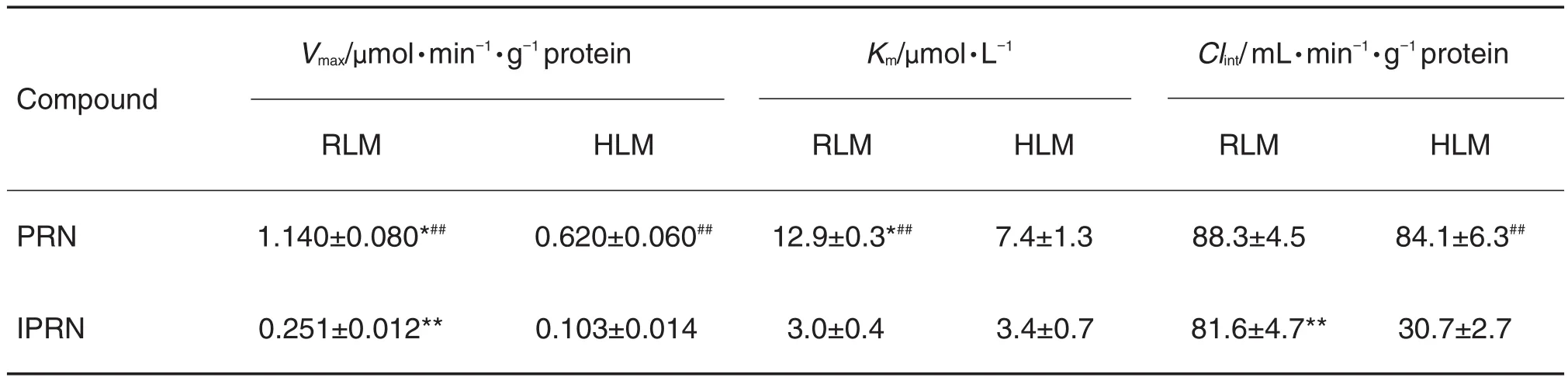
Tab.1 Enzymatic kinetics parameters of PRN and lPRN in HLM or RLM
3 讨论
药物的CYP酶促动力学特征是决定药物代谢性质的重要参数,也是评价药物相互作用潜能的基础[7]。早在30年前,美国制药工业界就试图根据药物在肝微粒体中的酶促动力学参数进行体内代谢动力学的预测[8]。由于酶促动力学研究方法比较成熟,并可应用人源材料(人肝微粒体)通过体外实验获得酶动力学参数(Km和Vmax),因此可快速在人体试验前用最低成本获得肝清除率等重要性质,对新药研发具有重要意义[9]。
本研究首先进行了体外代谢稳定性评价,了解两药的体外肝代谢消除性质,并优化肝微粒体蛋白浓度、底物浓度和孵育时间等孵育条件。比较两药的大鼠和人肝微粒体的代谢稳定性曲线可见,PRN 和IPRN在大鼠微粒体以及PRN在人肝微粒体的消除曲线相似,而IPRN在人肝微粒体的消除曲线较为平缓,明显慢于前3组,此结果与酶促动力学研究中获得的体外清除率相符。
酶促动力学研究主要有两种方法,底物消除法和产物生成法,虽然产物生成法是比较准确测定酶促动力学参数的方法,但必须获得药物代谢转化数据以及产物标准品。相比之下,底物消除法更适用于化合物研究的早期。Youdim等[10]研究发现,两种方法获得的结果除了个别药物代谢通路复杂,会产生3倍的偏差外,其他大部分化合物的Km值都不会有太大的差异。因此,本研究在缺乏代谢产物鉴定和标准品的基础上采用了原型药物消除法进行酶促动力学研究。
在酶促动力学研究中获得的Km和Vmax参数值,除了定义药物的酶促反应性质外,还可为药物体内药代动力学特征的预测提供重要信息。例如,当体内药物浓度远低于Km时,代谢清除通常是线性的,此时清除率Cl约为Vmax/Km;当体内药物浓度高于Km时,药物的体内清除将逐渐超过酶的代谢能力,呈现非线性过程。由本研究的数据可见,PRN和IPRN在人肝微粒体中的Km分别为7.4和3.4μmol·L-1,口服含有这两种成分的中药后,吸收入血的浓度很可能低于该水平,药物将以线性速率消除。但是,当多种药物合并使用,PRN和IPRN的代谢受到抑制时,血药浓度可能大幅增加,应注意可能出现的非线性药代动力学过程。此外,根据体外内在清除率推算肝清除率,可初步判断肝代谢清除作用对药物体内总清除及生物利用度的贡献。从本研究中获得的内在清除率推算其相应的肝清除率,并与大鼠和人的生理肝血流量(Qhrat=55.2 mL·min-1·kg-1,Qhhuman=20.7 mL·min-1·kg-1)[11]相比后发现,PRN和IPRN在人肝的抽提率分别约为80%和60%;而两者在大鼠肝的抽提率相似约为60%,两者的生物利用度均可能<40%。
代谢酶存在的种属差异,是动物结果难以直接外推到人的主要因素[12]。本研究系统比较了两个化合物在大鼠和人肝微粒体中的代谢稳定性及酶促动力学特征。结果显示,PRN在人肝微粒体CYP酶的Km显著高于大鼠,Vmax低于大鼠,而线性清除率在两个种属间相似。IPRN与人和大鼠肝CYP酶的Km相当,但Vmax有明显差别,因此Clint也有明显差别,在人肝微粒体中Clint显著低于大鼠。结果分析表明,两个化合物在人和大鼠肝微粒体的酶促动力学性质存在种属差异,在应用动物体外结果进行人体外推时,需要注意。
PRN和IPRN是同分异构体,在结构上分别属于线性和角型两类天然呋喃香豆素化合物[13]。由目前研究可见,两者在人和大鼠肝微粒体中,酶促动力学特征均有差别,特别是在人肝微粒体,PRN的代谢清除要明显快于IPRN,提示二者在化学结构上的差异,可能导致其与酶的活性位点结合特性和亲和力的差异,有必要在动物和人体代谢研究中进一步证实。
综上所述,PRN和IPRN在体外大鼠和人肝微粒体孵育体系中的代谢清除呈现明显的种属和结构差异。这些结果为深入研究PRN和IPRN与CYP酶的相互作用,以及应用体外结果对体内药代动力学特征的预测和解释提供科学数据。
[1]Zhai YK,Pan YL,Niu YB,Wu XL,Mei QB. Comparative studies on the differentiation and maturation of rat calvarial osteoblasts by psoralen and isopsoralen in vitro[J].Chin Pharmacol Bull(中国药理学通报),2012,28(3):355-361.
[2]Stern RS.Psoralen and ultraviolet a light therapy for psoriasis[J].N Engl J Med,2007,357(7):682-690.
[3]Regueiro J,Vallverdú-Queralt A,Negreira N,Simal-Gándara J,Lamuela-Raventós RM.Identification and quantification of grape fruit juice furanocoumarin metabolites in urine:an approach based on ultraperformance liquid chromatography coupled to linear ion trap-orbitrap mass spectrometry and solid-phase xtraction coupled to ultraperformance liquid chromatography coupled to triple quadrupoletandem mass spectrometry[J].J Agric Food Chem,2014,62(9):2134-2140.
[4]Zhuang XM,Zhong YH,Xiao WB,Li H,Lu C. Identification and characterization of psoralen and isopsoralen as potent CYP1A2 reversible and time-dependent inhibitors in human and rat preclinical studies[J].Drug Metab Dispos,2013,41 (11):1914-1922.
[5]Hickman D,Wang JP,Wang Y,Unadkat JD. Evaluation of the selectivity of in vitro probes and suitability of organic solvents for the measurement of human cytochrome P450 monooxygenase activities[J].Drug Metab Dispos,1998,26(3):207-215.
[6]Huang XM,Lin QH,Li CZ,Deng JT,Li H.In vitro comparison of rotundine metabolism in liver microsomes of human,dog and rat[J].Chin Pharmacol Bull(中国药理学通报),2009,25(9):1147-11 52.
[7]Wang X,Yin SJ,Li Q,Wang SM,Lou YQ,Zhang GL.Enzyme kinetics of novel antiepileptic drug 3,4-dichlorophenyl-propenoyl-sec.-butylamine in rat liver microsomes in vitro[J].Chin J Clin Pharmacol(中国临床药理学杂志),2013,29(3):211-214,224.
[8]Chen LZ,Sabo JP,Philip E,Rowland L,Mao Y,Latli B,et al.Mass balance,metabolite profile,and in vitro-in vivo comparison of clearance pathways of deleobuvir,a hepatitis C virus polymerase inhibitor[J].Antimicrob Agents Chemother,2015,59(1):25-37.
[9]Zhang Q,Wang GJ.Advances and related issues in the use of in vitro methods to predict metabolic clearance rate of new drugs[J].Acta Pharm Sin(药学学报),2007,42(10):1023-1028.
[10]Youdim K,Dodia R.Comparison between recombinant P450s and human liver microsomes in the determination of cytochrome P450 Michaelis-Menten constants[J].Xenobiotica,2010,40(4):235-244.
[11]Davies B,Morris T.Physiological parameters in laboratory animals and humans[J].Pharm Res,1993,10(7):1093-1095.
[12] Zhang XL,Yue J.Progress in selection of tool drugs and species differences of cytochrome P450 [J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(5):697-701.
[13]Guo LQ,Taniguchi M,Xiao YQ,Baba K,Ohta T,Yamazoe Y.Inhibitory effect of natural furanocoumarins on human microsomal cytochrome P450 3A activity[J].Jpn J Pharmacol,2000,82(2):122-129.
(本文编辑:沈海南 齐春会)
Enzyme kinetics of psoralen and isopsoralen in rat and human liver microsomes
YANG Hai-ying,ZHONG Yu-huan,CHEN Lin,LI Hua,ZHUANG Xiao-mei
(State Key Laboratory of Toxicology and Medical Countermeasures,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTlVE To investigate and compare the enzyme kinetic characters of psoralen (PRN)and isopsoralen(IPRN)in rat and human liver microsomes.METHODS PRN and IPRN in liver microsomes incubates were determined using LC-MS/MS.The enzyme kinetic and metabolic stability ofPRN and IPRN were investigated by employing the optimized rat and human liver microsomes incubations. The Vmaxand Kmvalues were calculated using the nonlinear regression method.RESULTS The quantitative method showed good linearity within the range of 0.1-50.0 μmol·L-1and was suitable for the assay in biological samples.The in vitro elimination was linear with the substrate concentrations lower than 1 μmol,the protein concentration within 0.5 g·L-1,and the incubation time within 40 min.The t1/2values of PRN and IPRN in rat and human liver microsomes were 74.5,95.0,74.5 and 173.3 min,respectively.The Vmaxvalues of PRN in rat and human liver microsomes were(1.140±0.080)μmol·min-1·g-1protein,(0.620±0.060)μmol·min-1·g-1protein,while Kmvalues of PRN in rat and human liver microsomes were(12.9±0.3)μmol·L-1,(7.4±1.3)μmol·L-1,respectively.The Vmaxvalues of IPRN in rat and human liver microsomes were(0.251±0.012)and(0.103±0.014)μmol·min-1·g-1protein,while Kmvalues of IPRN in rat and human liver microsomes were(3.0±0.4)μmol·L-1,(3.4±0.7)μmol·L-1,respectively. CONCLUSlON The enzyme kinetic characters and metabolic stability of PRN and IPRN show species and chemical structures related differences.Interestingly,the metabolic eliminations of PRN and IPRN are similar in rats.However,the metabolic elimination of IPRN in humans involved in CYP enzymes may be much slower than that of PRN.
psoralen;isopsoralen;liver microsomes;cytochrome P-450 enzyme system;pharmacokinetics
The project supported by National Science and Technology Major Project(2012ZX09301003-001-009);National Science and Technology Major Project(2013ZX09J13103-01B);National Science and Technology Major Project(2014ZX09507001003);and National Science and Technology Major Project(2014ZX09J14103-01A)
ZHUANG Xiao-mei,E-mail:xiaomeizhuang@163.com,Tel:(010)66930665
R969.1,R285.5
A
1000-3002(2015)06-0924-07
国家科技重大专项(2012ZX09301003-001-009);国家科技重大专项(2013ZX09J13103-01B);国家科技重大专项(2014ZX09507001003);国家科技重大专项(2014ZX09J14103-01A)
阳海鹰,女,硕士,高级实验师,主要从事药物代谢研究。
庄笑梅,E-mail:xiaomeizhuang@163.com,Tel:(010)66930665
(2015-03-24接受日期:2015-11-09)
